海水养殖尾水处理系统中微生物群落对水处理阶段的响应
2021-02-04胡高宇范建勋肖国强蔡景波柴雪良
胡高宇 张 翔 陈 琛 范建勋 肖国强 蔡景波 柴雪良
(1.浙江省海洋水产养殖研究所,温州 325005;2.浙江省近岸水域生物资源开发与保护重点实验室,温州 325005;3.上海海洋大学水产与生命学院,上海 201306;4.三门县农业农村局,台州 317100)
随着渔业资源的衰退,我国捕捞产业产量已经难以高速增长,为了满足国内对水产品的需求,水产养殖进入快速增长时期。2017年中国渔业统计年鉴[1]显示,全社会渔业产值为12002.91亿元,其中捕捞业占20.06%,养殖业占74.60%,我国水产品市场需求主要由养殖业提供。养殖带来的不仅仅是经济效益,残饵、排泄物、溶解性氮磷等成为养殖过程中的主要污染物。将未经处理的养殖尾水排放至水环境中,会对水环境造成不良影响,因此,如何以较低成本和较高效率来净化养殖尾水将成为绿色养殖业发展的关键问题之一。
生物膜法是养殖尾水处理中最常用也是最经济的方法,因其绿色环保、效果较好等特点受到广泛关注。生物膜法主要是利用滤料表面微生物的生长繁殖来消耗水体中有机物质,以此达到脱氮的目的,目前在水处理工程中以硝化和反硝化作用为核心的技术已经被广泛应用[2,3]。研究表明,通过添加生物填料可以增大生物膜与水体的接触面积,以此加强对水体处理效果[4]。国内对生物填料的研究有较多文献记载,目前研究较多的材料有:陶粒、弹性填料、活性炭、聚乙烯材料、牡蛎壳和藤壶壳等。支莹等[5]以粉煤灰为原料的轻质陶粒作为生物填料,结果发现对COD、TN和TP去除率分别可达83.57%、74.61%和80.17%;王威等[6]利用聚乙烯材料成功培养生物膜之后,24h内氨氮去除率90%以上;以牡蛎壳为填料对城市生活污水处理时,COD去除达到38%,当水力停留时间4h以上时氨氮去除率97%[7];藤壶壳对对虾尾水进行处理时发现,随着填充率的增加处理效果越好[8];李倩等[9]利用弹性毛刷对罗氏沼虾养殖系统的水质进行净化,取得了较好的效果。
盐生植物也是修复海水养殖尾水的重要手段之一[10],目前已经有较多的盐生植物被应用于养殖尾水的治理当中,有研究发现碱蓬对养殖富营养化水体进行原位修复后,海水中的氮磷含量均有明显下降[11];以芦苇构建人工湿地较好地去除了养殖尾水污染物[12];曾碧健等[13]通过种植海马齿生态浮床不仅增加了池塘中的浮游生物多样性也降低了有机质含量。吴英杰等[14]利用北美海蓬子生态浮床对养殖海水进行净化,结果发现生态浮床对水体具有显著的净化效果,其中以50%的覆盖面积对海水中的N、P以及COD去除效果最好。
本实验通过设计不同类型的功能池对海水养殖尾水进行分级处理,以16S rRNA基因高通量测序技术分析水体和生物膜的微生物群落组成,以期揭示在不同处理阶段中微生物菌落结构的动态变化。
1 材料与方法
1.1 实验装置
本实验装置采用的生物填料有弹性填料(塑料毛刷,单元直径15 cm,中心串联一根尼龙绳周围呈毛刷状)、陶粒(规格为直径2—3 cm)以及北美海蓬子生态浮床(植株长度20—30 cm,每平方米9盆,70—80株的正方形浮床),采用这三种不同的材料构成填料组合,对南美白对虾的养殖尾水进行净化处理,尾水处理系统由沉淀池、陶粒池以及除磷池组成(图1)。养殖尾水处理系统总长50 m,宽7 mm,高1.2 m,总面积350 m2,在每个处理池末端设置不同高度的多个平行出水管以形成落差,最高处水位1.2 m,最低处水位0.7 m,6个处理池高度和面积一致,每个池用底部连通的隔水墙分隔成两部分,促使水流上下流动,避免产生静水区。系统采用序批式处理,尾水日处理量约5×105kg,水力停留时间为1h,不进行回流。高位池养殖尾水由水泵抽入1号沉淀池,在高度差的作用下逐级流入后续处理池。陶粒池装填量为35 m3;4个沉淀池全部挂上塑料毛刷,悬挂密度为每平方15根(直径15 cm,长1.2 m),并在池底做好固定以防止毛刷漂浮;除磷池中生态浮床占30 m2,剩余空间悬挂毛刷,悬挂方式与沉淀池相同。
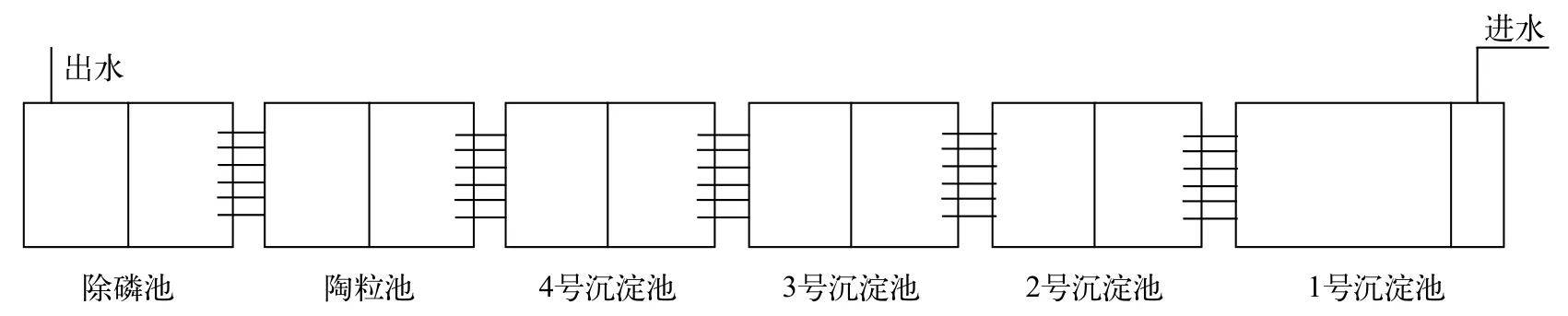
图1 海水养殖尾水处理系统Fig.1 Mariculture waste-water treatment system
1.2 样品采集
水样采集顺序分别是进水口(W1)、1号沉淀池(W2)、2号沉淀池(W3和W4),3号沉淀池(W5和W6)、4号沉淀池(W7)、陶粒池(W8)、除磷池(W9)。垂直采集每个处理池的进出水口水样,混匀后以0.45 μm孔径的滤纸进行抽滤后再测定水质。水质检测指标有:化学需氧量(CODMn)、悬浮物颗粒(TSS)、营养盐(氨氮NH3-N、亚硝酸盐N、硝酸盐以及活性磷酸盐。水质检测均按照国标GB17378.4-2007海洋监测规范方法进行。
生物膜样品采集主要包括塑料毛刷,陶粒以及北美海蓬子根系。塑料毛刷的样品采集顺序为1号沉淀池(MS1和MS2)、2号沉淀池(MS3和MS4)、3号沉淀池(MS5和MS6)、4号沉淀池(MS7和MS8)以及除磷池(MS9),毛刷通过无菌剪剪下3根,长度为5 cm;陶粒样品采集自陶粒池,按进水先后顺序编号C1和C2,每个处理池各随机采集等重且规格一致的陶粒5颗;北美海蓬子根系样品采集自除磷池生态浮床,随机采集20 g根系(编号为Root1)。
1.3 环境基因组提取及高通量测序
将生物填料样品用无菌生理盐水冲洗,使用SB-5200DT超声波清洗机(40 kHz,15min)分离生物填料上的生物膜,用0.22 μm孔径的滤膜(MF-MillipoteTM,Ireland)对超声后的悬液进行抽滤,待液体不能被过滤之后保存滤膜,抽滤后留在滤膜上的样品即生物膜;水样微生物采集用相同的滤膜对水进行抽滤,每个样品均保存滤膜2片,抽滤结束后将滤纸保存于-80℃超低温冰箱,用以后续实验。
生物膜DNA的提取采用水样基因组DNA快速提取试剂盒,将滤膜剪碎之后用试剂盒Water DNA kit(Omega)进行提取。在完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。使用ABI GeneAmp®9700型PCR仪进行PCR扩增,PCR扩增16S rRNA的V4+V5区,采用TransStart Fastpfu DNA聚合酶,引物序列为515F:5′-GTGCC AGCMGCCGCGG-3′;907R:5′-CCGTCAATTCMT TRAGTTT-3′。用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收。将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)检测定量,之后按照每个样本的测序量要求,进行相应比例混合,构建Miseq基因文库。
1.4 Illumina数据分析
高通量测序平台为Illumina Miseq PE250,Miseq测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU聚类分析以及物种分类学分析。OTU(Operational Taxonomic Units)指的是在遗传学的研究中,为了便于分析人为的给某一分类单元设置的统一标志,通常可以认为一个OTU代表一种微生物。利用Uparse Version(7.0.1001)对所有样品的有效序列进行聚类,通常将高于97%相似性的非重复序列进行聚类,在聚类过程中去掉嵌合体得到OTU代表序列。随后再对OTU表进行筛选,保留了至少3个样本中序列数都大于等于5的OTU以及序列数总和大于等于20的物种,以此得到有效序列[15]。分析物种结构组成时,为防止叶绿素干扰,去除OTU中的叶绿体以及丰度较低物种之后,再对OTU进行统计分析。
使用QIIME软件分析α-生物多样性,R语言分析β-生物多样性,R语言的“Indicspecies”包分析基于指示值挑选显著性(P<0.05)的标志物种,以STAMP软件对指示种作多组别比较分析,用Canoco软件作冗余分析(Redundancy Analysis,RDA)筛选与细菌群落变异相关的主要环境因子。
2 结果
2.1 测序质量分析
对测序结果的微生物序列进行分析(表1),21个样品总共得到的有效序列数是932158条,平均有效序列数是(44388±8392)条,序列的有效覆盖率全部达到98%以上,在测序条数达到30000条以上时Sobs稀释性曲线趋于平稳,表明测序数据合理,因此该测序结果能够较好地反映微生物的组成状态。测序结果总共发现3781种OTU,水体样品平均OTU数为(834±208)种,生物膜样品组(生物膜样品组是对毛刷、陶粒及根系样品的总称)平均OTU数为(1489±432)种,水体样品中平均OTU数值明显少于生物膜样品(P<0.05)。

表1 各样品高通量测序数据结果分析Tab.1 Analysis of high-throughput sequencing data of each sample
2.2 α-生物多样性分析
对筛选出来的细菌OTU序列结果进行分析计算,得出相关α-多样性指数(图2),采用群落丰富度指数Chao和Ace、群落多样性指数Shannon指数、Simpson指数和文库覆盖率对养殖尾水系统内浮游生物群落进行评估。结果显示,Shannon指数平均值为4.77±0.93,毛刷组随着系统运行先增大后减小,平均值为5.32±0.88,水样组总体呈现先增大后减小,平均值3.99±0.39,陶粒组均值为5.49±0.25;Simpon指数平均值为0.04±0.04,毛刷组先减小后增大平均值为0.03±0.04,水样组总体先增大后减小平均值为0.06±0.03,陶粒组平均值为0.01±0.01;Ace指数平均值为1610.10±473.17,毛刷组先增大后减小,平均值为1802.98±493.29,水样组平均值为1331.93±266.79,陶粒组平均值为1605.63±47.91;Chao指数平均值为1562.38±506.22,毛刷组先增大后减小平均值为1894.69±548.76,水样组平均值为1214.17±247.48,陶粒组平均值为1668.84±60.84。
2.3 微生物群落结构分析
为了解样品中细菌共有情况,绘制了Venn图(图3,未去除叶绿体序列)。结果显示,样品中总OTU出现于所有样品的核心共有菌为546种,生物膜之间共有细菌有699种,仅出现于生物膜的核心共有菌为153种。生物膜组与水样组中共有菌群最多的是毛刷组,最少的是根系组。毛刷组(2898种)和水体组(2415种)中细菌OTU总数较多,数量几乎是陶粒(1768种)和北美海蓬子根系(1253种)的两倍,但样品OTU均值却未明显高于陶粒和海蓬子根系,而且生物膜与水样之间共有菌数量从大到小依次是毛刷组、陶粒组以及根系组。

图2 α-多样性指数分析图Fig.2 α-diversity index analysis chart

图3 样品中微生物组成分布Venn图Fig.3 Venn diagram of the distribution of microbial composition in samples
经过物种注释(去除了叶绿体序列),在门分类水平上,以物种在样品中的相对丰度构建柱形图(图4),样品中主要细菌类群为:变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)及浮霉菌门(Planctomycetes),平均相对丰度分别为(46.08±7.87)%、(24.43±8.87)%、(8.23±5.91)%和(7.09±5.68)%,生物膜和水样之间差距大导致标准差偏大。变形菌门中以α-变形菌和γ-变形菌两种细菌含量最高,在变形菌门中平均所占的比例分别为(58.93±19.63)%和(27.37±12.77)%。
在生物膜样品中的菌群分布较水样中更加复杂,菌群分布具有明显差异。浮霉菌门、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、Verrucomicrobia门、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)、Ignavibacteriae门及酸杆菌门(Acidobacteria)在生物膜中含量较高,而水样中放线菌门(Actinobacteria)相较于生物膜丰度更高。
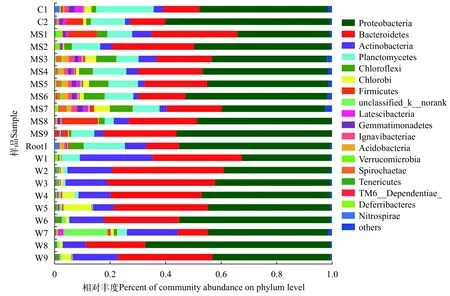
图4 微生物门水平(Phylum)上的物种相对丰度柱形图Fig.4 Community barplot analysis on the phylum level
硝化作用在水处理过程中具有非常重要的作用,在本实验系统中主要的硝化菌是亚硝化单胞菌属和硝化螺旋菌(Nitrospirae),它们被认为是去除含氮污染物的重要菌群,在系统中主要分布在生物膜中,主要在黏土陶粒C1(1.01%,1.78%)和C2(0.28%,0.71%)及北美海蓬子根系(0.05%,1.67%)中含量较高,塑料毛刷和水样中含量极低。
其他一些常见菌种在尾水系统中分布也有较大差异,如绿弯菌门,在生物膜和水样中占比分别为4.44%和0.15%,该菌种主要分布在生物膜上,可能是生物膜骨架的基本组成成分;作为有机高分子的分解者黄杆菌纲(Flavobacteriia),在尾水系统中每个处理池中均有发现,平均占比10.05%;芽孢杆菌(Bacillus)是水产养殖常用的益生菌,在各处理池中检测到的丰度均较低(陶粒组平均2.96%,毛刷组0.19%,水样组0.28%,根系0.31%),而且在陶粒样品C2中含量最高(C1中0.07%,C2中5.84%)。
2.4 β-生物多样性分析
NMDS分析为了解不同样本之间的差异性,对水体和生物膜进行聚类分析,基于Bray-Curtis和Unweighted-Unifrac 两种距离算法对尾水系统中的样品进行分析(图5和图6),在两个图中样品均被分成两个部分,表明了水体和生物膜上菌群群落组成具有明显差别。在水样中,样品W1(进水口)和W7(4号沉淀池)具有明显的差异性,与其他样品点的相对距离较远;在生物膜样品中,MS1、MS2、MS8和MS9与其他样品均距离较远,这可能是尾水系统中不同处理阶段导致,陶粒以及北美海蓬子根系因为载体材料的不同,与塑料毛刷样品点也相距较远。基于两种算法下的压力系数(Stress)均小于0.2,表明结果具有较好的拟合度,能够准确地反映系统内菌群的组成情况。
RDA排序分析根据表2分析结果显示,尾水系统中对菌群分布产生最大的影响因子为磷酸盐,磷酸盐对整个菌群的影响具有显著性相关关系(P<0.05),其他环境因子对菌群结构无显著性影响(P>0.05)(水质检测结果见表3)。根据图7中样品点在图中占据的位置,可以分成4个部分:在尾水系统中分布靠前的MS1和MS2;处于系统中部的MS3,MS4和MS5;处于靠后位置的MS6、MS7、MS8、C1、C2及单独的MS9。这反应了在系统前期处理阶段中,以化学需氧量作为主要的影响因子,到了处理阶段后期影响较大是磷酸盐和氨氮。
不同功能组的指示物种分析指示种可以用来反映自然环境的变化状况,可以通过指示值(IndVal)方法进行计算,该方法最早于1997年由Dufrêne 和Legendre提出[16],由于这种方法可以将某种环境状态内具有高专一性和高忠实性的物种筛选出来,对环境变化具有较好指示效果,因而被广泛用于生物指示的研究中[17,18]。

图5 基于Bray-Curtis距离NMDS分析Fig.5 NMDS analysis(based on the Bray-Curtis distance)

图6 基于Unweighted-Unifrac距离NMDS分析Fig.6 NMDS analysis(based on the Unweighted-Unifrac distance)

表2 RDA排序分析环境因子表Tab.2 The environmental factors in RDA analysis
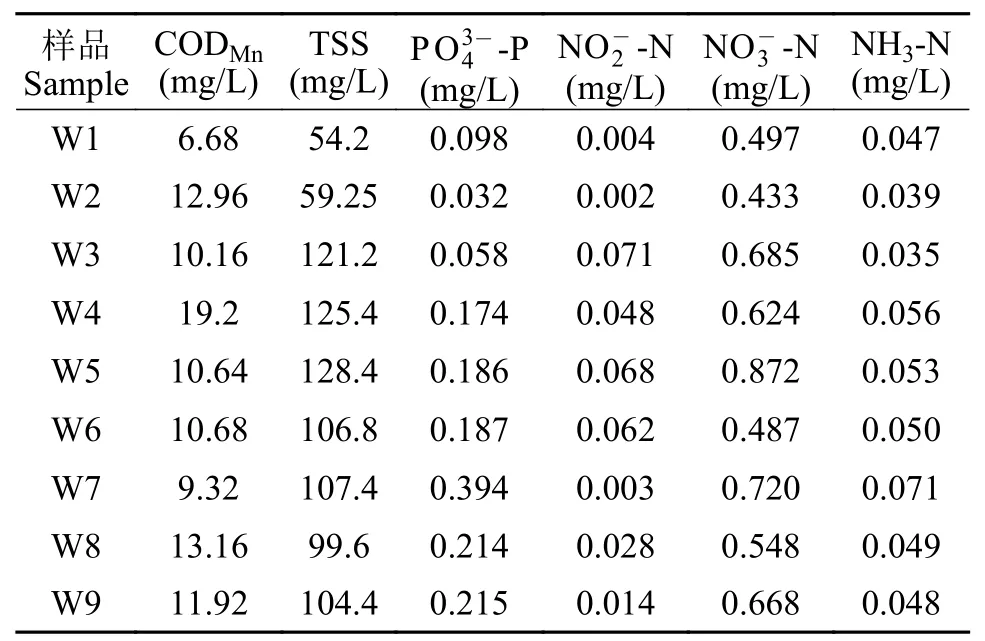
表3 水质检测结果Tab.3 The result of water quality
通过物种指示值进行计算,对采集的样品在P<0.05显著性水平上进行指示种挑选,在属水平上共选出160种细菌OTU,这160个物种主要属于变形菌门、厚壁菌门、拟杆菌门及放线菌门,为了解这些物种在系统中分布情况,将其进行聚类分析(图8)。根据聚类结果可以明显看出指示种被分成不同部分,不同材质样品被分成3组:黏土陶粒组、塑料毛刷和北美海蓬子根系组以及水样组;同种材质的样品(主要是毛刷组和水样组)按照其在系统中的处理阶段被分开聚类(按处理前中后三阶段将较为相似的样品聚类到一起)。
采用STAMP软件在P<0.05显著性水平对挑选出来的160种细菌在纲(Genus)水平上作热图分析(图9),可以看出样品的主要差异物种属于蓝细菌、α-变形菌(Alphaproteobacteria)及γ-变形菌(Gammaproteobacteria);浮霉菌、黄杆菌及δ-变形菌(Deltaproteobacteria)相对差异较小。
3 讨论
3.1 水处理阶段和载体对微生物群落的影响
随着分子生物学的发展,高通量测序方法已经逐渐成为研究微生物群落的主要手段,通过对16S rRNA基因测序分析可以获得大量有效序列,包括那些非可培养细菌数据,这就使得可以更加深入地探索微生物群落结构多样性。对高通量测序而言,测序的数量和深度是影响测序结果的主要因素。在本研究中,对序列采取随机抽样以及它们所表示的OTU数构建Sobs稀释曲线,在稀释曲线中随着抽取序列数的增加而曲线逐渐趋向平坦,这表示本次测序数据可以反映样本的真实情况。
本实验尾水系统采用序批式处理,尾水通过不同类型的功能池分级处理,不同类型功能池中微生物群落分布具有较大差异。从Shannon指数图变化可以看出,在尾水刚进入处理系统时,由于水体之间混合作用以及尾水富营养的特点改变了生活环境,导致细菌不适应而丰度减少,随着处理池中营养被分解利用,细菌生长恢复并缓慢上升,这与毛刷中菌群变化不同,毛刷生物膜菌群在尾水高营养条件下迅速繁殖,但是在生物膜成熟的同时也伴随着菌膜脱落,脱落的细菌一部分死亡,另一部分则在水体中存活而导致水中丰度增加,因此这可以解释为什么在水中的营养被消耗殆尽之后,同一个处理池中水样W7 的Shannon指数出现上升而毛刷MS8的Shannon指数出现下降的情况。陶粒内外表面孔隙率较高且粗糙,对水体中有机物和细菌具有较强吸附效果[19],Shannon指数上陶粒高于水样的原因可能是陶粒为细菌的生长提供了充分的载体。北美海蓬子根系的菌落丰度也大于水体,其原因可能是因为植物根系作为一个有机体,形成了其特有的根际微生物群落,从而导致了菌群差异。
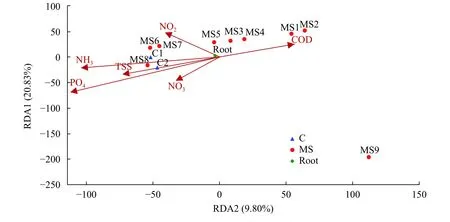
图7 生物膜样品与水环境的RDA排序图Fig.7 RDA ordination biplot between biofilm samples and environmental factors in the system

图8 指示物种Cluster聚类分析图Fig.8 Indicator species cluster analysis
为了解不同载体材料对菌群的影响,通过基于Bray-Curtis以及Unweighted-Unifrac距离来分析遗传进化和群落结构关系,对比生物膜在该算法下的距离位置,发现与分析结果是相似的。在本研究结果中不同处理阶段及不同材质的生物膜样品在NMDS图中均相距较远,在树状聚类图中也分别进行聚类。水样组也有同样的结果,根据处理阶段具有不同的表现。同时利用距离矩阵对毛刷和水样的菌落结构分析,发现其组内变化无显著差异(P>0.05),这意味着整个水处理过程中,环境变化对毛刷生物膜和水体中菌群动态变化的影响程度是类似的,而造成群落之间差异的主要原因是载体材料不同。生物填料为生物膜的培养提供了附着条件,不同类型的载体材料由于内部结构及其物理性质不一样,选择性地筛选水体中的细菌作为附着细菌,生物填料通过富集作用导致营养物质含量不同,从而造成了菌落在生物膜与水体之间的差异性。生物填料差异性在不同组分之间的共有菌群占比上也有体现,毛刷(49.21%)、陶粒(32.53%)与水体的共有菌占比较高,说明该类型生物膜是通过富集水体菌群提供了强化的水净化能力;然而,根系与水共有菌占比低(19.25%),这可能是根际微生物引起的菌群结构差异,同时也暗示了根际生物膜可能具有不同于无机物填料生物膜的水处理能力。
3.2 不同水处理阶段生物膜中的氮循环相关菌群
水产养殖尾水中含有大量的氮元素,氮的转化涉及了微生物的固氮、硝化与反硝化作用等,地球氮循环主要就是由微生物介导,其中起着重要作用的一类菌群就是变形菌门[20—22]。α-变形菌纲包含许多固氮细菌;β-变形菌纲(Betaproteobacteria)中的亚硝化单胞菌属(Nitrosomonas)是常见的氨氧化菌;反硝化作用是生物脱氮的关键步骤,关系到废水处理系统的除氮效率,负责反硝化作用的细菌主要分布于α-变形菌纲和β-变形菌纲[23];γ-变形菌和δ-变形菌纲主要是兼性异养细菌,可以通过有氧和无氧呼吸对有机物进行分解代谢[24]。硝化细菌在水体氨氮、亚硝酸盐和硝酸盐之间相互转化中发挥着不可替代的作用,硝化细菌由氨氧化细菌和亚硝酸盐氧化细菌两类菌群组成,其中的亚硝化单胞菌属、亚硝化叶菌属(Nitrosolobus)、亚硝化弧菌属(Nitrosovibrio)、亚硝化球菌属(Nitrosocuccus)和亚硝化螺菌属(Nitrosospira)是常见的氨氧化菌,亚硝酸盐氧化菌中的硝酸杆菌属(Nitrobacter)、硝化球菌属(Nitrococcus)、硝化螺菌属(Nitrospira)和硝化刺菌属(Nitrospina)在氧化亚硝酸盐上发挥着重要作用[25]。

图9 指示种按纲水平(Class)在不同样品中的分布热图Fig.9 The heatmap of indicator species in different samples on class level
在本研究中海水养殖尾水处理系统的氨氧化菌主要是亚硝化单胞菌属,亚硝酸盐氧化菌是硝化螺菌属,在尾水系统中主要分布在黏土陶粒以及北美海蓬子根系中,在陶粒和根系样品中占比分别是2.79%(C1)、1.00%(C2)以及1.72%(Root);塑料毛刷中有少量的亚硝化单胞菌属分布,水样中硝化细菌检出极低,因此在尾水处理系统中陶粒和北美海蓬子根系可能是进行硝化作用的主要场所。从黏土陶粒上硝化菌的比例来看,一级陶粒池生物膜上硝化细菌含量最多,二级陶粒池和除磷池中的硝化细菌含量较为接近,因此一级陶粒池硝化作用可能强于二级陶粒池以及北美海蓬子生态浮床。
除了变形菌的反硝化作用,有研究发现生物膜中还存在着其他菌群可以稳定硝酸盐浓度[26,27]。黄杆菌存在于生物膜内层,在缺氧条件下可以利用硝酸盐或者亚硝酸盐进行无氧呼吸,在去除氮同时也可以氧化有机质,这种被称为异化性硝酸还原作用[28],黄杆菌在所有样品中平均占比10.05%,在一定条件下它们也将发挥着净化水体氮元素的职能。属于厚壁菌门的芽孢杆菌是一种益生菌,它们也可以通过自身代谢显著降低水体中的亚硝酸盐浓度[29],孟睿等[30]用芽孢杆菌为实验菌种对水产养殖废水进行控制处理,发现废水中的COD和亚硝酸盐浓度明显降低;王亚南等[31]发现芽孢杆菌在近海养虾场底泥中具有超过50%的生物量,其中有一部分细菌具有还原硝酸盐降低氮素含量的作用。芽孢杆菌在尾水系统中均有分布但是含量较低,在陶粒池中含量最高(陶粒组平均2.96%,毛刷组0.19%,水样组0.28%,根系0.31%)。有研究指出[32],与水质净化具有相关联的菌群中仍存在着大量不能培养或未分类鉴定的物种,这些功能性菌群的生长在维持水体氮平衡中起着至关重要的作用。
3.3 水处理系统指示物种
由于不同阶段水处理过程中群落结构存在显著性差异,我们筛选出160种指示物种,研究结果发现筛选出来的指示物种能够明显地区分出样品的来源与功能(图8和图9),因此,指示物种的丰度变化可以用来作为区分样品来源和载体材质的指标,同时也可以用来反映尾水系统中生物膜的成熟度和稳定性。热图分析显示指示种中差异最大的是蓝细菌,聚球藻(Synechococcus)是其中差异最大的物种,大部分聚球藻可以利用硝酸盐和氨作为他们生长所需的氮源,处理前期高浓度营养提供了合适的生长环境,是提供初级生产力的重要贡献者。除了蓝细菌,其次是α-变形菌纲和γ-变形菌纲,这两类变形菌中的主要差异菌有红杆菌科(Rhodobacteraceae)、交替假单胞菌科(Idiomarinaceae)以及着色菌科(Chromatiaceae)。除此之外,筛选出来的物种还有一部分未能分类鉴定,这些菌种缺乏相关资料文献作为参考,其功能都有待进一步去验证,这些敏感物种可能是作为评价不同阶段下水处理效果的一个生物学指标,是改进尾水处理系统的参考依据之一。
4 结论
在海水养殖尾水系统中,微生物群落主要为变形菌门、拟杆菌门、蓝细菌门、放线菌门、浮霉菌门和酸杆菌门。在不同水处理阶段中,微生物多样性指数总体呈现先增长后下降的趋势,表明养殖尾水中营养元素被充分利用,有机污染物也得到了有效降解。同一阶段中生物膜载体材料不同是影响菌群结构的主要因素。北美海蓬子根系和黏土陶粒生物膜中硝化细菌丰度占比远高于其他功能单元,是硝化作用的主要发生场所。系统前半段,化学需氧量是微生物组成主要影响因子,处理后半段影响较大是磷酸盐和氨氮。通过物种指示值筛选出160种指示OTU,主要属于变形菌门、厚壁菌门、拟杆菌门以及放线菌门,这些指示生物可能是作为评价海水养殖尾水处理系统的指标,为水处理系统改进提供参考依据。
