长链非编码lncRNA DBH-AS1对瘢痕疙瘩成纤维细胞凋亡的影响及作用机制
2021-02-04贾春英张荣明
贾春英 张荣明
锦州医科大学附属第三医院烧伤整形外科(辽宁锦州121000)
瘢痕疙瘩,又称病理性瘢痕,是由于个体皮肤损伤后的胶原异常积聚所致,主要与成纤维细胞的过度增殖和细胞外基质的大量沉积有关,瘢痕疙瘩临床表现为皮肤表面的结痂与斑块,颜色呈鲜红或淡紫,自觉瘙痒与刺痛等[1-3]。研究表明瘢痕疙瘩的形成与多种复杂因素相关,如细胞因子、炎症因子和基因调控等[4-5]。近年来,瘢痕疙瘩的形成机制与调控机理已成为目前生物医学领域的研究热点,瘢痕疙瘩的治疗难题亟需突破[6]。
lncRNA 全称长链非编码RNA,是一种长度超过200nt 的非编码RNA。相比编码RNA,lncRNA具有更强的细胞特异性和组织特异性,并且lncRNA 在不同组织细胞中的表达水平存在差异,同时对细胞增殖、分化、迁移、凋亡和代谢等过程产生显著影响[7]。研究表明lncRNAs 在瘢痕疙瘩组织和细胞中异常表达,并对瘢痕疙瘩中机理形成起着重要作用[8-9]。lncRNA CACNA1G-AS1 在瘢痕疙瘩中通过调控钙通道蛋白CACNA1G 参与瘢痕疙瘩成纤维细胞迁移过程[10]。lncRNA ATB 通过调控EMT 参与瘢痕疙瘩的形成与发展[11]。
DBH-AS1是一种长度约为2 kb,从9q34染色体转录的非编码RNA[12]。研究表明lncRNA DBH-AS1在骨肉瘤、肝癌等疾病中均发挥重要作用[13-14]。据报道DBH-AS1 在肝癌组织和细胞中高表达,过表达DBH-AS1 通过激活肝癌中的MAPK 信号通路促进细胞增殖和存活[15]。然而DBH-AS1 在瘢痕疙瘩中的作用及机制尚未完全阐明。因此本研究采用qRT-PCR 检测瘢痕疙瘩和正常皮肤组织中DBHAS1 的表达水平,并深入探讨DBH-AS1 调控miR-138/HIF-1α通路在瘢痕疙瘩成纤维细胞凋亡的作用,以验证lncRNA-DBH-AS1/miR-138/HIF-1α轴对瘢痕疙瘩形成的影响。
1 材料与方法
1.1 组织标本选择2018 年3 月至2019 年10 月在我院接受瘢痕疙瘩治疗患者作为研究对象,共50 例,其中男31 例,女19 例,平均年龄(31.2 ±10.6)岁,所有患者在术前均未接受手术、化疗、放疗或生物治疗等,并且排除其他肿瘤及重大疾病的可能。在术中瘢痕疙瘩和少量周围正常皮肤组织。所有组织标本分成相同大小在30 min 内液氮速冻,并在入-80 ℃冰箱内保存。所有患者均在签署知情书的条件下自愿参与本研究。
1.2 方法
1.2.1 细胞培养与转染瘢痕疙瘩成纤维细胞和正常成纤维细胞采购于中国科学院北京细胞库,在37 ℃、5%CO2平衡湿度培养箱环境中采用含10%胎牛血清的DMEM 细胞培养基培养。选取对数生长期细胞进行实验,参考lipofectamine 2000 试剂说明书转染新增si-NL、LV-NC、si-DBH-AS1、LV-DBHAS1、miR-138 mimics、miR-138 inhibitors、si-HIF-1α和LV-HIF-1α,转染24 h后进行下一步实验。
1.2.2 qRT-PCR按照Trizol试剂盒步骤提取瘢痕疙瘩组织和细胞中总RNA。使用分光光度仪计量RNA 水平。以β-actin 为内参通过260 nm 和280 nm吸光度,qRT-PCR 按照SYBR Green 试剂盒说明书进行反应体系的配制,通过Prime ScriptTMRT 试剂盒检测RNA 的浓度,采用反转录试剂盒合成cDNA。以β-actin 为内参,按2-ΔΔCt法进行相对表达量分析。
1.2.3 流式细胞仪细胞凋亡检测取对数生长期的细胞,转染24 h 后接种到密度为3 × 105个/孔的6 孔板中,经预冷的70%乙醇处理后,置于4 ℃温度条件下过夜。加入10 μL Annexin V-FITC和5 μL 碘化丙啶染色液(0.25 mg/mL),轻轻混匀,室温避光孵育20 min,用流式细胞仪进行检测。
1.2.4 双荧光素酶报告将野生型(WT)或突变型(MUT)DBH-AS1 克隆到pmirGLO 质粒受体中,同时将miR-138 mimics 或miR-138 inhibitors 导入293细胞中,共培养48 h 后采用双荧光素酶受体分析系统测量双荧光素活性。
1.2.5 Westrn blot 法收集转染24 h 后的细胞,常规提取细胞总蛋白,BCA 试剂盒测定蛋白浓度,SDS-PAGE 凝胶每孔加入40 μg 的待测蛋白,110 V电泳,250 mA 电转至PVDF 膜,5%脱脂奶粉37 ℃封闭1 h,分别加入HIF-1α、caspase-7 和β-actin 一抗4 ℃孵育过夜,TBST 洗膜3×10 min,二抗37 ℃孵育1 h,TBST 洗膜3 × 30 min,ECL 显影。运用Quantity one 软件分析蛋白条带灰度值,以β-actin作内参,计算相对表达量。
1.3 统计学方法所有实验数据以均数±标准差表示,采用SPSS 21.0 统计学软件对数据进行统计学分析,两组间采用t检验,多组间比较采用方差分析,P<0.05 认为差异有统计学意义。
2 结果
2.1 DBH-AS1在瘢痕疙瘩组织和瘢痕疙瘩成纤维细胞中的表达水平QRT-PCR结果显示DBH-AS1在瘢痕疙瘩组织和成纤维细胞中明显高于正常组织和正常成纤维细胞,差异有统计学意义(P<0.05)。转染si-DBH-AS1 和LV-DBH-AS1 分别下调和上调瘢痕疙瘩成纤维细胞中的DBH-AS1 表达水平,见图1。
2.2 低表达与过表达DBH-AS1 对成纤维细胞凋亡的影响流式细胞术结果显示,转染si-NC 和si-DBH-AS1 的瘢痕疙瘩成纤维细胞凋亡率分别为(6±1.2)%和(17±2.7)%,转染si-DBH-AS1 明显下调细胞中caspase-7 mRNA和蛋白表达水平,差异有统计学意义(P<0.05)。而转染LV-NC 和LV-DBHAS 瘢痕疙瘩成纤维细胞凋亡率分别为(5 ± 0.9)%和(1 ± 0.5)%,过表达DBH-AS 显著上调caspase-7 mRNA和蛋白水平,见图2。
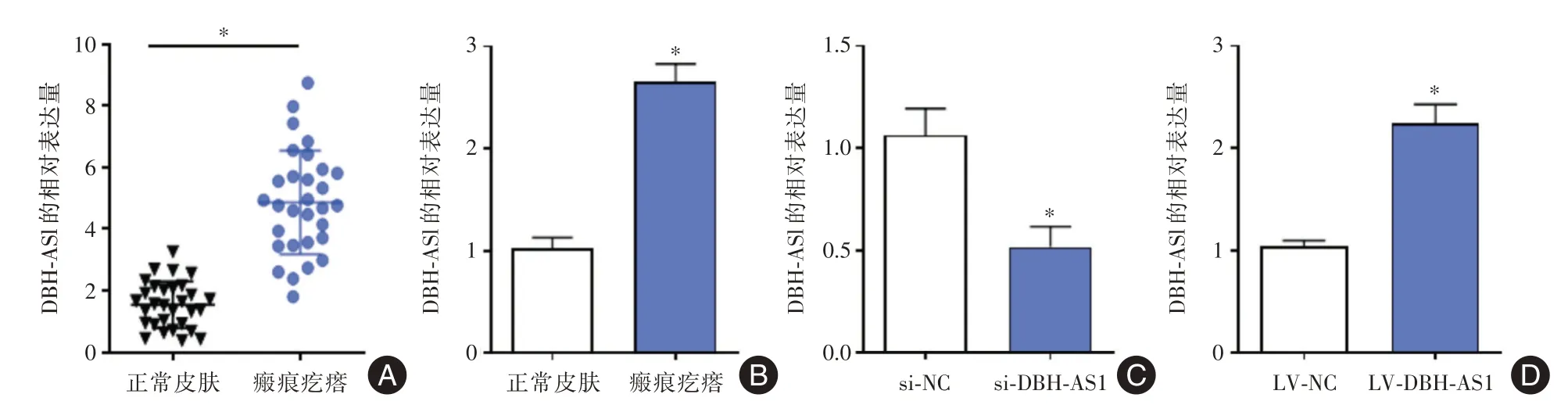
图1 DBH-AS1 在瘢痕疙瘩组织和瘢痕疙瘩成纤维细胞中的表达水平Fig.1 DBH-AS1 relative expression level in keloid tissues and keloid fibroblasts
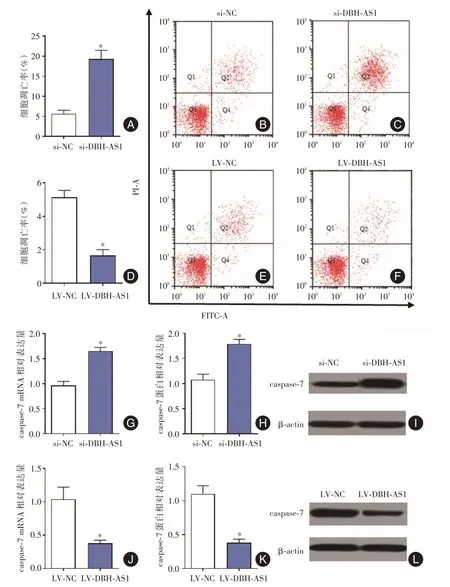
图2 低表达与过表达DBH-AS1 对成纤维细胞凋亡的影响Fig.2 Effects of low expression and overexpression of DBH-AS1 on apoptosis of fibroblasts
2.3 DBH-AS1能够靶向结合miR-138双荧光素酶报告显示DBH-AS1 能作为海绵靶向结合miR-138,DBH-AS1 野生组转染miR-138 mimics 后,双荧光素活性显著下调,而DBH-AS1 突变组无明显变化。QRT-PCR 结果显示miR-138 在瘢痕疙瘩组织和成纤维细胞均低于正常组织和正常成纤维细胞,差异有统计学意义(P<0.05)。转染si-NC 和si-DBHAS1 的瘢痕疙瘩成纤维细胞中miR-138 相对表达量分别为(1.0±0.2)和(1.7±0.3),而转染LV-NC和LV-DBH-AS1的miR-138相对表达量为(0.9±0.2)和(0.3±0.2),差异有统计学意义(P<0.05),见图3。
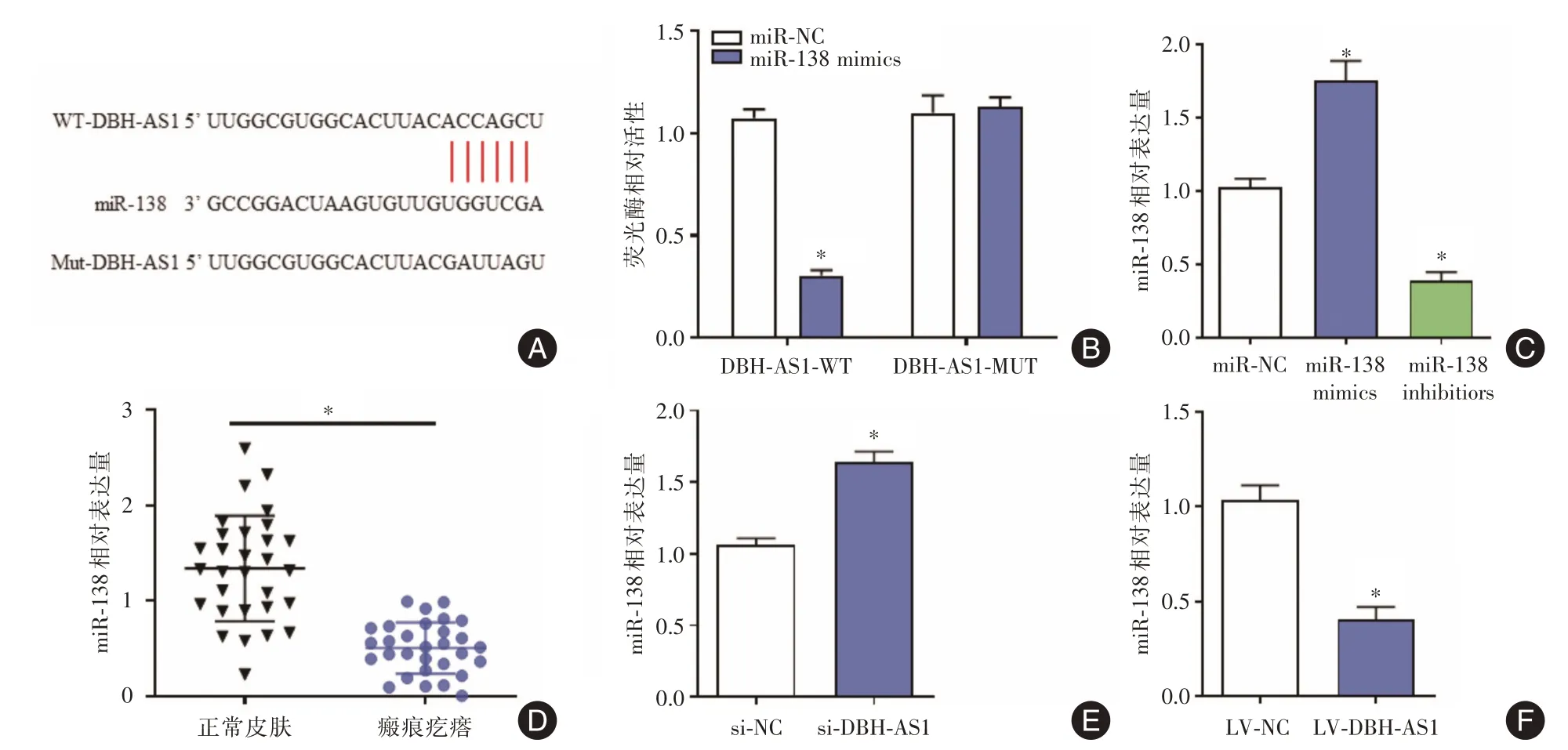
图3 DBH-AS1 能够靶向结合miR-138Fig.3 DBH-AS1 serves as a sponge of miR-138
2.4 过表达与低表达miR-138 对成纤维细胞细胞凋亡的影响流式细胞术结果显示成纤维细胞转染miR-NC 和miR-138 mimics 的细胞凋亡率分别为(7 ± 0.5)%和(19 ± 0.8)%,而转染miR-NC 和miR-138 inhibitors 的细胞凋亡率分别为(15 ± 0.7)%和(6 ± 0.4)%,差异有统计学意义(P<0.05)。过表达和敲低miR-138 也会显著上调或降低caspase-7 mRNA 和蛋白的表达水平,见图4。
2.5 miR-138 能够靶向结合HIF-1α双荧光素酶报告显示miR-138 能够靶向调控HIF-1α,HIF-1α野生组转染miR-138 mimics 后,双荧光酶活性显著低于转染miR-NC 组,然而HIF-1α突变组无明显差异。HIF-1α在疤痕疙瘩组织和正常组织中相对表达量分别为(1.0±0.2)和(2.1±0.8),转染miR-NC、miR-138 mimic 和miR-138 inhibitors 后,成纤维细胞中HIF-1α相对表达量分别为(1.0 ± 0.1)、(0.4 ±0.1)和(1.6 ± 0.2),差异有统计学意义(P<0.05),见图5。
2.6 DBH-AS1调控miR-138/HIF-1α通路参与细胞凋亡的影响回复实验中,转染miR-138 inhibitors能够逆转单独转染si-DBH-AS1 对瘢痕疙瘩成纤维细胞凋亡的影响,却能够进一步加强单独转染LVDBH-AS1 对成纤维细胞凋亡的影响(P<0.05)。而转染si-HIF-1α能够逆转单独转染miR-138 inhibitors 对成纤维细胞凋亡的影响,却进一步加强单独转染miR-138 mimic 对瘢痕疙瘩成纤维细胞凋亡的作用(P<0.05),见图6。
3 讨论
瘢痕疙瘩是一种病理性皮肤疾病,轻则影响皮肤外观,重则导致畸形,出现各种皮肤功能性症状,然而疤痕疙瘩的形成机制尚不清楚[16-18]。研究表明大量lncRNA 在瘢痕疙瘩组织中均存在异常表达,然而lncRNA 在瘢痕疙瘩的研究还远未深入[19-21]。本研究中DBH-AS1 在瘢痕疙瘩组织和成纤维细胞中都明显上调,敲低DBH-AS1 能促进成纤维细胞凋亡,然而高表达DBH-AS1 显著抑制细胞凋亡。这提示DBH-AS1 通过调控成纤维细胞凋亡参与瘢痕疙瘩的发生和进展,其具体机理需进一步探讨。
miRNA 是一种长度仅有20~24 nt的微型RNA,生物体内的miRNA 数量占RNA 总数的比例不足1.0%,但机体内30%~50%的基因表达均与miRNA有关。研究表明miR-194-3p、miR-199a-5p、miR-29a和miR-1224-5p等miRNA在瘢痕疙瘩组织中存在异常表达[22-24]。JIE 等[14]的研究成果显示LncRNA DBH-AS1 能靶向结合miR-138 参与肝细胞癌的肿瘤形成过程。本研究中,双荧光素酶结果显示DBH-AS1 能够靶向结合miR-138,过表达miR-138促进成纤维细胞凋亡,而沉默miR-138 抑制细胞凋亡,这提示DBH-AS1 通过靶向结合miR-138 调控成纤维细胞凋亡。
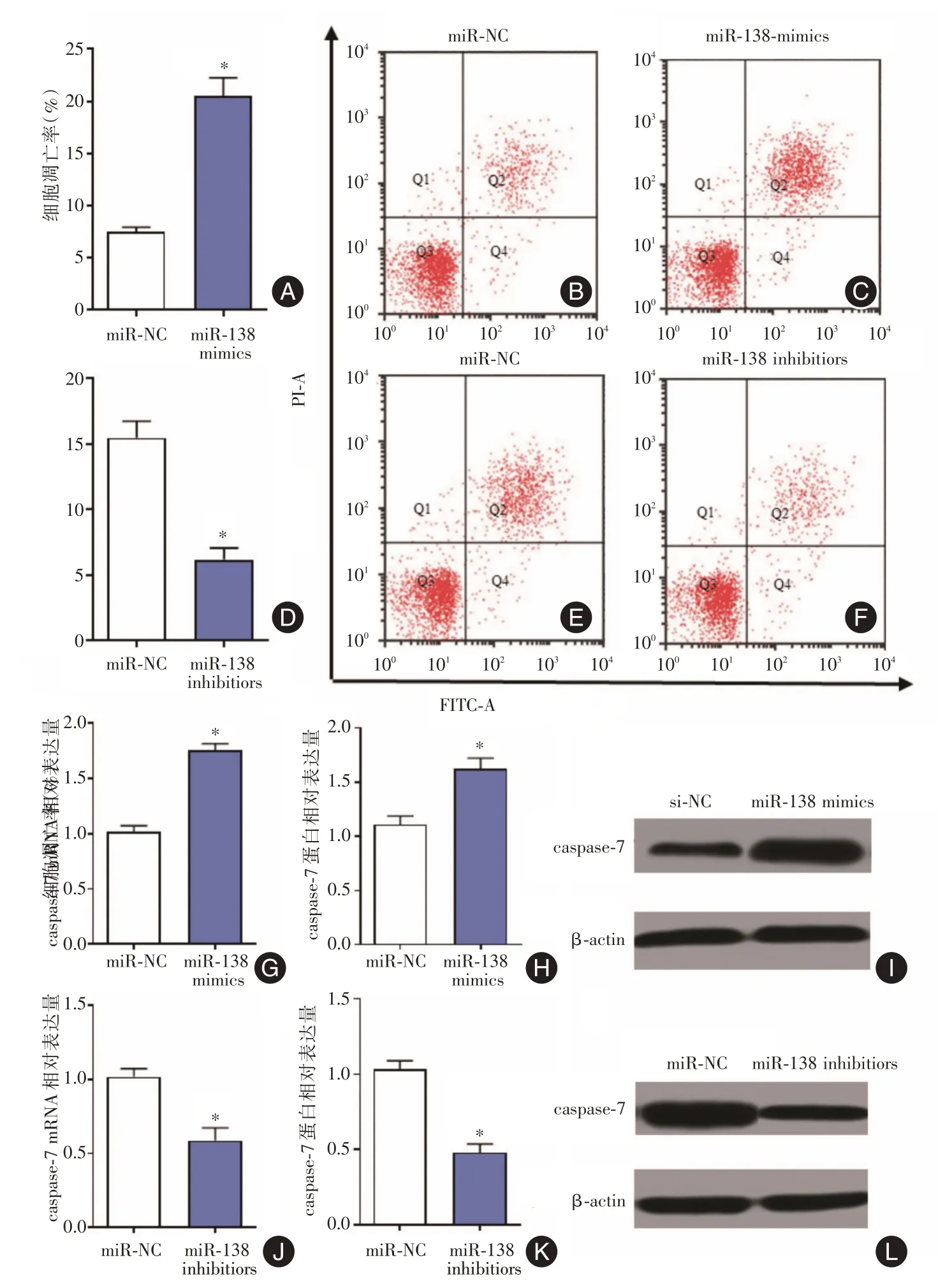
图4 过表达与低表达miR-138 对成纤维细胞细胞凋亡的影响Fig.4 Effects of overexpression and low expression of miR-138 on apoptosis of fibroblast cells
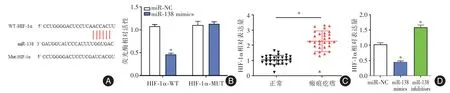
图5 miR-138 能够靶向结合HIF-1αFig.5 miR-138 can directly target HIF-1α
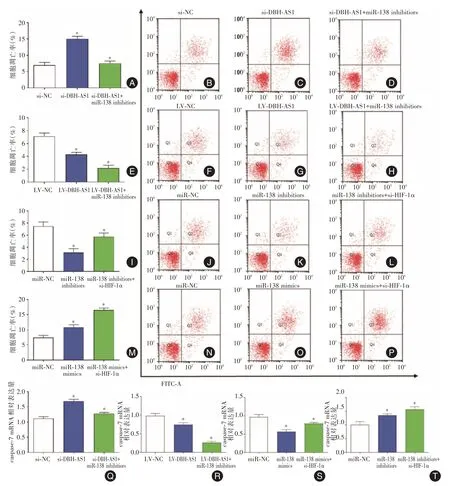
图6 DBH-AS1 调控miR-138/HIF-1α通路参与细胞凋亡的影响Fig.6 DBH-AS1 participates in the effect of apoptosis by regulating the miR-138/HIF-1α pathway
HIF-1α是一种缺氧诱导因子-1α,叶飞轮等[25]发现HIF-1α可通过影响血管新生、炎症反应和细胞凋亡参与瘢痕疙瘩的形成。本研究中,双荧光素酶结果显示miR-138 能够靶向结合HIF-1α,证实miR-138 能特异性靶向结合HIF-1α,HIF-1α在瘢痕疙瘩组织中的相对含量明显高于正常皮肤组织,这说明miR-138 靶向结合HIF-1α参与成纤维细胞凋亡进程。进一步实验证实lncRNA DBHAS1 能够通过调控miR-138/HIF-1α信号通路参与成纤维细胞凋亡。
本研究首次发现lncRNA DBH-AS1可作为miR-138 海绵调控HIF-1α的表达,进而参与瘢痕疙瘩成纤维细胞凋亡,但仅考虑了体外细胞实验,还缺乏体内实验加以验证。因此,LncRNA DBH-AS1 能否应用疤痕疙瘩的临床治疗还有待进一步验证,但可为瘢痕疙瘩治疗提供了新思路和新选择。
