Ac-SDKP抑制SPP1/TGF-β1信号拮抗实验性矽肺的机制
2021-02-04蔡文臣张诗汇魏中秋靳馥宇李雅倩李田徐洪杨方
蔡文臣 张诗汇 魏中秋 靳馥宇 李雅倩 李田 徐洪 杨方
华北理工大学1公共卫生学院,2临床医学院,3基础医学院(河北唐山063210)
尘肺病是我国最严重的职业病,对其发生、发展机制与防治研究一直是职业病研究领域的难点和热点问题[1-3]。课题组前期通过高通量测序技术,筛选到一些与矽肺发生发展有关的mRNA,并发现分泌性磷蛋白1(secretory phosphoprotein,SPP1)在矽肺模型组的差异表达具有代表性。研究表明,SPP1 的高表达与器官纤维化进展关系密切,其可通过激活转化生长因子1(transforming growth factor-β1,TGF-β1)信号促进成纤维细胞分化和Ⅰ型胶原(collagen type I,COL I)表达[4-6],对SPP1 的阻断可能是治疗肺纤维化的潜在靶点[7-9]。课题组多年来一直研究N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酰(N-acetyl-seryl-aspartyl-lysyl-proline,Ac-SDKP)的抗器官纤维化作用机制[10-12],因此本研究拟通过体内外实验,观察SPP1 在矽肺纤维化中的作用模式以及Ac-SDKP 能否通过调节SPP1/TGF-β1 信号拮抗矽肺纤维化。为获得矽肺纤维化作用靶点提供一定实验基础。
1 材料与方法
1.1 材料和试剂动式染尘自动控制系统(天津开发区合普工贸有限公司);小鼠单核巨噬细胞RAW264.7(中国科学院上海细胞库);二氧化硅(silicon dioxide,SiO2)(美国Sigama 公司),Ac-SDKP(瑞士Bachem AG 公司),SPP1 重组蛋白(10352-H08H,北京Sino Biological 公司),COLⅠ(ab34710,美国Abcam 公司),SPP1(AF0227,美国Affinity 公司),巨噬细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)(DF7577,美国Affinity 公司);转化生长因子Ⅰ型受体(TGF-β receptor typeⅠ,TGFβRⅠ)(A16983,美国ABclonal公司);TGFβR Ⅱ(ARG59501,上海Arigo 公司);Smad2/3(5678,美国Cell Signaling Technology公司);磷酸化Smad2/3(phosphate Smad2/3,p-Smad2/3)(8828s,美国Cell Signaling Technology 公司);α-微管蛋白(alpha tubulin antibody,α-Tubulin)(美国Affinity 公司);PV6000 通用型两步法免疫组化试剂(北京中杉公司);山羊抗兔、抗鼠二抗(美国KPL公司);ECL 显色试剂盒(北京庄盟生物公司);苏木精染色液(珠海贝索公司)。
1.2 动物实验SPF 级雄性Wistar 大鼠[(180 ±10)g,3 周龄]于华北理工大学医学实验中心洁净级动物房[SYXK(冀)2015-0038]饲养。采用HOPE-MED8050 动式染尘构建矽肺大鼠模型,其中对照组吸入纯净气,模型组吸入50 μg/m3SiO2,3 h/d,5 d/周[10-12]。实验分组为(n= 18):(1)对照组:吸入纯净气16 周后,腹腔内埋入含有生理盐水的微量缓释胶囊;(2)染尘组:动式染尘至16 周后,腹腔内埋入含有生理盐水的微量缓释胶囊;(3)Ac-SDKP 治疗组:动式染尘至16 周后,在大鼠腹腔内埋入含有Ac-SDKP[800 μg/(kg·d)]的微量缓释胶囊,均于24 周处理动物。
1.3 细胞培养和处理小鼠巨噬细胞RAW264.7在37 ℃含5%CO2的培养箱中用Ham′s F-12K 营养培养基培养,实验分组为:(1)对照组:无血清培养基培养;(2)SiO2诱导组:无血清培养条件下,给予200 μg/mL 的SiO2培养基诱导24 h;(3)Ac-SDKP处理组:无血清培养条件下,先给予10-8mol/L Ac-SDKP 诱导1 h,再加入SiO2(200 μg/mL)/SPP1 重组蛋白(1 μg/mL)诱导24 h。(4)SPP1 重组蛋白诱导组:无血清培养条件下,给予1 μg/mL 的SPP1 重组蛋白诱导24 h;(5)LY364947 抑制剂组:无血清培养条件下,先给予LY364947 抑制剂(59 nmol/L)培养1 h,再加入1 μg/mL的SPP1重组蛋白诱导24 h。
1.4 免疫组织化学染色石蜡切片常规脱蜡至水,常规制备细胞爬片。切片经高压修复,3%的H2O2封闭内源性过氧化物酶室温孵育15 min。滴加兔抗SPP1(1∶100),4 ℃过夜;滴加羊抗兔/小鼠免疫球蛋白G(1∶500)37 ℃孵育30 min,免疫组织化学显色试剂盒显色,镜下控制,常规复染,脱水透明,中性树脂封片,显微镜扫描。
1.5 免疫印迹法提取肺组织和RAW264.7 细胞蛋白,BCA试剂盒测定蛋白浓度,取10 ~20 μg蛋白进行常规电泳和电转,一抗COL I(1∶800),MCP-1(1∶1 000),TGFβR I(1∶1 000),TGFβRII(1∶1 000),p-Smad2/3(1∶500),Smad2/3(1∶500)和SPP1(1∶1 000)在4 ℃孵育过夜,山羊抗兔或抗小鼠二抗(1:5 000)孵育30 min。使用ECL发光试剂于ECLTM蛋白检测系统检测信号,使用Image Pro Plus 6.0软件测量平均光密度。以目标蛋白与内参蛋白α-Tubulin 的比值作为蛋白的相对表达量。
1.6 统计学方法采用SPSS 20.0软件进行统计学分析。数据以均数±标准差表示。多组间采用单因素方差分析,两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 Ac-SDKP 抑制矽肺大鼠中SPP1 的表达如图1 所示,IHC 结果显示,与对照组比较,矽肺模型组中有较大的矽结节形成,结节中可见SPP1 阳性表达细胞的分布。与矽肺模型组比较,Ac-SDKP处理组的病变程度明显减轻,SPP1 阳性表达减少。
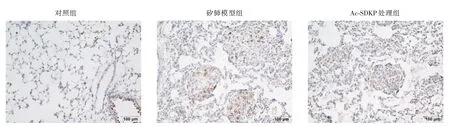
图1 SPP1 在Ac-SDKP 处理的染尘大鼠肺组织中的分布与表达(×200)Fig.1 The distribution and expression of SPP1 in Ac-SDKP treated silicosis rats lung tissues(×200)
Western blot 结果显示(图2),与对照组比较,矽肺模型组中COL I、MCP-1、TGF-β1 和SPP1 蛋白表达均升高(P<0.05)。与矽肺模型组比较,Ac-SDKP 处理组中COLⅠ、MCP-1、TGF-β1 和SPP1 蛋白表达明显降低(P<0.05)。
2.2 Ac-SDKP 抑制SPP1 在巨噬细胞中的表达IHC 结果显示,与对照组比较,SiO2诱导组中可见SPP1 阳性表达,与SiO2诱导组比较,Ac-SDKP 处理组中SPP1 阳性表达减少。
Western blot 结果显示(图4、5),与对照组比较,SiO2诱导组中COL I、MCP-1、TGF-β1 和SPP1的蛋白表达上调(P<0.05);与SiO2诱导组比较,Ac-SDKP 处理组中COL I、MCP-1、TGF-β1 和SPP1表达降低(P<0.05)。
2.3 Ac-SDKP抑制SPP1/TGF-β1信号通路如图6 所示,与对照组比较,SPP1 诱导组中TGFβRII、TGFβRI、p-Smad2/3 和SPP1 蛋白表达明显升高(P<0.05),与SPP1诱导组比较,Ac-SDKP处理组和LY364947 处理组中TGFβRII、TGFβRI、p-Smad2/3和SPP1 蛋白表达降低(P<0.05)。
3 讨论
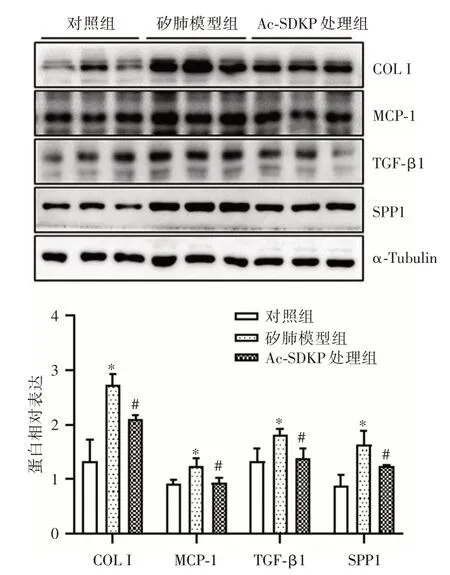
图2 COL I、MCP-1、TGF-β1 和SPP1 蛋白在Ac-SDKP 处理的染尘大鼠肺组织中的表达(n=3)Fig.2 The expression of COL I,MCP-1,TGF-β1 and SPP1 in Ac-SDKP treated silicosis rats lung tissues(n=3)
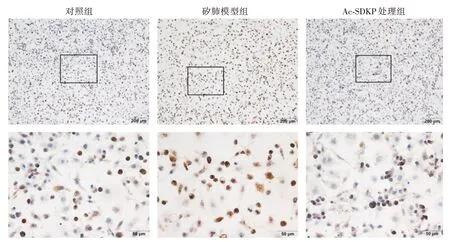
图3 SPP1 在Ac-SDKP 处理的RAW264.7 细胞中的表达(×200)Fig.3 The expression of SPP1 in Ac-SDKP treated RAW264.7 cells(×200)
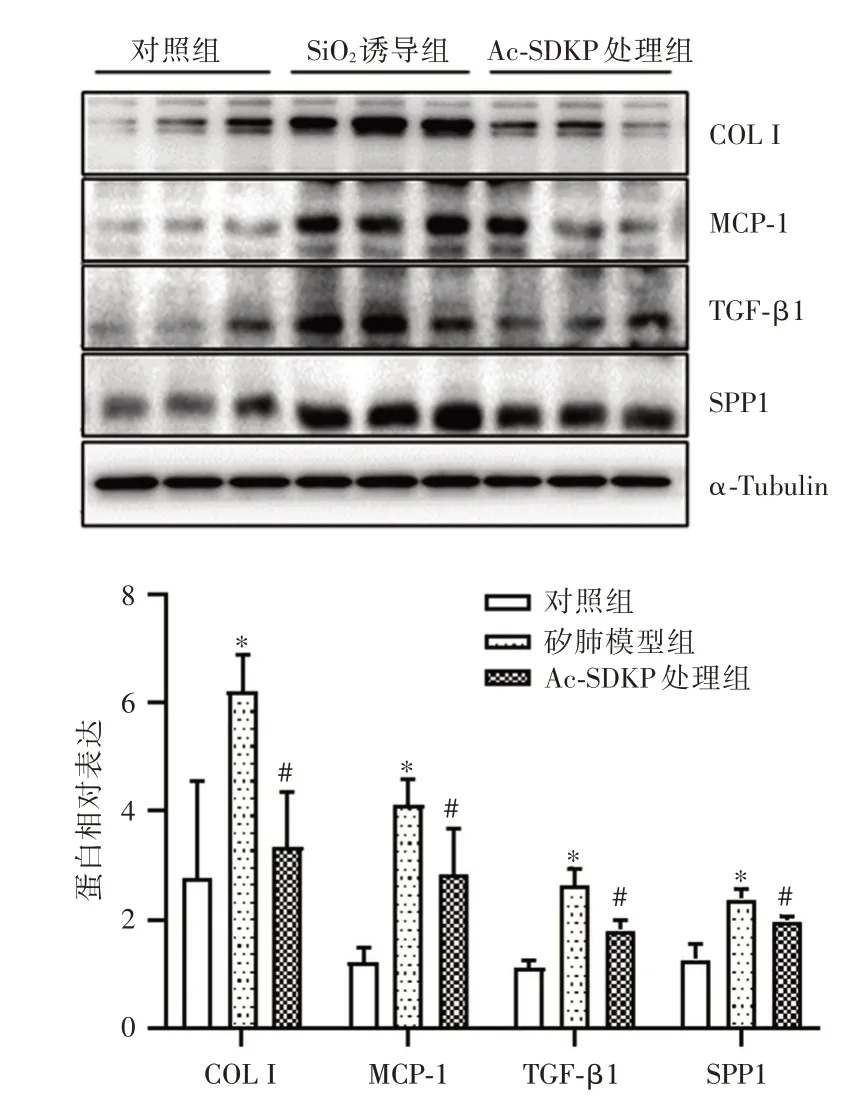
图4 COL I、MCP-1、TGF-β1 和SPP1 蛋白在Ac-SDKP 处理的RAW264.7 细胞中的表达(n=3)Fig.4 The expression of COL I,MCP-1,TGF-β1 and SPP1 in Ac-SDKP treated RAW264.7 cells(n=3)
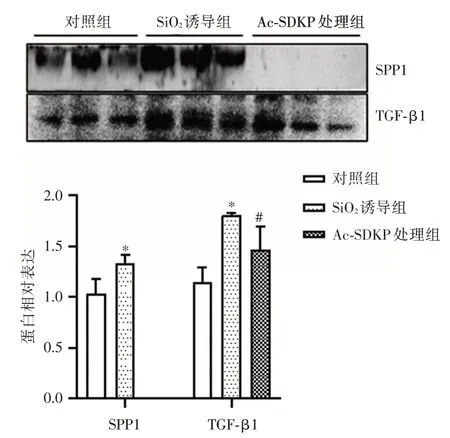
图5 TGF-β1 和SPP1 蛋白在Ac-SDKP 处理的RAW264.7细胞培养基中的表达(n=3)Fig.5 The expression of TGF-β1 and SPP1 in Ac-SDKP treated RAW264.7 cells medium(n=3)
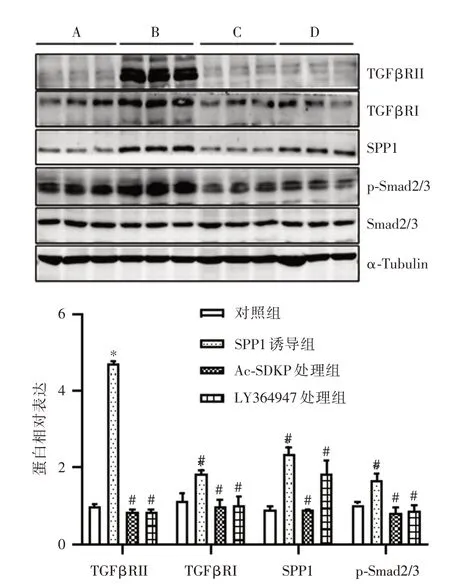
图6 TGFβRII、TGFβRI、p-Smad2/3 和SPP1 在Ac-SDKP、LY364947 处理的给予SPP1 重组蛋白的巨噬细胞中的表达(n=3)Fig.6 The expression of TGFβRII,TGFβRI,p-Smad2/3,SPP1 in Ac-SDKP and LY364947 treated RAW264.7 cells with SPP1 recombinant protein(n=3)
课题组前期利用动式染尘大鼠模型进行了转录组测序分析,发现了一些与矽肺纤维化进展有关的mRNA 与非编码RNA[12],综合差异变化倍数和丰度,发现SPP1 基因表达差异在实验性矽肺模型中具有代表性。SPP1 与心血管疾病、肿瘤、糖尿病、肾病关系密切,具有多种生物学功能,主要参与调控炎症,介导骨代谢和损伤修复,在调控巨噬细胞、T 细胞、破骨细胞功能等方面发挥了重要作用[13]。近年来发现,SPP1 在博来霉素介导的肺间质纤维化模型[7-8]、石棉肺小鼠模型[14]、辐照所致的肺间质纤维化模型[15]中表达均上调,提示SPP1在肺纤维化进展中可能起到了一定的调节作用。本研究结果显示,在动式染尘矽肺大鼠模型以及体外SiO2诱导的RAW264.7 细胞中,SPP1 均显著上调,IHC 结果也显示,SPP1 主要表达于矽肺结节内,且SiO2诱导后RAW264.7 细胞中SPP1 阳性染色明显增强,提示SPP1 可能参与了矽肺纤维化的进展。
在体外培养的来源于肝、皮肤和肺的成纤维细胞中,均发现SPP1能够激活TGF-β1信号,从而促进了肌成纤维细胞分化,加速了纤维化进程;SPP1 能够通过上调基质金属蛋白酶(matrix metalloproteinases 9,MMP9)的表达,进而激活TGF-β1,从而促小鼠成纤维细胞的胶原沉积[4-6,17-19]。本研究也发现,在实验性矽肺模型中,SPP1/TGF-β1 信号的激活伴随着胶原沉积和巨噬细胞活化。已有研究显示,采用单细胞RNA 测序发现,特发性肺纤维化中巨噬细胞亚群高表达SPP1[19],且在纤维化过程中随着炎症和纤维化程度的加深,SPP1 的表达逐渐升高[7],说明SPP1 可调节巨噬细胞极化并产生大量炎症介质和细胞因子[9,20]。在本研究中,予以SiO2诱导RAW264.7 细胞,细胞内和培养基中均检测到SPP1/TGF-β1 表达的增高;进一步采用SPP1重组蛋白诱导,可发现TGF-β1 信号的活化,予以TGF-β1 信号通路抑制剂则引起相反变化,提示SiO2能够刺激巨噬细胞分泌SPP1,进而活化TGFβ1 信号,参与了肺纤维化进展。
课题组对Ac-SDKP 的抗矽肺纤维化作用进行了系列研究[21-23],发现其能够通过抑制巨噬细胞活化和肌成纤维细胞分化,保护肺泡Ⅱ型上皮细胞从而拮抗矽肺纤维化进展。本研究中,体内外实验均提示,予以Ac-SDKP 能够抑制矽肺大鼠和体外RAW264.7 细胞中SPP1 表达水平的上调,并具有类似TGF-β1 信号通路抑制剂的作用,能够阻断SPP 对TGF-β1 信号的激活作用。
综上所述,本研究发现Ac-SDKP 通过对SPP1/TGF-β1 信号的阻断,抑制了巨噬细胞的活化,然而其具体作用机制,仍需进一步研究探讨。
