超声造影延迟相廓清的肝炎性病灶与肝细胞癌的鉴别与分析
2021-02-04周萍萍吴晓贝李珊珊罗鸿昌李开艳
黄 哲 周萍萍 吴晓贝 李珊珊 罗鸿昌 李开艳
肝内局灶性病灶的良恶性直接影响临床医师对患者后期治疗方式的选择,故准确诊断其良恶性是临床影像学研究的重点。超声造影可动态显示病灶内部血管构筑情况,不同增强模式有助于肝内局灶性病变的诊断。但部分肝炎性病灶超声造影可表现为“动脉相增强、延迟相廓清”模式,易被误诊为肝细胞癌,导致不必要的手术和治疗。超声造影定量分析能够客观准确地评估肝内局灶性病变的血流灌注状态[1]。本研究通过比较经手术或穿刺活检病理证实为肝炎性病灶与肝细胞癌患者的超声造影表现及定量分析结果,旨在探讨超声造影对两者的鉴别诊断价值。
资料与方法
一、研究对象
选取2012 年1 月至2019 年9 月我院经手术或穿刺活检病理证实的肝炎性病灶患者38 例(共38 个病灶)为肝炎性病灶组,男28例,女10例,年龄21~67岁,平均(47.2±11.4)岁,包括炎性假瘤29 例、结核瘤6 例、炎性肌纤维母细胞瘤3 例。病灶直径1.4~10.7 cm,中位数4.8 cm。入选标准:①临床资料完整,术前均行超声造影检查且表现为“动脉相增强,延迟相廓清”;②超声造影后1周内接受穿刺活检或手术病理诊断为肝炎性病变;③接受超声造影前未接受任何治疗。
随机选取同期经病理确诊的66 例肝细胞癌患者(共66个病灶)为肝细胞癌组,男58例,女8例,年龄32~75岁,平均(52.1±6.4)岁。病灶直径0.9~7.2 cm,中位数4.5 cm。入选标准:①临床资料完整,术前接受超声造影检查且表现为“动脉相增强,延迟相廓清”;②超声造影后1周内接受手术切除,经病理确诊为原发性肝癌;③接受超声造影前未接受任何治疗。排除标准:①临床诊断为肝细胞癌但无手术病理依据;②接受超声造影检查前接受过TACE 等治疗;③临床或超声造影资料不完整。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.一般资料获取:收集患者临床信息,包括年龄、性别、临床症状(肝区疼痛、腹胀、纳差、消瘦、黄疸、腹泻、上消化道出血、发热等)、乙肝病毒感染史,以及术前血清糖水平抗原(CA125)和甲胎蛋白(AFP)等一般资料和实验室检查结果。
2.超声造影检查:使用GE Logiq 9 彩色多普勒超声诊断仪,C1-5 凸阵探头,频率 2~5 MHz;机械指数0.07~0.09。造影剂使用 SonoVue(意大利 Bracco 公司),使用前加入5.0 ml 生理盐水,振荡配制成微泡混悬液。检查时先行常规二维超声检查,选择最佳观察切面,记录病灶位置、大小、形态、回声、内部血流等,切换至超声造影模式后嘱患者配合屏气或缓慢呼吸,以保持观察病灶处于观察切面中央。于肘前静脉注射1.2 ml 配置好的微泡混悬液,随后用5.0~10.0 ml 生理盐水冲洗,注射完毕立即实时观察病灶及周围肝组织在动脉相(10~30 s)、门脉相(31~120 s)及延迟相(121~360 s)的图像并储存。
3.图像及参数分析:将两组病灶的常规超声及超声造影图像随机排序。由两名具有两年以上超声诊断经验的医师在不知分组情况下共同读片,记录每个病灶的常规超声特征及造影各时相表现,并应用仪器自带的时间-强度(TIC)曲线分析软件进行定量分析。首先将感兴趣区放置在病灶的实性部位,软件自动描记出TIC 曲线,移动伪像及较大血管排除在感兴趣区外,以避免测量误差。常规超声特征包括病灶的位置、分布、大小、形态、边界、内部回声及血流。超声造影特征包括动脉相病灶增强模式和峰值时增强形态、门脉相增强程度及病灶内有无坏死无增强区;TIC 曲线分析观察记录造影剂达到时间(RT)、增强上升斜率、曲线下面积(AUC)、达峰时间(TTP)、平均通行时间(MTT)、峰值强度(PI)及下降时间(FT)。
三、统计学处理
应用SPSS 22.0 统计软件,连续资料以中位数(最小值~最大值)表示,行Mann-WhitneyU检验;计数资料以率、频数表示,行χ2检验或Fisher精确检验。应用Mann-WhitneyU检验对连续变量进行单变量分析,χ2检验或Fisher 精确检验对分类变量进行单变量分析,Logistic 回归分析对多分类变量进行分析。P<0.05为差异有统计学意义。
结 果
一、两组一般资料和实验室生化检查结果比较
两组在性别、症状、乙肝病毒感染史、CA125及AFP水平比较,差异均有统计学意义(均P<0.05)。见表1。
二、两组常规超声和超声造影表现比较
两组在血流信号、边界比较,差异均有统计学意义(均P<0.05),见表2。 肝炎性病灶组超声造影提示形态不规则和边界不清晰的比例均高于肝细胞癌组,差异均有统计学意义(均P<0.01);肝炎性病灶组表现为门脉相低增强30 例、等增强8 例,肝细胞癌组表现为门脉相低增强26例、等增强34例、高增强6例,两组在增强强度方面比较差异有统计学意义(P<0.01)。见表3和图1,2。
三、超声造影定量分析
定量分析结果显示:肝炎性病灶组AUC 大于肝细胞癌组,FT 和MTT 均小于肝细胞癌组,差异均有统计学意义(均P<0.01),见表4。
单变量分析结果显示,AUC>365.281、MTT<22 s、FT<35.5 s 鉴别肝炎性病灶与肝细胞癌的敏感性和特异性分别为100%和68.2%、92.4%和73.7%、100%和60.5%,见表5。Logistic 回归多变量分析结果显示,AUC>365.281诊断肝炎性病灶为良性病变的符合率为100%。
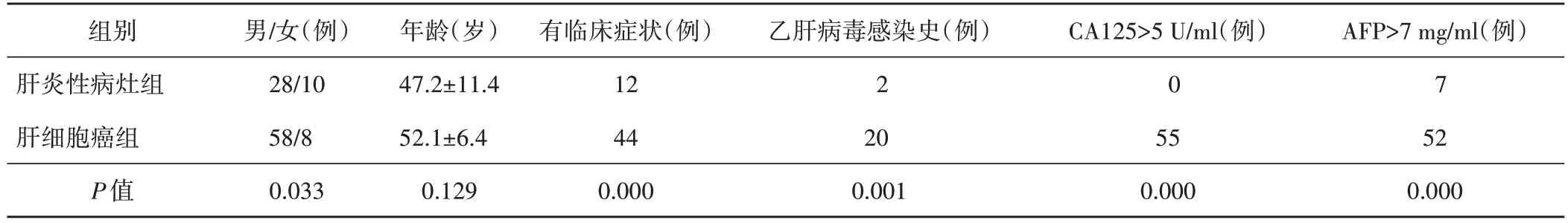
表1 两组一般资料和实验室检查结果比较
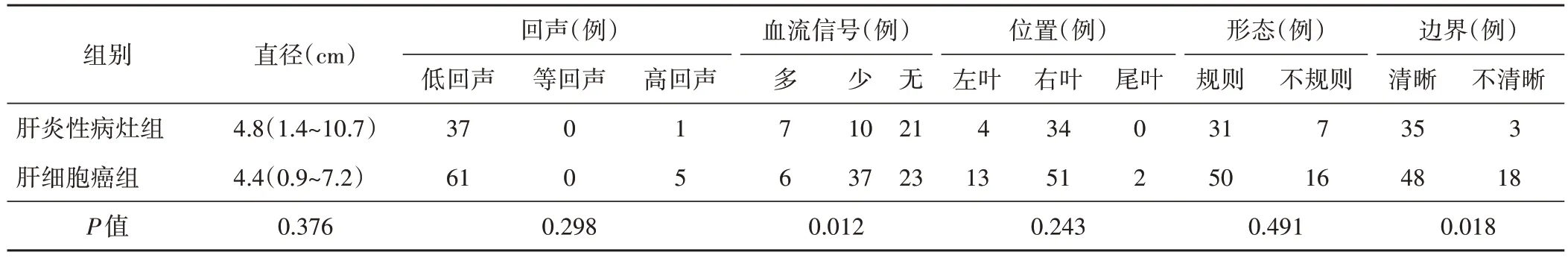
表2 两组常规超声表现比较
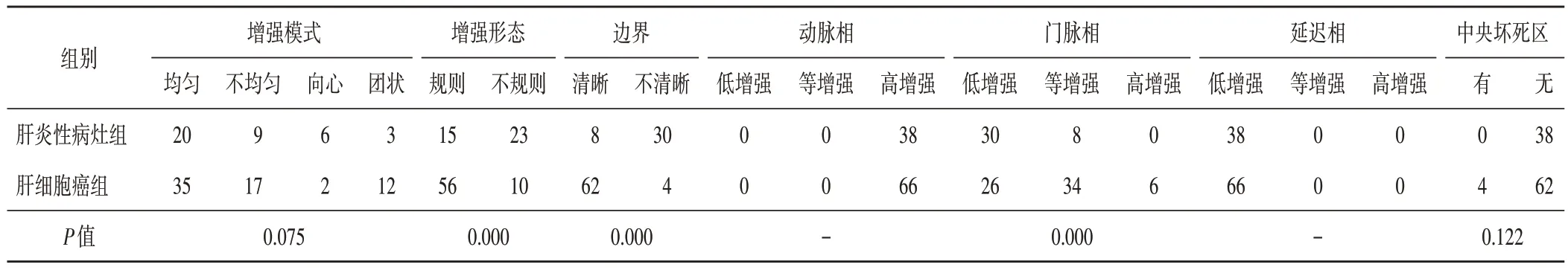
表3 两组超声造影表现比较 例
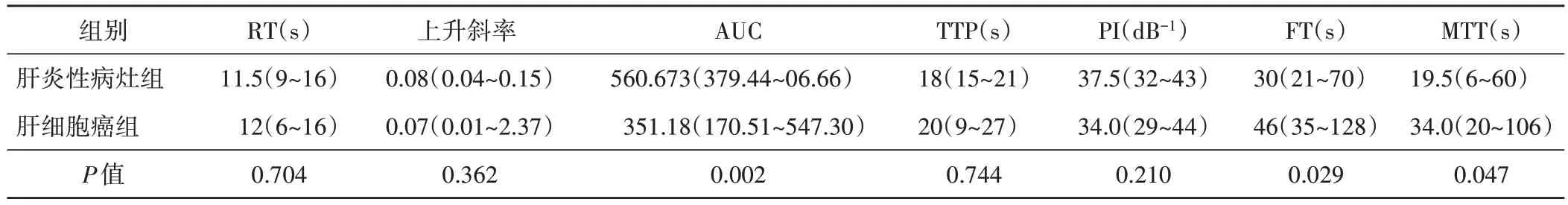
表4 两组超声造影TIC曲线定量分析结果比较[中位数(最小值~最大值)]

讨 论
肝炎性病灶以增生变性的纤维组织伴浆细胞、淋巴细胞浸润为特点,是一种罕见的肝内局灶性良性病变[2]。根据欧洲超声造影指南[3]标准,典型的肝脏良性病变超声造影表现为门脉相和延迟相持续增强,肝脏恶性病变表现为门脉相和/或延迟相造影剂廓清。由于部分肝炎性病灶可表现为“动脉相增强,延迟相廓清”模式,易被误诊为肝细胞癌,导致不必要的手术及治疗。因此,探讨延迟相廓清的肝炎性病灶的影像学特点及其与肝细胞癌的鉴别诊断要点具有重要的临床价值。
本研究纳入的肝炎性病灶患者中,26.3%为女性,31.58%出现上腹间歇性疼痛、发热、消化不良等一般症状,而肝细胞癌患者多发于男性,且由于肿瘤的恶性生物学行为出现严重不适,如肝区疼痛、纳差、消瘦,黄疸、上消化道出血等[4]。本研究中7 例肝炎性病灶患者伴有乙肝病毒感染史,但研究[5]认为乙肝病毒感染可能并非肝炎性病灶的相关致病因素,而肝细胞癌与乙肝病毒感染和肝硬化明显相关。目前对于肝炎性病灶的诊断尚无有效的实验室检查指标,患者肝功能正常,肿瘤标志物多呈阴性,本研究中仅7例患者AFP 出现轻度增高,而CA125 异常升高仅见于肝细胞癌患者。
本研究中肝炎性病灶常规超声多表现为低回声,与既往研究[6]结果相符。彩色多普勒可显示病灶内部血流情况,邱丽娜等[7]研究表明小肝癌病灶内部及周边的血流显示率高于肝炎性病灶,本研究结果与其相似。但仍有较多病灶CDFI无法显示其血流情况,尤其当病灶受心脏及周围大血管衰减干扰较大时,由于CDFI对低速血流检测不敏感,难以提供稳定可靠的血流灌注信息。
超声造影可以动态观察病灶的微循环灌注,提高诊断符合率。肝细胞癌以肝动脉供血为主,超声造影动脉相常表现为高增强;而肝炎性病灶内部为炎细胞浸润,炎性肉芽肿伴新生血管形成,导致肝动脉代偿性灌注,也呈动脉相高增强。肝炎性病灶超声造影动脉相增强表现多样[8],本研究中肝炎性病灶在动脉相呈均匀或不均匀、向心、团状增强,这可能与病灶内炎性细胞成分构成、坏死和纤维化程度及新生血管分布不同有关,由于肝炎性病灶的炎性细胞向周围正常肝组织蔓延,无明确界限,导致病灶增强的形态不规则、边界不清;而病灶延迟相出现廓清,分析与伴发闭塞性静脉炎而导致门静脉供血不足有关[9]。本研究中肝细胞癌超声造影表现为增强峰值时,形态较规则,边缘清晰,原因是肝细胞癌多呈膨胀性生长,可向四周压迫正常肝组织。
超声造影定量参数能客观反映病灶内部血流灌注情况。董彩虹等[10]研究通过肉眼观察肝炎性假瘤病灶超声造影表现,发现肝炎性假瘤增强持续时间短,动脉相增强程度较肝脏恶性肿瘤低,且病灶内造影剂减退较肝脏恶性肿瘤的程度低、速度慢。本研究超声造影定量分析发现肝炎性病灶组造影剂MTT 较肝细胞癌组缩短,动脉相增强程度与肝细胞癌相似,与上述研究结果部分相似。究其原因,肝炎性病灶内部为炎细胞浸润伴新生血管形成,肝动脉代偿性灌注,致动脉相增强程度与肝细胞癌相似,尤其当病灶内或病灶周边出现胆管扩张时更难以鉴别。本研究肝炎性病灶内造影剂减退较肝细胞癌组快,增强持续时间缩短。原因为肝炎性病灶伴发闭塞性静脉炎而导致门静脉血供不足造影剂减退,其中肝细胞癌静脉回流系统主要以肝静脉为主[11],故肝炎性病灶内造影剂减退较肝细胞癌快。本研究通过超声造影定量参数定量分析更客观地反映病灶内部灌注情况。
综上所述,超声造影通过动态观察肝炎性病灶与肝细胞癌的微循环血流灌注情况,可为其鉴别诊断提供更多信息,超声造影定量分析可更客观地显示肝脏炎性病灶的血流灌注特征,具有较好的临床应用价值。
