基于分子对接技术的藤茶总黄酮对高尿酸血症肾功能损伤保护机制研究
2021-02-03李佳川李思颖
李佳川,李思颖
西南民族大学药学院,四川 成都 610041
肾功能损伤是高尿酸血症(hyperuricemia,HUA)临床最常见并发症之一,体内血尿酸产生过多或肾脏排泄尿酸减少,尿酸盐达过饱和状态而沉积于肾间质和输尿管,从而引起肾脏病变[1]。HUA肾功能损伤主要病理学改变为慢性肾间质、肾小管病变,并伴有局部炎症反应发生[2]。近年来,HUA并发的肾功能损伤发病率呈升高趋势,男性患者多于女性,其发病隐匿,早期无明显临床症状。临床上常用的化学药物多为别嘌醇、非布司他和苯溴马隆等[3],通过抑制尿酸生成和促进尿酸排泄来改善尿酸代谢,但对并发的肾功能损伤尚无确切疗效。糖尿病、HUA 等代谢性疾病是中医药防治的优势病种,中医药及少数民族医药对其相关并发症具有较好的临床治疗优势。
藤茶,又称莓茶、龙须茶、客家白茶,由显齿蛇葡萄Ampelopsis grossedentata(Hand.-Mazz.) W.T.Wang 的嫩枝叶加工而成,具有清热解毒、活血通络的功效[4],主要分布于四川、贵州、湖南、湖北、广西等少数民族地区[5-6],具有药食同源之性。藤茶含有黄酮类[7]、多糖类[8]、酚类[9]、氨基酸[10]等多种活性成分,其黄酮类成分含量最为丰富,主要有二氢杨梅素、藤茶素、槲皮素、杨梅素等,其中二氢杨梅素的质量分数高达35%,被认为是藤茶发挥保健功效的重要药效物质基础[11-12]。现代药理学研究表明,藤茶及其总黄酮部位具有抗氧化[13]、降血压[14]、调血脂[15]、抗动脉粥样硬化[16]、心血管保护[17]、抗肝癌[18]等药理作用。课题组前期通过对藤茶民族习用地区大量走访和临床实践反馈后发现,藤茶作为药食两用植物,在多个少数民族地区均有治疗痛风和慢性肾炎的民间习用和文献记载情况[19],但其治疗HUA 肾功能损伤的作用机制相关研究较少。因此,本研究采用分子对接技术,综合藤茶总黄酮中代表性活性成分,深入探讨药物组分与尿酸生成和排泄相关蛋白靶点的相互作用,并建立腺嘌呤联合乙胺丁醇致HUA 肾功能损伤大鼠模型进行验证,系统探讨藤茶总黄酮提取物对HUA肾功损伤的保护作用,以期为少数民族地区药食资源藤茶的进一步保健开发提供科学依据。
1 材料
1.1 动物
SPF 级雄性Wister 大鼠50 只,7 周龄,体质量200~220 g,购于四川省成都达硕实验动物研究中心,许可证号SCXK(川)2015-030。动物饲养于西南民族大学药学院SPF 级动物实验室,温度(24±2)℃,相对湿度(55±5)%,每12 小时昼夜间断性照明,适应性饲养1 周。动物实验经西南大学药学院实验动物伦理委员会批准(批准号2019-05)。
1.2 药材
藤茶药材市售,产地湖南省张家界市,经西南民族大学顾健教授鉴定为葡萄科植物显齿蛇葡萄A.grossedentata(Hand.-Mazz.) W.T.Wang的干燥嫩枝叶。藤茶粉碎后过40 目筛,称取适量干燥藤茶,按1∶10 加入蒸馏水,于100 ℃回流提取2 次,每次2 h,滤过,合并滤液,减压蒸发浓缩得浸膏。将浸膏用D-101 大孔树脂吸附,水洗近无色后,用95%乙醇洗脱,收集洗脱液,回收乙醇,得纯化物,干燥即得藤茶总黄酮(total flavonoids fromA.grossedentata,AGTF)。以二氢杨梅素为对照品,采用AlCl3比色法测定AGTF 质量分数为84.16%。
1.3 药品与试剂
别嘌醇片(批号20181206,国药准字H34021248,规格0.1 g/片)购自合肥九联制药有限公司;二氢杨梅素对照品(批号MUST-14013108,质量分数≥98%)购自成都曼思特生物科技有限公司;腺嘌呤(批号D1915072,质量分数≥99.5%)购自上海阿拉丁生化科技股份有限公司;盐酸乙胺丁醇片(批号T19B030,规格0.25 g/片)购自杭州民生药业有限公司;尿酸试剂盒(批号20190407)、黄嘌呤氧化酶(xanthine oxidase,XOD)试剂盒(批号20190330)、腺苷脱氨酶(adenosine deaminase,ADA)试剂盒(批号20190403)、肌酐试剂盒(批号20191021)、尿素氮试剂盒(批号20191022)均购自南京建成生物工程研究所;尿酸重吸收转运体1(uric acid reabsorption transporter 1,URAT1)抗体(批号bs-10357R)、葡萄糖转运蛋白9(glucose transporter 9,GLUT9)抗体(批号bs-13388R)、三磷酸腺苷结合盒转运蛋白G2(adenosine triphosphate binding cassette transporter G2,ABCG2)抗体(批号bs-0662R)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)抗体(批号bs10802R)、白细胞介素-1β(interleukin-1β,IL-1β)抗体(批号bs0812R)、白细胞介素-6(interleukin-6,IL-6)抗体(批号bs23660R)、转化生长因子-β(transforming growth factor-β,TGF-β)抗体(批号bs0086R)、辣根过氧化物酶标记的羊抗兔IgG(批号bs0295G-HRP)均购自北京博奥森生物技术有限公司;苏木素染液(批号G1005-1)、伊红染液(批号G1001)购自武汉赛维尔生物技术有限公司;β-actin抗体(批号00083126)购自美国Proteintech 公司;SDS-PAGE 凝胶制备试剂盒、BCA 蛋白定量检测试剂盒均购自上海碧云天生物技术有限公司。
1.4 仪器
CYT5M 型多功能全波长酶标仪(美国BioTek公司);H165-W 型高速微量离心机(湖南湘仪实验室仪器开发有限公司);Mini-Sub Cell GT Cell 型水平电泳系统、ChemiDoc 免染蛋白印迹系统(美国Bio-Rad 公司);BMJ-Ⅲ型包埋机(常州郊区中威电子仪器厂);PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司);BA400 型数码三目摄像显微镜(麦克奥迪实业集团有限公司)。
2 方法
2.1 AGTF 主要活性成分与疾病相关靶点的分子对接
尿酸代谢涉及尿酸生成(即嘌呤分解代谢)与尿酸排泄等多个途径。XOD 和ADA 是尿酸生成途径中的重要靶蛋白,也是抗HUA 药物设计的关键靶点;URAT1、GLUT9 和ABCG2 是促尿酸排泄药物作用的靶点[20-22]。以上靶点对AGTF 潜在药效物质的筛选及临床诊断、治疗具有重要意义。根据文献报道[11-23],将藤茶总黄酮提取物中发挥药理作用的主要活性成分二氢杨梅素、杨梅素、槲皮素和藤茶素作为配体,以URAT1、GLUT9、ABCG2、XOD和ADA 蛋白为受体,分别进行分子对接,并以临床上降尿酸首选药物黄嘌呤氧化酶抑制剂别嘌醇作为阳性对照[24]。
2.1.1 化合物的处理 运用 PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)下载或Chemdraw 软件绘制二氢杨梅素、杨梅素、槲皮素和藤茶素的2D 结构,采用PyRx 软件对化合物分子进行能量最小化,保存为pdb 格式,作为配体备用。
2.1.2 蛋白结构的预测与筛选 在NCBI 数据库(https://www.ncbi.nlm.nih.gov/)中分别检索URAT1、GLUT9、ABCG2、XOD 和ADA 的蛋白质序列,并利用SWISS-MODEL 同源建模平台(https://swissmodel.expasy.org/)预测所有蛋白质序列的三维蛋白结构。通过SAVES v5.0 在线平台(https://servicesn.mbi.ucla.edu/SAVES/)对预测出的三维蛋白结构进行评分,根据Verify分析和Ramachandran图立体化学质量评估的数据,筛选出评分高的模型作为预测的靶蛋白结构。
2.1.3 受体蛋白的准备 利用AutoDock Tools 软件,对筛选出的靶蛋白除水、加氢、添加原子电荷、设置原子类型,存为pdbqt 格式,作为受体备用。
2.1.4 分子对接 运用PyRx 软件中的AutoDock Vina 将化合物与受体蛋白分别进行分子对接,并对对接结果进行分析。
2.2 动物实验验证
2.2.1 分组、造模和给药 根据前期预实验结果,大鼠随机分成对照组、模型组、别嘌醇(50 mg/kg,别嘌醇溶于蒸馏水配制成0.5%溶液)组和AGTF(0.25、0.50 g/kg,AGTF 溶于蒸馏水分别配成质量浓度为25、50 mg/mL 的溶液)组,每组10 只。腺嘌呤和盐酸乙胺丁醇溶于蒸馏水配制成1%腺嘌呤、2.5%盐酸乙胺丁醇的混悬液,除对照组ig 等体积生理盐水外,其余各组ig 混悬液(10 mL/kg)[25],1 次/d,连续14 d。于造模第8 天,各给药组ig 药物(10 mL/kg),对照组和模型组ig 等体积生理盐水,1 次/d,连续14 d。
2.2.2 AGTF 对大鼠血清中XOD、ADA 活性和尿酸、肌酐、尿素氮水平的影响 大鼠禁食不禁水24 h,末次给药1 h 后ip 10%水合氯醛(0.3 mL/100 g)麻醉,腹主动脉取血,分离血清,按试剂盒说明书检测血清中XOD 和ADA 活性和尿酸、肌酐、尿素氮水平。
2.2.3 AGTF 对大鼠肾脏组织病理变化的影响 大鼠脱颈椎处死,分离大鼠肾脏组织,用冰生理盐水冲洗,滤纸拭干后称定质量,计算肾脏指数;取部分肾脏组织以4%多聚甲醛固定,脱水、修剪、包埋、切片、苏木素-伊红(HE)染色,于显微镜下观察肾脏组织的病理变化。
2.2.4 AGTF 对大鼠肾脏组织URAT1、GLUT9、ABCG2、TNF-α、IL-1β、IL-6 和TGF-β 蛋白表达的影响 采用免疫组化法检测肾脏组织URAT1、GLUT9、ABCG2 蛋白表达[26];取剩余肾脏组织于液氮中冻存,采用Western blotting 法检测肾脏组织中炎症因子TNF-α、IL-1β、IL-6 和TGF-β 蛋白的表达[27]。
2.3 统计学方法
实验结果采用SPSS 20.0 软件进行统计分析,采用Image-Pro Plus6.0软件进行图像分析。结果以表示,数据用单因数方差分析进行组间比较。
3 结果
3.1 AGTF 主要活性成分与疾病相关靶点的分子对接结果
结合能小于0 则配体与受体可以自由结合,结合能越低表明受体与配体间的亲和力越大,二者发生相互作用的可能性越高。如表1 所示,二氢杨梅素、杨梅素、槲皮素、藤茶素和别嘌醇与抗HUA 靶点蛋白的对接结合能均小于0,表明AGTF 主要活性成分均与URAT1、GLUT9、ABCG2、ADA、XOD 受体蛋白有较好的结合活性,能较稳定地自发结合,且结合作用优于别嘌醇。AGTF 中含量最高的二氢杨梅素与各靶蛋白的对接模式如图1、2 所示,二氢杨梅素与各受体蛋白通过范德华力、氢键等多个价键结合,表明二氢杨梅素与受体蛋白的结合具有较高的稳定性。

表1 藤茶总黄酮主要活性成分和别嘌醇与疾病蛋白靶点的分子对接结果Table 1 Molecular docking of allopurinol and main active components of AGTF with disease protein targets
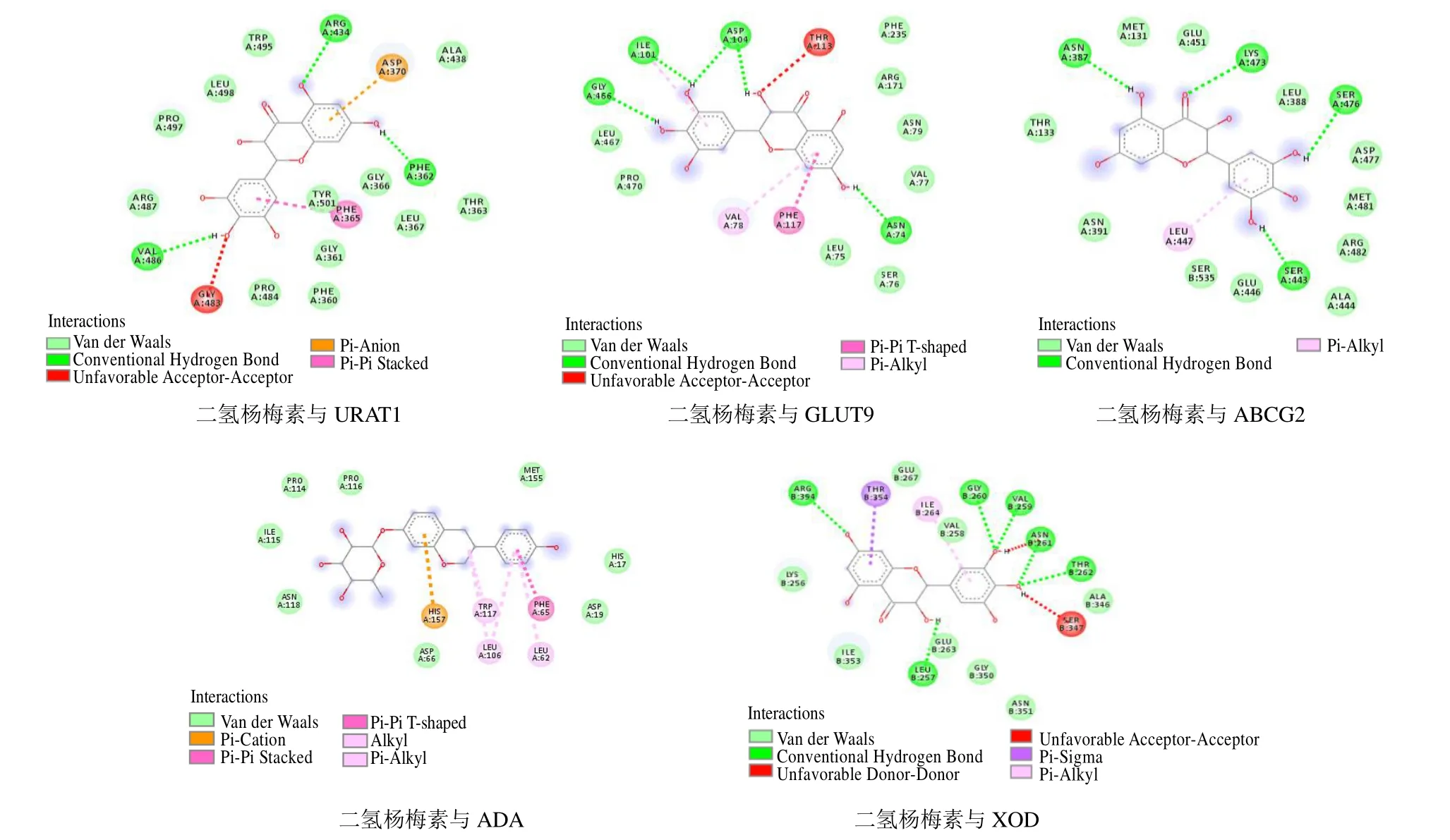
图1 二氢杨梅素与受体蛋白的活性结合位点Fig.1 Active binding sites of dihydromyricetin with receptor protein

图2 二氢杨梅素与疾病相关靶点的分子对接模式Fig.2 Molecular docking patterns of dihydromyricetin and disease-related targets
3.2 AGTF 对HUA 大鼠一般情况及肾脏指数的影响
对照组大鼠体态正常、精神状态良好、活动自如、行动敏捷,无不良症状。模型组大鼠排尿增多、毛色较暗且粗糙、体形明显消瘦,部分大鼠死亡。各给药组大鼠表现介于对照组和模型组之间。如表2 所示,与对照组比较,模型组大鼠的肾脏指数明显增加(P<0.01),肾脏指数升高93.71%,表明腺嘌呤联用乙胺丁醇可成功诱导大鼠肾功能损伤。与模型组比较,AGTF 能够明显降低HUA 大鼠的肾脏指数(P<0.01),表明AGTF 对HUA 大鼠具有一定保护作用。
3.3 AGTF 对HUA 大鼠血清中尿酸水平、XOD 和ADA 活性的影响
如表3 所示,与对照组比较,模型组大鼠血清中尿酸水平、XOD 和ADA 活性均明显升高(P<0.01),表明模型大鼠尿酸代谢异常。与模型组比较,AGTF 组大鼠血清尿酸水平、XOD 和ADA 活性均明显降低(P<0.05、0.01),表明AGTF 具有改善尿酸代谢和抗HUA 作用。
表2 AGTF 对HUA 大鼠肾脏指数的影响 ()Table 2 Effect of AGTF on renal index in HUA rats

表2 AGTF 对HUA 大鼠肾脏指数的影响 ()Table 2 Effect of AGTF on renal index in HUA rats
与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05##P<0.01,下表同*P < 0.05 **P < 0.01 vs control group; #P < 0.05 ##P < 0.01 vs model group,same as belows
组别 剂量/(g·kg-1) 肾脏指数/(mg·g-1)对照 — 07.90±0.18模型 — 15.30±0.94**别嘌醇 0.05 15.72±0.46 AGTF 0.50 11.60±0.36##0.25 10.51±0.44##
3.4 AGTF 对HUA 大鼠血清中肌酐和尿素氮水平的影响
如表4 所示,与对照组比较,模型组大鼠血清中肌酐和尿素氮水平均明显升高(P<0.01),表明模型大鼠肾功能异常。与模型组比较,AGTF 组大鼠血清中肌酐和尿素氮水平均明显降低(P<0.01),表明AGTF 能有效改善HUA 大鼠肾功能损伤,保护肾脏。
表3 AGTF 对HUA 大鼠血清中尿酸水平、XOD 和ADA 活性的影响 ()Table 3 Effect of AGTF on uric acid level,XOD and ADA activities in serum of HUA rats ()

表3 AGTF 对HUA 大鼠血清中尿酸水平、XOD 和ADA 活性的影响 ()Table 3 Effect of AGTF on uric acid level,XOD and ADA activities in serum of HUA rats ()
组别 剂量/(g·kg-1) 尿酸/(μmol·L-1) XOD/(U·L-1) ADA/(U·mL-1)对照 — 040.87±4.64 12.97±0.15 15.06±0.44模型 — 112.08±6.09** 21.13±0.42** 19.59±1.04**别嘌醇 0.05 055.28±5.60## 14.08±0.20## 16.45±0.65##AGTF 0.50 066.87±4.85## 16.30±0.39## 17.22±0.50##0.25 074.37±4.02## 16.79±0.38## 17.86±0.54#
表4 AGTF 对HUA 大鼠血清中肌酐和尿素氮水平的影响()Table 4 Effect of AGTF on creatinine and urea nitrogen levels in serum of HUA rats ()
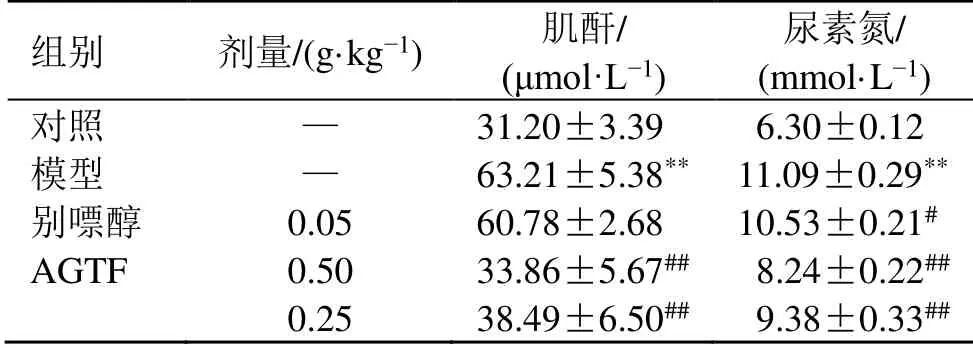
表4 AGTF 对HUA 大鼠血清中肌酐和尿素氮水平的影响()Table 4 Effect of AGTF on creatinine and urea nitrogen levels in serum of HUA rats ()
组别 剂量/(g·kg-1) 肌酐/(μmol·L-1)尿素氮/(mmol·L-1)对照 — 31.20±3.39 06.30±0.12模型 — 63.21±5.38** 11.09±0.29**别嘌醇 0.05 60.78±2.68 10.53±0.21#AGTF 0.50 33.86±5.67## 08.24±0.22##0.25 38.49±6.50## 09.38±0.33##
3.5 AGTF 对HUA 大鼠肾脏组织病理变化的影响
如图3 所示,模型组大鼠肾小球基底膜增厚,肾小管结构坏死,间质内纤维组织增生。AGTF 组大鼠肾脏组织被膜较为完整,皮质和髓质分界较为清晰,肾小球结构基本正常,肾小管排列较为整齐,肾小管上皮细胞变性、坏死的情况相较于模型组较少,偶见肾小管管腔内少量中性粒细胞渗出,病变区域间质内纤维组织增生的情况有所减少,病变程度较模型组轻。
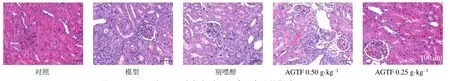
图3 AGTF 对HUA 大鼠肾脏组织病理变化的影响 (HE,×100)Fig.3 Effect of AGTF on pathological change of renal tissue in HUA rats (HE,× 100)
3.6 AGTF 对HUA 大鼠肾脏组织相关炎症因子蛋白表达的影响
如图4 和表5 所示,与对照组比较,模型组大鼠肾脏组织中TNF-α、IL-1β、IL-6 和TGF-β 蛋白表达水平明显升高(P<0.01),表明HUA 伴有局部炎症反应。与模型组比较,AGTF 组大鼠肾脏组织中TNF-α、IL-1β、IL-6 和TGF-β 蛋白表达均显著降低(P<0.05、0.01),表明AGTF 能抑制促炎症因子合成与释放,减少肾脏间质纤维化的形成,有效保护肾脏组织。

图4 AGTF 对HUA 大鼠肾脏组织中TNF-α、IL-1β、IL-6和TGF-β 蛋白表达的影响Fig.4 Effect of AGTF on expressions of TNF-α,IL-1β,IL-6,and TGF-β in HUA rats
表5 AGTF 对HUA 大鼠肾脏组织TNF-α、IL-1β、IL-6 和TGF-β 蛋白表达的影响 ()Table 5 Effect of AGTF on expressions of TNF-α,IL-1β,IL-6,and TGF-β in kidney of HUA rats ()

表5 AGTF 对HUA 大鼠肾脏组织TNF-α、IL-1β、IL-6 和TGF-β 蛋白表达的影响 ()Table 5 Effect of AGTF on expressions of TNF-α,IL-1β,IL-6,and TGF-β in kidney of HUA rats ()
组别 剂量/(g·kg-1) 蛋白相对表达量TNF-α IL-1β IL-6 TGF-β对照 — 0.34±0.07 0.21±0.06 0.32±0.06 0.43±0.05模型 — 1.00±0** 1.00±0** 1.00±0** 1.00±0**别嘌醇 0.05 0.57±0.11## 0.48±0.08## 0.57±0.11## 0.63±0.13##AGTF 0.50 0.39±0.09## 0.35±0.13## 0.36±0.12## 0.53±0.08##0.25 0.82±0.06# 0.64±0.14## 0.70±0.09## 0.76±0.12##
3.7 AGTF 对HUA 大鼠肾脏组织URAT1、GLUT9和ABCG2 蛋白表达的影响
由图5~7 和表6 所示,与对照组比较,模型组大鼠肾脏组织尿酸盐重吸收相关蛋白URAT1、GLUT9 表达显著升高(P<0.05、0.01),促进尿酸盐排泄相关蛋白ABCG2 表达显著降低(P<0.01)。与模型组比较,AGTF 组大鼠肾脏组织URAT1、GLUT9 蛋白表达显著降低(P<0.05、0.01),ABCG2蛋白表达显著升高(P<0.05、0.01),表明AGTF能够通过抑制尿酸盐在肾脏的重吸收,促进尿酸排泄,从而减轻尿酸盐沉积对肾脏组织的损伤,起到保护肾脏组织的作用。

图5 AGTF 对HUA 大鼠肾脏组织URAT1 蛋白表达的影响 (×400)Fig.5 Effect of AGTF on expression of URAT1 in kidney of HUA rats (× 400)
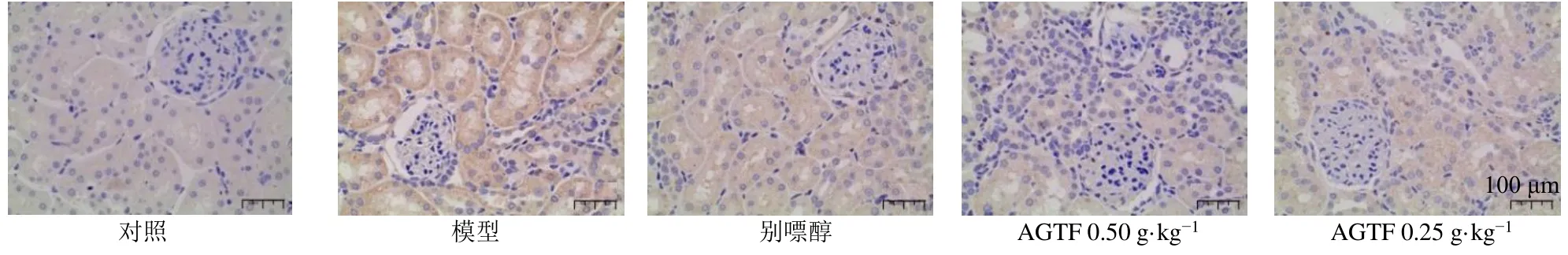
图6 AGTF 对HUA 大鼠肾脏组织GLUT9 蛋白表达的影响 (×400)Fig.6 Effect of AGTF on expression of GLUT9 in kidney of HUA rats (× 400)

图7 AGTF 对HUA 大鼠肾脏组织ABCG2 蛋白表达的影响 (×400)Fig.7 Effect of AGTF on expression of ABCG2 in kidney of HUA rats (× 400)
表6 AGTF 对HUA 大鼠肾脏组织URAT1、GLUT9 和ABCG2 蛋白表达的影响 ()Table 6 Effect of AGTF on expressions of URAT1,GLUT9,and ABCG2 in kidney of HUA rats ()
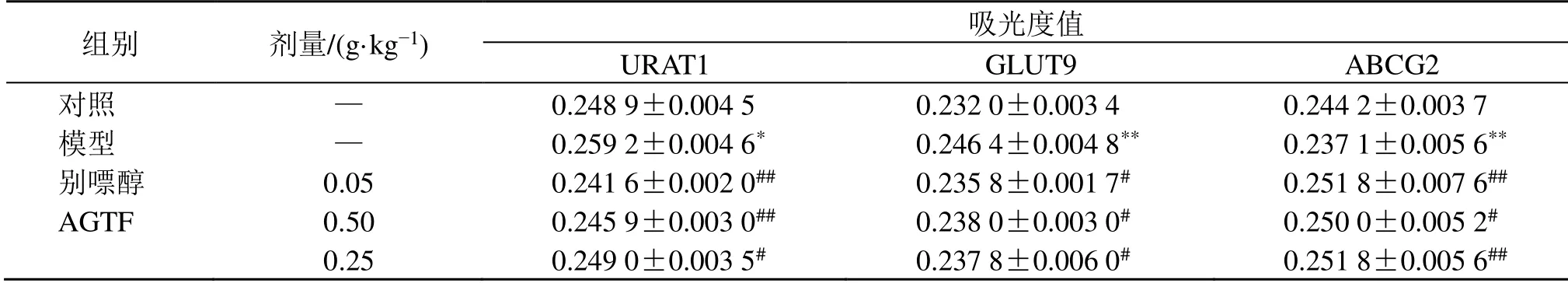
表6 AGTF 对HUA 大鼠肾脏组织URAT1、GLUT9 和ABCG2 蛋白表达的影响 ()Table 6 Effect of AGTF on expressions of URAT1,GLUT9,and ABCG2 in kidney of HUA rats ()
组别 剂量/(g·kg-1) 吸光度值URAT1 GLUT9 ABCG2对照 — 0.248 9±0.004 5 0.232 0±0.003 4 0.244 2±0.003 7模型 — 0.259 2±0.004 6* 0.246 4±0.004 8** 0.237 1±0.005 6**别嘌醇 0.05 0.241 6±0.002 0## 0.235 8±0.001 7# 0.251 8±0.007 6##AGTF 0.50 0.245 9±0.003 0## 0.238 0±0.003 0# 0.250 0±0.005 2#0.25 0.249 0±0.003 5# 0.237 8±0.006 0# 0.251 8±0.005 6##
4 讨论
近年来,由于饮食习惯和生活条件的改变,人们大量摄入高嘌呤食物,HUA 患病率逐年增加,成为仅次于糖尿病严重危害人类健康的“第四高”。肾功能损伤是HUA 临床最常见并发症之一,尿酸是嘌呤代谢的最终产物[28],尿酸的生成与排泄之间的失衡是直接诱导HUA 肾功能损伤的主要原因,维持正常的血尿酸水平对预防肾脏疾病的发生发展具有重要的临床意义。藤茶作为多民族地区药食保健资源具有丰富的活性成分,其开发价值较大。
XOD 和ADA 是尿酸生成途径中的重要靶蛋白,在嘌呤分解代谢过程中发挥着重要作用,抑制其活性可以有效控制血清尿酸水平。肾脏是尿酸排泄的主要器官[29-30],由于尿酸不能自由通过细胞膜,肾小管上皮细胞上的尿酸转运蛋白URAT1、GLUT9 和ABCG2 参与尿酸盐的分泌与重吸收,为肾脏调节尿酸代谢的重要靶点[31]。本研究将AGTF主要活性成分与 HUA的5个潜在治疗靶点(URAT1、GLUT9、ABCG2、XOD、ADA)进行分子对接模拟,结果显示AGTF 中主要活性成分二氢杨梅素、杨梅素、槲皮素和藤茶素与疾病相关靶点均具有较好的结合活性,表明这些成分可能是AGTF 中改善HUA 及其肾功能损伤的潜在药效物质。其中,藤茶素的对接得分最高,其次是二氢杨梅素,目前对藤茶素的药理活性研究较少,而二氢杨梅素作为AGTF 的主要活性成分,除了在降血糖、调血脂、抑菌、抗炎、镇痛、抗氧化、抗肿瘤、保肝护肝、免疫调节等方面具有较好的药理活性[32-33],还能够显著降低小鼠血清中尿酸水平,具有保护和治疗肾脏损伤的作用[34]。对接结果还发现,别嘌醇与5 个受体蛋白都能自由结合,其中与XOD 靶点的结合能最小,表明别嘌醇与XOD 的相互作用最强,与其能够抑制XOD 从而减少尿酸产生的报道一致[35]。与别嘌醇的对接结果相比,AGTF 的主要活性成分与5 个受体蛋白发生相互作用的可能性均高于别嘌醇,提示AGTF 在抗HUA 及其肾功能损伤方面具有潜在的临床应用价值,AGTF 可能通过二氢杨梅素、杨梅素、槲皮素和藤茶素等活性成分作用于URAT1、GLUT9、ABCG2、ADA 和XOD 靶点,发挥治疗HUA 肾功能损伤的药效作用,体现了中药多成分、多靶点的特点。
基于分子对接结果,本研究采用腺嘌呤和乙胺丁醇复合建立大鼠HUA 肾功能损伤模型,通过体内实验进一步探讨了AGTF 对HUA 肾功能损伤的保护作用及机制。结果表明,AGTF 组大鼠血清中XOD、ADA 活性和尿酸、肌酐、尿素氮水平均显著降低,肾脏组织病理学改变明显减轻,表明AGTF具有较好的降低血尿酸水平、改善尿酸代谢、减轻高尿酸盐沉积对肾脏组织损伤的作用,其作用机制可能与调节尿酸盐转运蛋白URAT1、GLUT9 和ABCG2 表达,抑制炎症因子TNF-α、IL-1β、IL-6和TGF-β 蛋白表达等途径有关。AGTF 一方面能明显抑制URAT1、GLUT9 转运蛋白的表达,阻碍肾近曲小管尿酸盐的重吸收;另一方面通过上调ABCG2 转运蛋白的表达,增强肾近曲小管外侧膜上的尿酸盐转运速率,促进肾脏尿酸盐的排泄,协同降低尿酸水平、减少尿酸盐在肾小管的沉积,从而减轻肾功能损伤。过多的尿酸盐在肾脏的堆积会刺激肾小管上皮细胞,促进局部炎症反应,导致肾间质纤维化,AGTF 能够显著降低大鼠肾脏中TNF-α、IL-1β、IL-6 和TGF-β 的蛋白表达,抑制炎症反应,保护肾功能,延缓肾脏间质纤维化。
综上所述,本研究通过分子对接技术结合体内实验,发现AGFT 不仅能够调节尿酸盐转运蛋白URAT1、GLUT9 和ABCG2 的表达,降低大鼠血清中尿酸代谢相关指标水平,有效改善HUA 和肾脏病理反应,同时还能抑制肾脏炎症反应,发挥对HUA 肾功能损伤的保护作用。与分子对接结果一致,AGTF 能够直接作用于XOD、ADA、URAT1、GLUT9、ABCG2 关键靶蛋白,从而发挥其治疗作用,表明分子对接结果具有可靠性和合理性。
利益冲突所有作者均声明不存在利益冲突
