壳聚糖交联介孔二氧化硅固定化β-葡萄糖苷酶生物转化淫羊藿苷研究
2021-02-03刘聪燕李瑞云马程遥刘玉萍李晓琦
刘聪燕,李瑞云,马程遥,刘玉萍,瞿 鼎,李晓琦,陈 彦*
1.南京中医药大学附属中西医结合医院,江苏 南京 210028
2.江苏省中医药研究院,中药组分与微生态研究中心,江苏 南京 210028
宝藿苷I 是来源于小檗科淫羊藿属植物淫羊藿Epimedium brevicirnuMaxim.的一种稀有次级黄酮苷,具有显著的抗肿瘤、抗骨质疏松等药理活性[1-2],但原植物中宝藿苷I 的含量非常低,只有0.01%~0.25%,而市售高纯度宝藿苷I 的价格约为每克7000元人民币[3]。淫羊藿苷是淫羊藿中含量最丰富的一种原型苷,价廉易得,由于其具有与宝藿苷I 相同的8-异戊烯基黄酮骨架,通过体外酶生物转化的方法脱去其C-7 位葡萄糖基,即可制备药理活性更强的宝藿苷I,故其可作为获取宝藿苷I 的原料药[4-5]。
β-葡萄糖苷酶又称β-D-葡萄糖苷水解酶(EC 3.2.1.21,β-glucosidase,β-Glc),是一种广泛存在于植物、动物和微生物中的纤维素水解酶。研究表明,在温和的条件下,β-Glc 可定向水解淫羊藿苷为宝藿苷I,但存在价格昂贵、寿命短、易于变性或降解、难以回收和再利用等缺陷。采用吸附、包埋、交联、共价结合等方法将酶固定在适宜载体材料上,可有效延长酶的使用寿命,提高其重复利用性能,降低生产成本[6-8]。SBA-15 型介孔二氧化硅(SBA-15)具有高度有序的2D 六边形通道结构、较宽的孔径分布(5~30 nm)和良好的机械化学性能,是酶固定化的理想载体[9-10]。本研究采用吸附-交联法制备壳聚糖(chitosan,CS)交联SBA-15 固定化β-Glc(SBA-Glc-CS),通过对其理化性质、酶泄露行为、最适酶解条件、酶解动力学和重复利用性进行考察,证明了SBA-Glc-CS 促进淫羊藿苷高效转化为宝藿苷I 的潜力,从而为宝藿苷I 的绿色工业化生产提供新的思路和技术方法。
1 仪器与材料
1.1 仪器
Waters Acquity ARC 高效液相色谱仪,美国Waters 公司;MS205DU 十万分之一天平,梅特勒-托利多仪器有限公司;THZ-82AHS 气浴恒温恒速振荡器,江苏金坛市金城国胜实验仪器厂;JEM-2100 型透射电子显微镜(TEM),日本JEOL 公司;Tescan MAIA3 LM 超高分辨场发射扫描电镜(SEM),捷克Tescan 公司;Nicolet iS10 傅里叶红外光谱仪(FTIR)、1510 Multiskan GO 酶标仪,美国Thermo Fisher Scientific 公司;TRISTAR3020 比表面积与孔隙度分析仪,美国Mike 公司。
1.2 材料
β-Glc,酶活≥6 U/mg,美国Sigma 公司;SBA-15,江苏先丰纳米材料科技有限公司;壳聚糖,脱乙酰度≥95%,上海麦克林生物化学有限公司;25%戊二醛水溶液,国药集团化学试剂有限公司;淫羊藿苷、宝藿苷I 对照品,批号分别为20110206、20120222,HPLC 测定质量分数均≥98%,供含量测定用,购于上海源叶生物科技有限公司;BCA 试剂盒,美国Thermo Fisher Scientific 公司;甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 分析测定方法的建立[11-12]
2.1.1 酶活力测定方法 以淫羊藿苷为底物,在50 ℃、pH 6.0 条件下与适量酶振荡反应1 h 后,加入9 倍量甲醇终止反应,涡旋离心后,取上清液进行HPLC 检测,计算酶活力、相对酶活力、酶活回收率和淫羊藿苷转化率。
酶活力可定义为在50 ℃、pH 6.0 条件下,1 g酶每小时水解消耗淫羊藿苷的物质的量,表示为μmol/(h·g)。
相对酶活力=酶活力/最高酶活力,最高酶活力为同组实验中活力最高点的值,计为100%
酶活回收率=固定化酶总活力/被固定的游离酶总活力
转化率=(反应初始淫羊藿苷量-反应终止淫羊藿苷量)/反应初始淫羊藿苷量
色谱条件:依利特Supersil ODS2 色谱柱(150 mm×4.6 mm,5 μm);流动相为甲醇-0.1%甲酸水溶液:0~7 min,70%甲醇;7~8 min,70%~80%甲醇;8~20 min,80%甲醇;检测波长270 nm;体积流量1.0 mL/min;柱温30 ℃,进样量10 μL。HPLC 色谱图见图1。
2.1.2 载酶量测定方法 采用二辛可宁酸(BCA)法,以牛血清蛋白(BSA)质量浓度为横坐标(X),吸光度(A)值为纵坐标(Y)绘制标准曲线,得标准曲线回归方程为Y=0.007 9X+0.009 6,R2=0.998 9,结果表明BSA 在2.8~166.7 μg/mL 与A值呈良好的线性关系。

图1 混合对照品 (A) 和酶水解样品 (B) 溶液的HPLC 色谱图Fig.1 HPLC of mixed standard solution (A) and sample solution after enzymatic hydrolysis (B)
将待测样品溶液的A值代入回归方程,计算固定化酶的载酶量和固定率。
载酶量=被固定的酶量/固定化酶的量
固定率=被固定的酶量/固定化过程中投入的总酶量
2.2 SBA-Glc-CS 的制备工艺优化
2.2.1 固定化β-Glc 的制备 取适量SBA-15 超声分散在2 mL 具有一定pH 值的柠檬酸-磷酸氢二钠缓冲液中,加入适量β-Glc 后,室温下200 r/min 震荡孵育一定时间,再分别加入0.2 mL 壳聚糖溶液(5 mg/mL,0.5%稀盐酸溶液溶解)和0.2 mL 1.0%戊二醛溶液,室温下磁力搅拌1 h,离心收集沉淀,37 ℃真空干燥过夜,即得壳聚糖交联SBA-15 固定化β-Glc(SBA-Glc-CS)。固定化过程见图2。
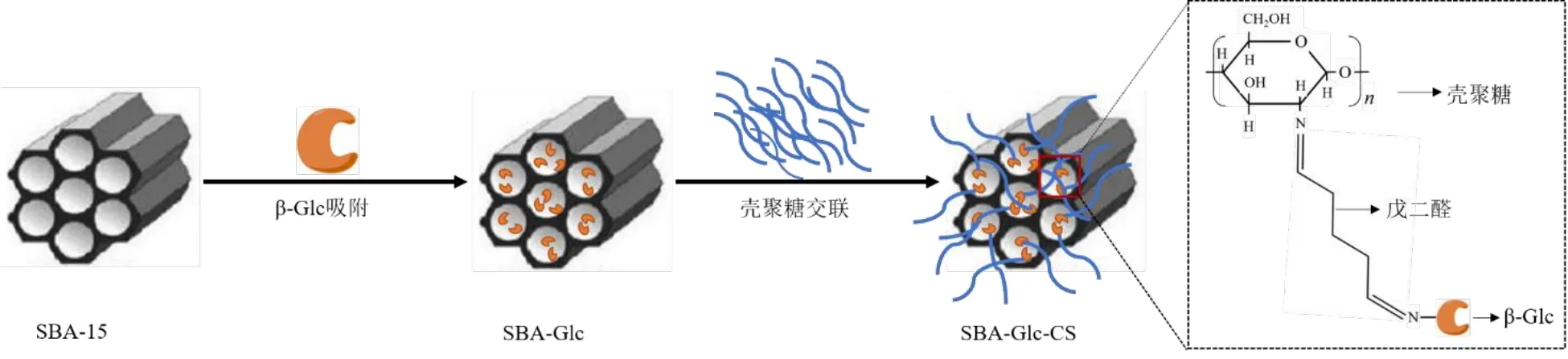
图2 SBA-Glc-CS 的制备过程示意图Fig.2 Principle scheme of perparation of SBA-Glc-CS
2.2.2 固定化参数优选 按“2.2.1”项下方法制备固定化β-Glc,分别考察不同固定化pH 值(3.0、4.0、5.0、6.0、7.0、8.0)、固定化时间(0.5、1、2、3、6、8、12 h)和酶质量浓度(1、2、3、4、5、6、7、8、9 mg/mL)对固定化酶酶活力和载酶量的影响,结果分别见表1~3。当固定化pH 值为6.0、固定化时间为8 h、酶质量浓度为7 mg/mL 时,SBA-Glc-CS 的酶活力最高,在该条件下制备的固定化酶的酶活力为439.2 μmol/(h·g),酶活回收率为93.7%,载酶量为1.120 g/g 载体,固定率为92.8%,结果表明壳聚糖交联SBA-15 不但可高效固定β-葡萄糖苷酶,还能较好地保持其酶活力。
表1 固定化pH 值对SBA-Glc-CS 酶活力和载酶量的影响( = 3)Table 1 Effect of immobilization pH values on enzyme activity and loading capacity of SBA-Glc-CS (= 3)
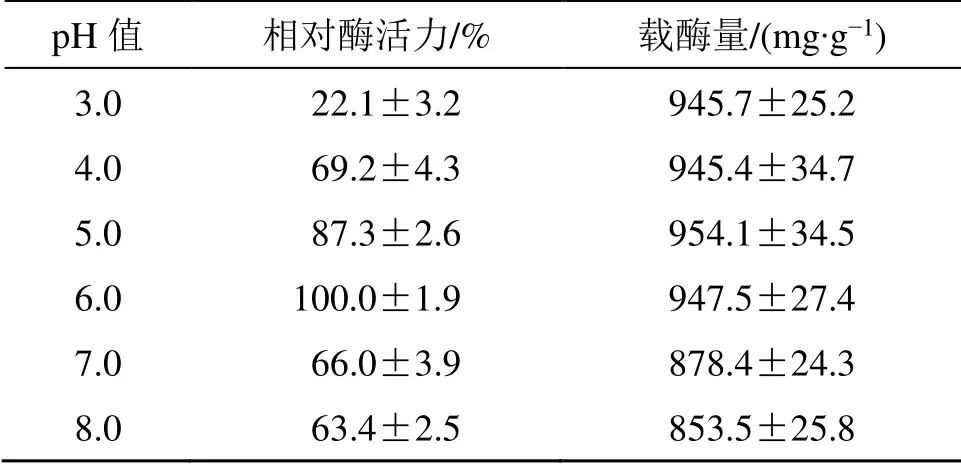
表1 固定化pH 值对SBA-Glc-CS 酶活力和载酶量的影响( = 3)Table 1 Effect of immobilization pH values on enzyme activity and loading capacity of SBA-Glc-CS (= 3)
pH 值 相对酶活力/% 载酶量/(mg·g-1)3.0 22.1±3.2 945.7±25.2 4.0 69.2±4.3 945.4±34.7 5.0 87.3±2.6 954.1±34.5 6.0 100.0±1.9 947.5±27.4 7.0 66.0±3.9 878.4±24.3 8.0 63.4±2.5 853.5±25.8
表2 固定化时间对SBA-Glc-CS 酶活力和载酶量的影响( = 3)Table 2 Effect of immobilization time on enzyme activity and loading capacity of SBA-Glc-CS ( = 3)

表2 固定化时间对SBA-Glc-CS 酶活力和载酶量的影响( = 3)Table 2 Effect of immobilization time on enzyme activity and loading capacity of SBA-Glc-CS ( = 3)
时间/h 相对酶活力/% 载酶量/(mg·g-1)0.5 86.2±2.5 931.9±25.3 1.0 80.6±4.0 973.0±34.8 2.0 69.8±2.1 924.7±26.4 3.0 66.7±3.4 962.8±24.1 6.0 62.9±2.5 970.5±20.9 8.0 100.0±3.6 951.7±34.3 12.0 32.4±2.9 935.1±26.6
2.3 SBA-Glc-CS 的质量评价
2.3.1 SEM 和TEM 观察 取适量干燥样品粉末,置于SEM 下观察并拍照;取适量样品粉末,用无水乙醇超声分散后,滴于铜网上,于室温干燥后,立即置于TEM 下观察并拍照;结果见图3。SBA-15和SBA-Glc-CS 的SEM 图均呈典型的具有一定长度的蠕虫状结构,TEM 图显示2 个样品均存在均一有序的长通道介孔结构,SBA-Glc-CS 的表面呈现一些不透明的阴影,可能与壳聚糖交联有关。
表3 固定化酶质量浓度对SBA-Glc-CS 酶活力和载酶量的影响 ( = 3)Table 3 Effect of immobilization enzyme concentration on enzyme activity and loading capacity of SBA-Glc-CS (n = 3)
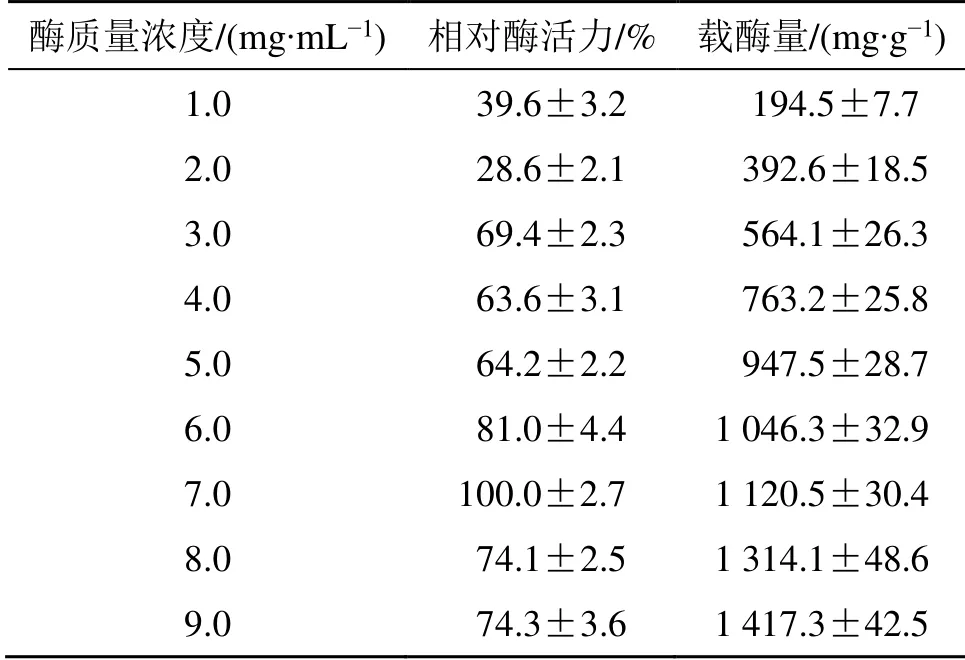
表3 固定化酶质量浓度对SBA-Glc-CS 酶活力和载酶量的影响 ( = 3)Table 3 Effect of immobilization enzyme concentration on enzyme activity and loading capacity of SBA-Glc-CS (n = 3)
酶质量浓度/(mg·mL-1) 相对酶活力/% 载酶量/(mg·g-1)1.0 39.6±3.2 194.5±7.7 2.0 28.6±2.1 392.6±18.5 3.0 69.4±2.3 564.1±26.3 4.0 63.6±3.1 763.2±25.8 5.0 64.2±2.2 947.5±28.7 6.0 81.0±4.4 1 046.3±32.9 7.0 100.0±2.7 1 120.5±30.4 8.0 74.1±2.5 1 314.1±48.6 9.0 74.3±3.6 1 417.3±42.5

图3 SBA-15和SBA-Glc-CS的SEM (A,C) 和TEM (B,D)表征图Fig.3 Representative SEM (A,C) and TEM (B,D) images of SBA-15 and SBA-Glc-CS

图4 SBA-15、β-Glc 和SBA-Glc-CS FTIR 表征图Fig.4 FTIR spectrum of SBA-15,β-glucosidase and SBAGlc-CS
2.3.2 FTIR 分析 取适量样品与KBr 按一定比例混合均匀,经压片机压制成透明薄片后,在傅里叶红外光谱仪上进行测试,结果见图4。SBA-15 和SBA-Glc-CS 均在462、800、1100 cm-1处呈现SiO2的特征吸收峰,分别归属于Si-O-Si 的弯曲振动、对称伸缩振动和反对称伸缩振动;β-Glc 在1653、1545、1260 cm-1处存在3 个特征吸收峰,分别归属于酶蛋白的酰胺I 带(C=O 伸缩振动)、酰胺II 带(N-H 伸缩振动,C-N 弯曲振动)和酰胺III 带(N-H弯曲振动,C-N 伸缩振动)。SBA-Glc-CS 在1653、1409 cm-1处存在的特征吸收峰可分别归属于β-Glc分子的酰胺I 带(C=O 伸缩振动)和氨基酸侧链上-CH3中C-H 对称伸缩振动,表明β-Glc 被成功固定;此外,SBA-Glc-CS 在1640 cm-1处存在1 个振动强度较弱的特征吸收峰,可归属于壳聚糖交联过程中戊二醛的醛基与壳聚糖、酶分子中氨基发生席夫碱反应时生成的C=N 双键的伸缩振动,表明壳聚糖交联成功。
2.3.3 N2吸附-脱附分析 取适量样品经100 ℃脱气处理过夜后,于液氮(-196 ℃)下测定其N2吸附-脱附等温线,结果见图5。SBA-15 和SBA-Glc-CS的吸脱附曲线均呈典型的IV 型曲线,且均具有H1滞留环,表明2 种样品均存在均匀分布的介孔,酶的固定化过程不会改变SBA-15 的介孔骨架结构。采用BET 法计算SBA-15 和SBA-Glc-CS 的比表面积分别为468.4、313.1 m2/g,采用BJH 法计算SBA-15 的孔容、孔径分别为1.22 cm3/g 和8.8 nm,SBA-Glc-CS 的孔容、孔径分别为0.74 cm3/g 和8.2 nm,SBA-Glc-CS 的比表面积、孔容、孔径均较SBA-15 显著降低,表明酶被成功地固定在SBA-15的介孔中。
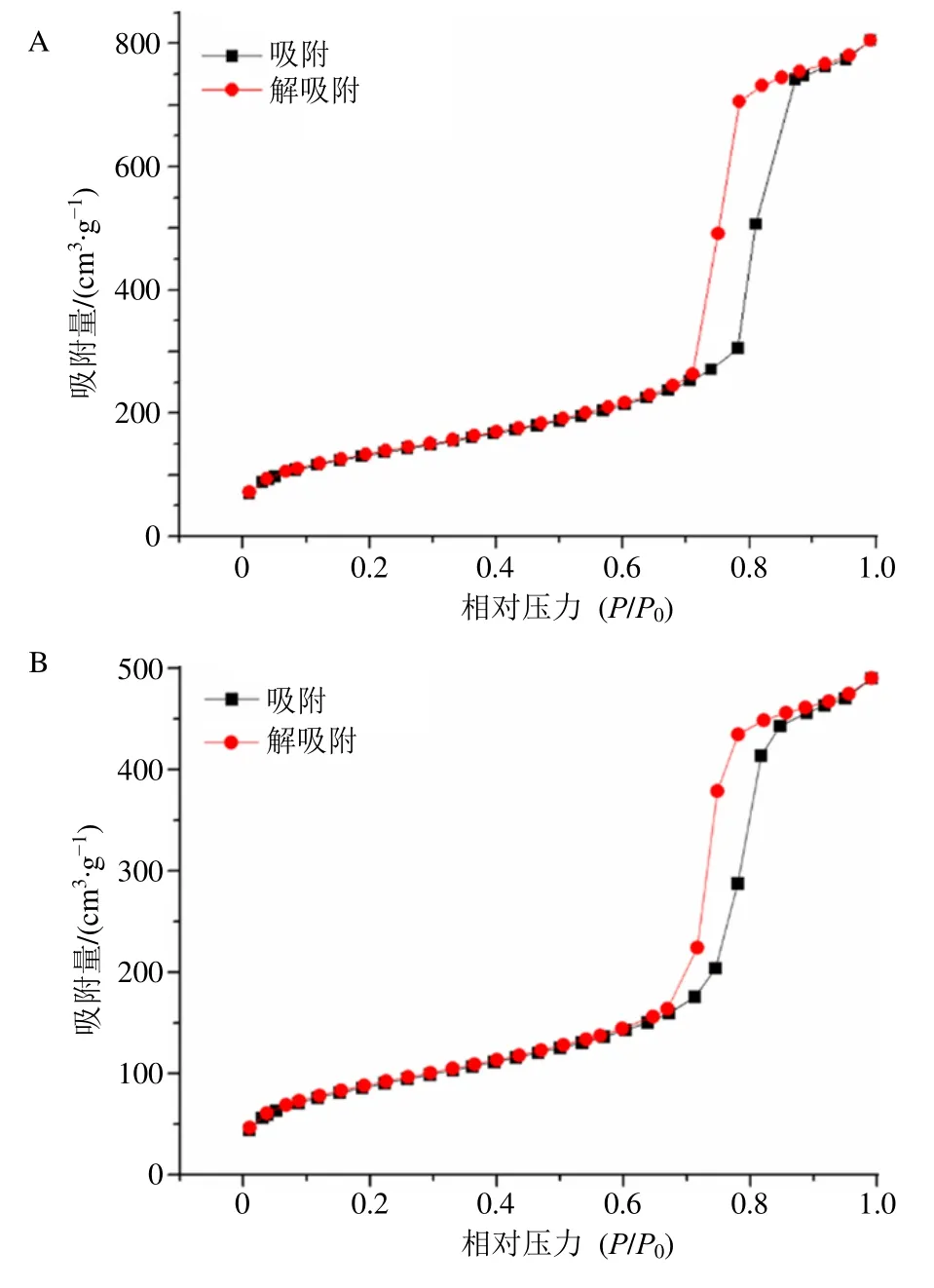
图5 SBA-15 (A) 和SBA-Glc-CS (B) 的N2 吸附-脱附等温线和孔径分布图Fig.5 N2 adsorption-desorption isotherms and pore size distributions of SBA-15 (A) and SBA-Glc-CS (B)
2.3.4 酶泄露评价 分别称取适量SBA-Glc和SBAGlc-CS,均匀分散在pH 5.0 的磷酸盐缓冲溶液中,置于恒温气浴振荡器中(50 ℃,200 r/min)孵育0.5、1、1.5、2、2.5、3、6、9、12、24 h,于各个时间点分别取样200 μL,同时补加200 μL 缓冲液,取出的样品经离心后取上清液测定泄漏的β-Glc 含量,结果见图6。未进行壳聚糖交联的SBA-Glc 随着孵育时间的延长,存在明显的酶泄漏现象,其24 h 的累计泄漏率高达18.7%,而经壳聚糖交联后的SBA-Glc-CS 的24 h 累计泄漏率仅为1.4%,表明壳聚糖交联可有效改善固定化酶的酶泄漏现象。
2.4 固定化β-Glc 酶解淫羊藿苷的最适条件考察
按“2.1.1”项下方法测定不同pH 值(4.0、5.0、6.0、7.0、8.0)、温度(25、37、50、60 ℃),底物质量浓度(0.25、0.50、0.75、1.00、1.25 mg/mL)条件下固定化和游离β-Glc 的酶活力,计算相对酶活;以淫羊藿苷转化率为指标,考察固定化和游离β-Glc 的最适酶解时间(0.5、1、2、4、6、8、10、12 h),结果见表4~7。固定化和游离β-Glc 的最适pH 值均为6.0,最适温度游离酶为60 ℃,固定化酶为50 ℃,最适底物质量浓度均为0.5 mg/mL,游离β-Glc 和固定化β-Glc 的最适酶解时间分别为4 h和8 h,淫羊藿苷的转化率均在95%以上,且酶解产物均为宝藿苷I。
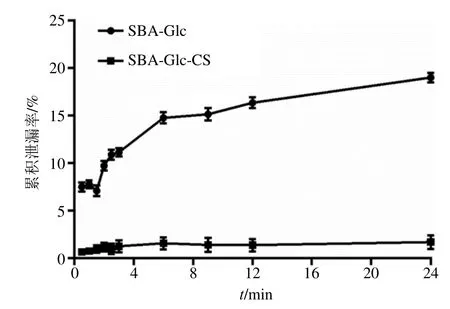
图6 固定化β-Glc 的累计泄漏率 ( = 3)Fig.6 Cumulative leakage rate of immobilized β-glucosidase ( = 3)
表4 游离与固定化β-Glc 的最适酶解pH 值考察 (n = 3)Table 4 Optimal pH of free and immobilized β-glucosidase( = 3)

表4 游离与固定化β-Glc 的最适酶解pH 值考察 (n = 3)Table 4 Optimal pH of free and immobilized β-glucosidase( = 3)
pH 值 相对酶活力/%游离酶 固定化酶4.0 20.6±3.5 38.8±4.8 5.0 93.1±2.6 62.6±3.7 6.0 100.0±2.7 100.0±3.2 7.0 54.8±4.3 93.3±5.4 8.0 7.3±3.6 64.7±3.1
表5 游离与固定化β-Glc 的最适酶解温度考察 (n = 3)Table 5 Optimal temperature of free and immobilized β-glucosidase ( = 3)

表5 游离与固定化β-Glc 的最适酶解温度考察 (n = 3)Table 5 Optimal temperature of free and immobilized β-glucosidase ( = 3)
温度/℃ 相对酶活力/%游离酶 固定化酶25 13.9±3.6 75.6±3.4 37 28.4±4.9 78.3±3.7 50 80.9±3.3 100.0±4.6 60 100.0±3.7 63.1±2.9
2.5 固定化β-Glc 的酶学性能考察
2.5.1 酶解动力学参数 按“2.2.1”项下酶活测定方法,分别称取适量游离和固定化β-Glc,水解不同质量浓度(1.0、1.25、1.50、1.75、2.0 mg/mL)淫羊藿苷,测定并计算在酶促反应初始阶段(淫羊藿苷转化量<5%)单位时间内淫羊藿苷的消耗量,既得酶解反应的初速度(V)。根据求导后的米氏方程1/V=Km/(Vmax[S])+1/Vmax(Km为米氏常数,[S]为底物浓度,Vmax为最大反应速率)计算Km和Vmax。结果见表8,2 种酶的1/V均和1/[S]呈良好的线性拟合关系,与游离酶相比,固定化β-Glc 的Km值变大,Vmax值变小,表明β-Glc 经固定后对淫羊藿苷的亲和力有所下降。
表6 游离与固定化 β-Glc 的最适底物质量浓度考察(= 3)Table 6 Optimal substrate concentration of free and immobilized β-glucosidase ( = 3)
底物浓度/(mg·mL-1)相对酶活力/%游离酶 固定化酶0.25 59.8±4.1 80.6±3.6 0.50 100.0±3.7 100.0±3.2 0.75 83.7±3.6 84.3±2.1 1.00 70.2±3.6 60.8±4.6 1.50 76.4±4.3 45.6±4.8
表7 游离与固定化β-Glc 的最适酶解时间考察 (n = 3)Table 7 Optimal hydrolysis time of free and immobilized β-glucosidase ( = 3)
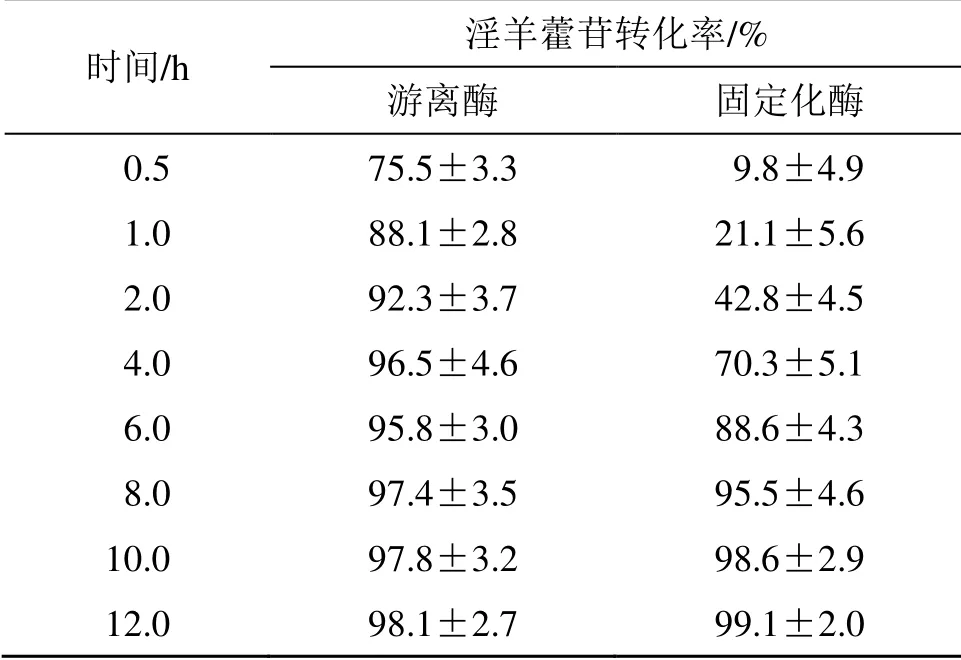
表7 游离与固定化β-Glc 的最适酶解时间考察 (n = 3)Table 7 Optimal hydrolysis time of free and immobilized β-glucosidase ( = 3)
时间/h 淫羊藿苷转化率/%游离酶 固定化酶0.5 75.5±3.3 9.8±4.9 1.0 88.1±2.8 21.1±5.6 2.0 92.3±3.7 42.8±4.5 4.0 96.5±4.6 70.3±5.1 6.0 95.8±3.0 88.6±4.3 8.0 97.4±3.5 95.5±4.6 10.0 97.8±3.2 98.6±2.9 12.0 98.1±2.7 99.1±2.0
2.5.2 重复利用性考察 取适量固定化β-Glc 与淫羊藿苷按“2.4”项下最适酶解条件反应后,离心,洗涤,收集沉淀物加入淫羊藿苷继续反应,重复上述操作5 次,按“2.1.1”项下方法测定酶活力,结果5 次实验的相对酶活力分别为(100.0±2.1)%、(89.2±4.5)%、(84.0±3.2)%、(82.9±3.1)%、(81.0±2.7)%(n=3),固定化β-Glc 在重复利用5次后的残余相对酶活力仍保持在80%以上,而游离酶只能利用1 次,结果表明经交联SBA-15 固定化可显著提高β-Glc 的利用效率,促进淫羊藿苷的高效生物转化。

表8 游离和固定化β-Glc 的酶解动力学参数Table 8 Enzymatic kinetic parameters of free and immobilized β-glucosidase
3 讨论
物理吸附是一种简单、温和、经济的酶固定化方法,酶分子通过氢键、范德华力、静电等作用被载体固定化,由于作用力较弱且不影响酶的活性位点,从而保持了固定化酶较高的酶活回收率,但也存在酶易泄漏、稳定性较差等问题[13-14]。吸附-交联法是目前最常用的一种复合固定化方式,该方法可以使酶在较为温和的条件下被固定化,既能较好地保持酶活力,又能防止酶泄漏[15-16]。
SBA-15 是一种具有二维立方体棒状结构的介孔硅,其特殊的长通道介孔为酶的吸附固定提供了较大的空间。研究表明,介孔二氧化硅的孔径与酶的装载量、酶活力、稳定性密切相关,若孔径显著小于待固定酶的分子尺寸,则酶大部分都不能进入孔道内,造成载酶量偏低;若孔径显著大于待固定酶的分子尺寸,则通过吸附作用固定的酶很容易从孔道中泄漏,造成酶活力下降和稳定性变差,因此根据不同酶的分子尺寸选择适宜孔径的介孔硅至关重要[17-18]。此外,固定化溶液pH 值、吸附时间、酶浓度等因素也会显著影响固定化酶的载酶量和酶活力,但载酶量越高,酶活力却不一定越高,这可能是由于过多的酶分子拥堵在介孔二氧化硅的孔道里,反而阻碍了底物分子与酶的充分接触反应[9]。
本研究选用的SBA-15 经N2吸附-脱附分析测定其孔径为8.8 nm,稍大于β-Glc 的分子尺寸(相对分子质量130 000,6.7 nm)[19],在最优条件下制备的固定化β-Glc 的载酶量高达1.120 g/g 载体,酶活力高达439.2 μmol/(h·g),表明SBA-15 是固定β-Glc 的理想载体。为了改善酶的泄漏,本研究以广泛应用的天然壳聚糖为介孔封堵剂,发现适量的壳聚糖交联可显著降低固定化β-Glc 的酶泄漏量,同时还能较好地保持其酶活力[20-21];在交联过程中,壳聚糖的用量需要控制,交联量过低则无法改善酶泄漏,交联量过高则会堵住介孔,不利于底物分子进入孔道与酶发生反应。与游离酶相比,经壳聚糖交联SBA-15 固定化的β-Glc 酶解淫羊藿苷的最适反应pH 值、底物浓度保持不变,最适温度有所降低,酶解等量淫羊藿苷所需时间变长,这可能是由于固定化过程在一定程度上影响了酶的活性中心,降低了酶与底物的亲和力(Km变大),继而导致酶解速率变慢(Vmax变小),酶解时间延长。但固定化β-Glc 具有制备工艺简单、载酶量高、易于分离、稳定性好、可重复利用等优势,在循环利用5 次后的剩余酶活依然保持在80%以上,总体酶解效率较游离酶(只能利用1 次)显著提高,促进了淫羊藿苷在体外高效转化为宝藿苷I,该研究为获取活性更强的中药稀有次级苷或苷元提供了新的技术方法和实验依据。
利益冲突所有作者均声明不存在利益冲突
