木犀草素制剂的研究进展
2021-02-03姚薛超宁洪鑫黄龙岳王世博李祎亮侯文彬
姚薛超,宁洪鑫,黄 欢,黄龙岳,王世博,李祎亮*,侯文彬*
1.天津中医药大学,天津 301617
2.北京协和医学院 中国医学科学院放射医学研究所,天津市放射医学与分子核医学重点实验室,天津 300192
木犀草素是一种天然黄酮类化合物(图1),通常以糖基化形式存在于各种药材、蔬菜和水果中,如金银花、荆芥、紫苏、卷心菜、花椰菜、胡萝卜和石榴[1]。木犀草素具有抗肿瘤、抗氧化、抗炎、抗过敏、抗菌、抗病毒、神经保护和心脏保护等药理作用[2-6]。但木犀草素的水溶性和脂溶性差,生物利用度低,大大限制了其临床使用。研究表明,100 mg/kg木犀草素的大鼠口服吸收率仅为10%,最大血浆浓度仅为3.79 μg/mL,同时木犀草素在血浆中清除速度快,口服和静脉注射均难以达到有效的血浆浓度[7]。为了推进木犀草素的临床应用,国内外学者不断深入研究,本文对木犀草素的制剂技术和新剂型的研究进展(图2)进行综述,为提高其生物利用度和临床疗效提供参考。
1 微粒给药系统
微粒给药系统系指药物或与适宜载体(一般为生物可降解材料),经过一定的分散包埋技术制得具有一定粒径(微米级或纳米级)的微粒组成的固态、液态或气态药物制剂,具有掩盖药物的不良气味与口味,提高难溶性药物的溶解度,或提高药物的生物利用度,或改善药物的稳定性,或降低药物不良反应,或延缓药物释放、提高药物靶向性等作用[8]。木犀草素微粒给药系统根据药物的类型,可分为聚合物胶束、脂质体、纳米粒、微乳。
1.1 聚合物胶束
聚合物胶束是由两亲性嵌段共聚物在水中自组装成壳/核结构的有序聚集体[9]。嵌段共聚物的疏水链可包裹木犀草素,而亲水链可增强系统在水中的溶解度,解决木犀草素水溶性差的问题,这首先满足了吸收的先决条件。木犀草素聚合物胶束主要应用于多种肿瘤如胶质母细胞瘤、非小细胞肺癌和原发性肝癌,也有应用于脑缺血再灌注损伤,这主要是基于聚合物胶束的优点:(1)生物相容性良好且可生物降解[10];(2)增加药物溶解度;(3)具有缓释性能;(4)肿瘤组织的选择性富集,基于增强渗透滞留效应;(5)减少网状内皮系统对药物的吞噬和清除,阻止蛋白质和细胞的吸附,延长体内循环时间。
使用不同的共聚物纳米载体可以实现不同的制剂特性,在木犀草素胶束制备中,Tan 等[11]采用聚乙二醇单甲醚聚乳酸羟基乙酸共聚物(MPEGPLGA)实现了木犀草素的良好分散及缓慢释放的功能,聚乙二醇分子延长了胶束的循环时间。但是该系列的载体具有稳定性差的缺点,Qing 等[12]发现不同嵌段共聚物的稳定性不同,甲氧基聚乙二醇-聚己内酯(mPEG-PCL)胶束可储存39 d,甲氧基聚乙二醇-聚丙交酯-乙交酯(mPEG-PLGA)胶束能储存8 d,而甲氧基聚乙二醇-聚丙交酯(mPEGPDLLA)胶束极不稳定,仅12 h 就出现黄色沉淀。
混合载体胶束在抗肿瘤药物领域是一种具有应用前景的制剂给药系统。(1)以2 种或2 种以上的天然、低毒的表面活性剂作为载体可以提高胶束的稳定性,具有一定的被动靶向作用。魏平平等[13]以聚乙二醇硬脂酸酯15(Solutol hs15)和泊洛沙姆188(Poloxamer188)为载体,通过薄膜水法制备木犀草素混合胶束。改善了胶束稳定性的同时,细胞对药物的摄取率也有明显提高。(2)可实现良好的抗肿瘤活性:二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)和维生素E 聚乙二醇琥珀酸酯(TPGS)装载木犀草素的长循环胶束(DTLLM),其中TPGS 可延长药物在血浆中的半衰期,增加细胞对药物的摄取,还可用作克服多药耐药性的赋形剂和P-糖蛋白的抑制剂。裸鼠体内抗肿瘤效果试验表明DTLLM 对非小细胞肺癌具有显著增强的抗肿瘤活性,对正常组织的毒性作用较小。体内靶向成像研究表明,DTLLM 实现了靶向给药,使药物释放缓慢,延长了循环时间。因此,该混合胶束显著提高了抗肿瘤效力。此外,该混合胶束的载药率(7.74%)在所查阅的装载木犀草素的聚合物胶束中最大[1]。
为提高胶束的肿瘤靶向能力可对嵌段共聚物进行修饰,如叶酸改性的聚乙二醇-聚(ε-己内酯)(Fa-PEG-PCL)纳米胶束用于封装木犀草素,识别在肿瘤表面表达的叶酸受体,从而实现靶向治疗[14]。体内药动学发现,木犀草素/Fa-PEG-PCL 胶束的清除半衰期、达峰浓度(peak concentration,Cmax)、药时曲线下面积(area under curve,AUC0~t)均优于与未经叶酸修饰的木犀草素/PEG-PCL 的指标,提高了木犀草素的生物利用度。在小鼠神经胶质瘤GL261 细胞的皮下肿瘤和颅内肿瘤的体内模型中,木犀草素/Fa-PEG-PCL 胶束显示出最大的抗肿瘤作用,胶质瘤抑制率为81.2%,明显大于木犀草素/PEG-PCL 胶束的59.5%。
聚合物胶束可将木犀草素和其他抗肿瘤药物一同负载协同增强抗肿瘤效果。王锦秀等[15]制备了载木犀草素和阿霉素的双药胶束应用于肝癌治疗,木犀草素治疗靶点为细胞的线粒体,而阿霉素为广谱细胞核靶向的肿瘤化疗药物,联合两种不同作用机理抗癌药物,可以有效协同治疗原发性肝癌。结果发现,与裸药相比,载双药胶束对HepG2 细胞的细胞毒性及细胞对药物摄取率均显著增强。体内实验表明载双药胶束能抑制肿瘤增殖,显著提高荷瘤小鼠的存活时间。
木犀草素的聚合物胶束见表1。
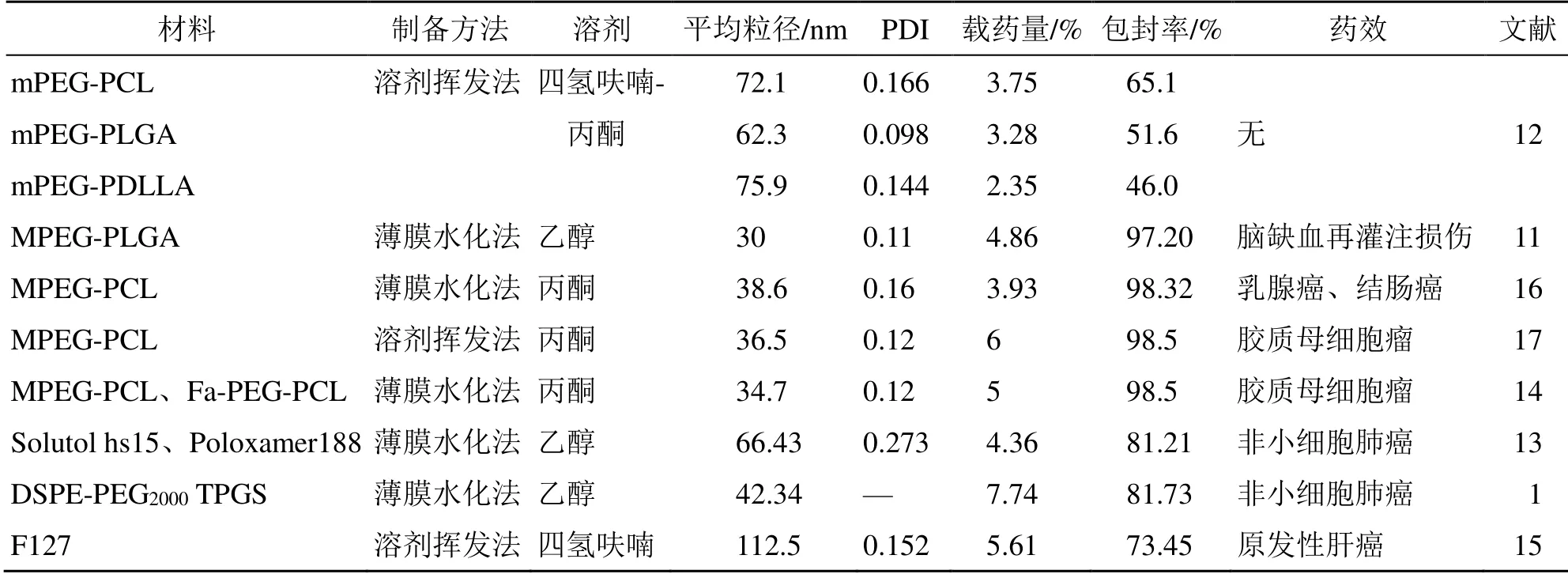
表1 木犀草素的聚合物胶束Table 1 Polymer micelles of luteolin
1.2 脂质体
脂质体是将药物包封于类脂质双分子层内而形成的微型泡囊体,在体内具有很好的生物相容性。脂质体作为药物递送载体,可以增强药物的溶解度,降低药物毒性,提高药物稳定性,延缓药物的释放,降低药物在体内的消除速度,提高药物生物利用度以及针对器官或组织的特异性靶向等。
磷脂、胆固醇作为脂质体的常规载体,在木犀草素脂质体制备中也有相关报道,其中有学者以木犀草素-胆固醇-卵磷脂质量比为1∶2∶7 制备脂质体(Lipo-木犀草素)[18],该脂质体在120 h 内缓慢释放。在药动学研究中,Lipo-木犀草素在iv 后2 h的血浆中木犀草素浓度比游离木犀草素高出约10倍,且AUC0~t明显增大,脂质体包裹减少了药物消除,提高了生物利用度。针对小鼠结肠癌CT26细胞和大肠癌的肿瘤模型,Lipo-木犀草素可以直接诱导肿瘤细胞凋亡;减少肿瘤血管生成,阻断肿瘤组织的营养供应,从而促进了肿瘤细胞的凋亡,抑制肿瘤增殖。
有报道称在脂质体基本载体高纯度蛋黄卵磷脂(PC-98T)、胆固醇中添加TPGS,可提高脂质体溶液的稳定性,其负ζ 电位显著增加,增强脂质体载体和木犀草素间的相互作用,防止药物泄漏,提高了载药率和包封率[(8.98±1.32)%vs(5.07±0.32)%,(71.55±0.26)%vs(45.45±1.33)%]。在人非小细胞肺癌A549 细胞中具有更高的细胞摄取潜力和细胞毒性作用。荷瘤小鼠的体内成像研究中,TPGS 修饰的脂质体具有靶向性和长循环特性。静脉给药后肿瘤体积显著减少,全身不良反应低。该研究应用于非小细胞肺癌治疗中取得良好的效果[19]。
通常用聚乙二醇修饰脂质体可增强脂质体载体在体内的稳定性及延长体内循环时间以提高生物利用度,有助于改善脂质体的弹性,通过角质层挤压实现透皮给药[20]。Sinha 等[20]通过薄膜水化技术结合超声处理以二硬脂酰基磷脂酰胆碱(DSPC)、胆固醇、木犀草素物质的量比为2∶1∶0.88 制备了常规脂质体,以DSPC、胆固醇、DSPE-PEG2000、木犀草素物质的量比为2∶1∶0.1∶1.1 制备了聚乙二醇化脂质体,粒径为(374±50)nm,有利于药物透皮递送。研究发现,与常规脂质体相比,用聚乙二醇化脂质体递送木犀草素可增强 caspase-3/caspase-14 介导的人永生化角质形成HaCaT 细胞凋亡[20]。木犀草素脂质体见表2。
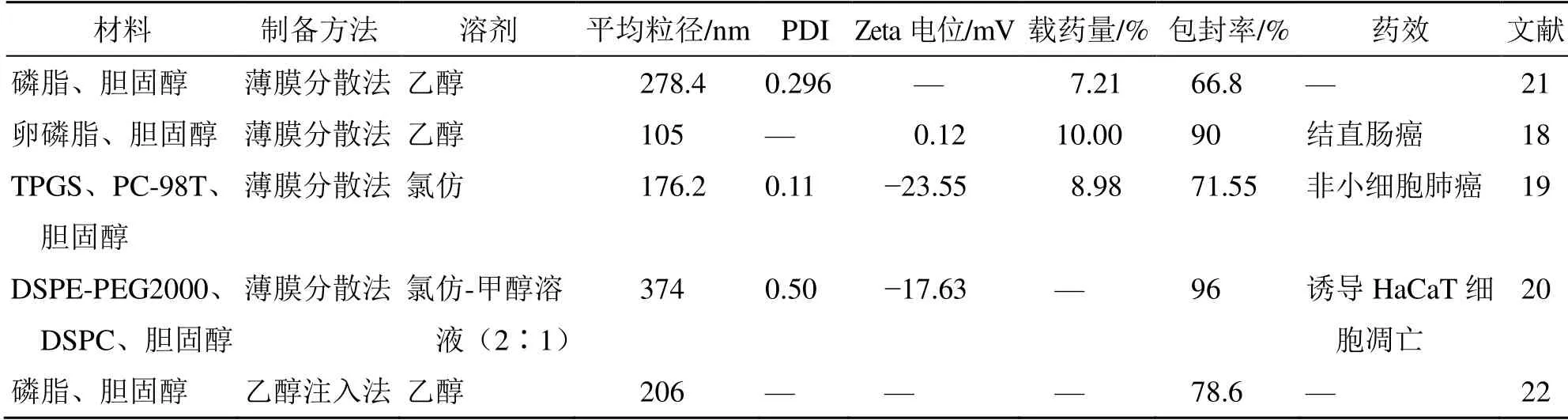
表2 木犀草素脂质体Table 2 Luteolin liposome
1.3 纳米粒
纳米粒系指药物或与载体辅料经纳米化技术分散,形成的粒径小于500 nm 的固体粒子[8],其粒径小、比表面积大,容易透过血管壁进入靶组织间隙,增加药物与肿瘤接触时间和接触面积,具有缓控释和靶向给药特性,可以提高药物溶解度,提高药物的生物利用度和药效等。根据药物载体的不同,可分为聚合物纳米粒、蛋白纳米粒、脂质纳米粒、硒复合物纳米粒、纤维素复合物纳米粒。
1.3.1 聚合物纳米粒 Majumdar 等[23]以聚乳酸-聚乙二醇(PLA-PEG)二嵌段共聚物为载体材料,应用乳化-溶剂蒸发法制备了木犀草素纳米颗粒,用于头颈部鳞状细胞癌。细胞摄取研究表明纳米颗粒以温度和时间相关的方式被内化到人喉癌Tu212 细胞中,体内研究表明纳米粒对头颈部鳞状细胞癌的肿瘤生长具有显著的抑制作用。虽然该纳米粒显示出较好的抗肿瘤活性,但是,其载药量和包封率太低,约为1.4%、9%,需进一步研究以获得更高的载药量、包封率及更广泛更好的体内外研究成果。王萌等[24]以mPEG-PLGA嵌段共聚物作为药物载体制备木犀草素载药纳米粒,且以丙酮为溶剂,得到的纳米粒包封率为(80.6±2.5)%,能在体外持续缓慢释放,且对人乳腺癌4T1 细胞有显著的抑制作用。需要进行体内研究来更好的验证该纳米粒的抗肿瘤活性及进行安全性评估。
1.3.2 蛋白纳米粒 付伟等[25]采用化学偶联方法制备甘草酸偶联牛血清白蛋白(GL-BSA),透析后冻干得到GL-BSA 冻干粉,以此为载体,采用去溶剂化法制备木犀草素白蛋白纳米粒,包封率为30.33%,载药量为10.94 μg/mg,考察给药24 h 后人肝癌HepG2 细胞的存活率,得到半抑制浓度为375 μg/mL,其中木犀草素实际量为4.09 μg/mL,高于木犀草素原粉的(52.94±4.91)μg/mL,具有更好的药效。白蛋白纳米颗粒具有主动靶向作用,易富集在肿瘤组织中,而甘草酸受体在肝肿瘤细胞表面过表达,因此将牛血清白蛋白偶联甘草酸主动靶向肝肿瘤细胞,有效提高木犀草素的生物利用度和抗肿瘤活性。显然,该制剂的包封率和载药量太低,且可能存在突释现象,还需要进一步的优化及评估。
El-Lakany 等[26]用相分离技术制备玉米醇溶蛋白纳米球,用于依西美坦和木犀草素的共递送。为了增强其靶向乳腺癌的能力,纳米球分别经聚乙二醇修饰和乳铁蛋白包裹,分别用于被动和主动靶向肿瘤。木犀草素作为主药成分之一,提示木犀草素单方制剂可尝试采用此方法提高制剂的生物利用度及药效。
1.3.3 脂质纳米粒 固体脂质纳米颗粒是以固态类脂为载体,将药物镶嵌于类脂核或黏附于类脂表面制备而成的固体胶粒给药系统[27],能够增加药物亲水性、物理稳定性,避免药物的降解或泄漏,控制药物释放,延长生物半衰期。陈金慧等[28]用薄膜超声法制备的木犀草素固体脂质颗粒的包封率为75%左右,其对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenyl hydrazine,DPPH)、羟基自由基、超氧阴离子的清除能力和还原能力均较木犀草素有显著提升,且随浓度增大而增强。木犀草素固体脂质颗粒增强了木犀草素的抗氧化能力,具有潜在应用价值,但需要进一步表征、优化及进行体内研究。
纳米结构脂质载体(NLC)是由固态脂质基质和一定量的液态脂质组成的新1 代的固体脂质纳米颗粒,可在一定程度上减少结晶度,扰乱固体脂质规则的晶格结构以获得更高的载药率和包封率,且可以通过控制加入液态脂质的量来控制药物释放。Liu 等[29]以硬脂酸棕榈酸甘油酯(Precirol ATO 5)为固相脂质,辛酸癸酸聚乙二醇甘油酯(Labrasol)为液相脂质,通过热高压均质化制备NLC,木犀草素在NLC 中处于非晶态,包封率可达95.63%,但载药量太低,仅有0.15%,需进一步优化。体外释放研究发现木犀草素-NLC符合Ritger-Peppa的动力学模型,表明NLC 中的木犀草素释放是由于药物扩散和脂质基质侵蚀。药动学研究中NLC 的相对生物利用度是木犀草素混悬液的515.06%,可见NLC 可显著改善木犀草素在大鼠中的口服生物利用度。
1.3.4 硒复合物纳米粒 陈锦灿等[30]以纳米硒为载体,制备了木犀草素-纳米硒复合物。将木犀草素乙醇溶液、Na2SeO3水溶液搅拌混匀后,逐滴加入抗坏血酸,继续搅拌反应,离心得到红色沉淀,用磷酸盐缓冲液洗涤得到规则球形的纳米颗粒。该复合物应用于肿瘤治疗,可以通过高效的诱导线粒体膜电位散失、增加细胞内活性氧等途径诱导细胞凋亡,又可以通过诱导自噬来加强其诱导肿瘤细胞死亡的能力,还可以引起G2/M 期周期阻滞。
1.3.5 纤维素复合物纳米粒 纤维素及其衍生物常被用作缓释材料,对纳米纤维素改性可以制备出分散性和稳定性较好的纳米纤维素微球,庆伟霞[9]将阳离子表面活性剂十六烷基三甲基溴化铵(CTMAB)负载到纤维素表面,以得到的CTMAB@纤维素作为药物载体,通过分子间作用力和疏水作用力制备出负载木犀草素的纳米复合物微球CTMAB@NCC@木犀草素,其载药量为(12.9±1.5)mg/g,在pH 6.4、7.4 的释放介质中,24 h 的体外累积释放率分别为44%、57%,具有缓释性能。为获得更高的载药量,李缓等[31]将纤维素表面接枝丁二酸酐得到丁二酸酐化纳米纤维素(NCSA),再将阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)负载到NCSA,得到一种新的纳米药物载体CTAB@NCSA,用于装载木犀草素,载药量达(42.8±4.2)mg/g,体外释放可达72 h,表明CTAB@NCSA 可以作为木犀草素递送的有效载体。
木犀草素纳米粒见表3。
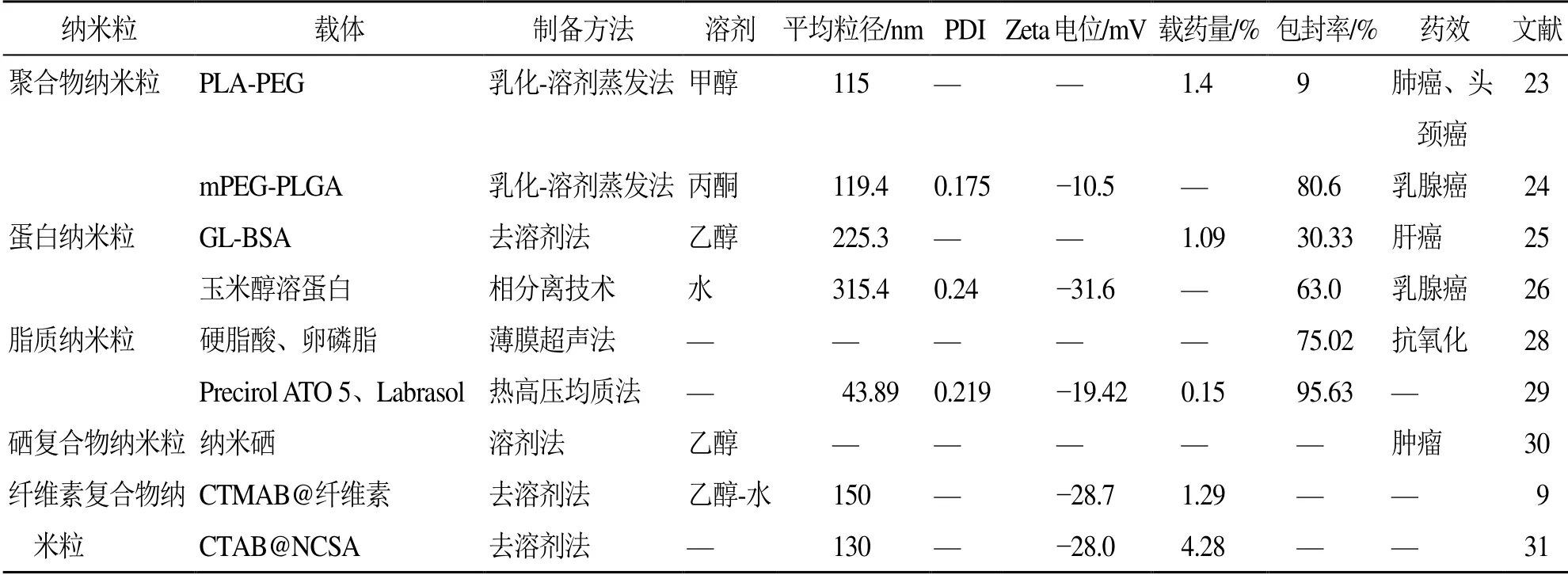
表3 木犀草素纳米粒Table 3 Luteolin nanoparticles
1.4 微乳
微乳由水相、表面活性剂、助表面活性剂和油相组成,黏度低、各向同性且热力学性质稳定,外观呈半透明、透明状或略带乳光[32]。微乳具有增加药物的溶解度,延长药物在体内的作用时间,提高生物利用度等作用。Liu 等[29]制备的木犀草素微乳的相对生物利用度是木犀草素混悬液的885.46%,显著改善了木犀草素在大鼠中的口服生物利用度。
微乳与其他的载药系统相比,最突出的特点就是对药物的增溶作用。木犀草素水溶性和脂溶性均较差,可以将其制备成水包油(O/W)和油包水(W/O)型微乳增加其在水中或油中的溶解度。赵惠茹等[32]采用伪三元相图制备了肉豆蔻酸异丙酯-聚氧乙烯氢化蓖麻油-无水乙醇-水的微乳体系,木犀草素在该O/W 型微乳中的溶解度是水中的561 倍,具有明显的增溶作用。杜成琨等[33]以司班、聚山梨酯、乙醇、大豆油、水质量比为4.2∶1.4∶1.4∶3∶1 制备W/O 型微乳,木犀草素在微乳中的溶解度约为大豆油的42 倍,大大提高了油溶性。
2 固体分散体
固体分散体是指将药物以一定状态高度分散在适宜的载体材料中形成的一种固态物质,能够在很大程度上改善水难溶性药物的溶解度与溶出速率,提高药物的生物利用度[34]。
吴春等[35]用溶剂-熔融法制备木犀草素固体分散体,采用Box-Behnken 中心组合设计结合响应面分析法,以累积溶出度为评价指标优化制备工艺,最佳制备工艺为以聚乙烯吡咯烷酮K30(PVP K30)为载体,80%乙醇为溶剂,载体与药物(39.5 mg)比例7∶1,于80 ℃下反应31 min,累积溶出度达84.72%。这为木犀草素固体分散体的制备提供了思路,但是并未对制得的分散体进行适当表征,需要进一步完善。Alshehri 等[36]则比较了融合、溶剂蒸发和微波辐射3 种制备方法制备的木犀草素固体分散体(分别标为木犀草素-FUD、木犀草素-SED 和木犀草素-MID)的溶出速率及抗氧化活性,分散体均以聚乙二醇4000(PEG4000)为载体制备。木犀草素从分散体中的最大溶出速率由高到低分别为木犀草素-MID [(97.78±4.4)%]>木犀草素-SED[(93.78±3.98)%]>木犀草素-FUD [(56.23±2.45)%],均高于木犀草素与PEG4000的物理混合物和木犀草素,这可能取决于木犀草素的非晶化程度;对DPPH 自由基清除活性由高到低分别为木犀草素-MID>木犀草素-SED>木犀草素-FUD>木犀草素。总的来说,微波辐射是制备木犀草素固体分散体有效且无溶剂的方法,具有最大的药物溶出速率及抗氧化活性,而分散体药物溶出度、溶出速率的提高一方面可归功于药物晶型转变,以非定形态分散于载体中,溶出过程不需要额外的动力去克服晶格能,另一方面,聚乙二醇类或PVP 类载体材料可增加润湿性且具有一定的增溶能力。
3 包合物
包合物系指一种分子(客分子)被部分或全部包合于另一种分子(主分子)的空穴结构内,形成的特殊络合物。查阅的相关文献均选择β-环糊精及其衍生物(主分子)作为木犀草素(客分子)的包合材料,包合比多为1∶1,木犀草素分子很容易进入β-环糊精中通过弱相互作用与其形成包合物并牢固结合。近年来的研究中多选用β-环糊精衍生物作为包合材料,与β-环糊精相比,其毒性更小,增溶效果更好[32],包合能力更强等优点。Liu 等[37]通过对5 种木犀草素-环糊精[β-环糊精、甲基-β-环糊精(M-β-CD)、羟乙基-β-环糊精(HE-β-CD)、羟丙基-β-环糊精(HP-β-CD)和葡萄糖基-β-环糊精(G-β-CD)]包合物的研究发现,G-β-CD 包合物显示出最大的稳定性常数即最好的稳定性,分子对接研究表明,包合物是由木犀草素的B 环插入G-β-CD 腔中形成的。
包合物的制备一般采用饱和水溶液法和研磨法。Alshehri 等[38]则分别采用微波辐射法和溶剂蒸发法制备了木犀草素-β-环糊精二元包合物和木犀草素-β-环糊精-普朗尼克F127 三元包合物,结果发现,包合物均比单一木犀草素具有更好的溶解度、稳定性和抗氧化性;同一种包合物,微波辐射法制备的包合物较溶剂蒸发法制备的包合物具有更大的药物释放;三元包合物较二元包合物显示出更好的溶解度和稳定性及更大的药物释放;因此,微波辐射法及合适的三元剂的加入对木犀草素包合物的制备提供了新的方法和思路,但该实验结果是体外结果,并没有进行药动学等体内药物研究,需要进行进一步的研究以证实。
龙友琦等[39]研究木犀草素及其磺丁基醚-β-环糊精(SBE-β-CD)包合物[40]在大鼠体内的药动学发现木犀草素在大鼠体内消除符合二室消除模型,与木犀草素相比,木犀草素-SBE-β-CD 包合物达峰时间提前45 min,Cmax和AUC0~t增大3 倍,生物利用度提高。
综上所述,木犀草素-β-环糊精或其衍生物包合物能够提高木犀草素的溶解度、稳定性、药效及生物利用度。
4 磷脂复合物
磷脂复合物是药物和磷脂分子通过电荷迁移作用而形成的较为稳定的化合物或络合物[41]。木犀草素的-OH 基团可与磷脂分子相互作用形成复合物[42-43]。该复合物可改变母体药物的理化性质,使药物呈无定形态;可改善药物对细胞的亲和性,促进药物对生物膜的渗透;改善药物的水溶性和脂溶性;增强药物在胃肠道中的吸收,提高药物的生物利用度[41,44]。
木犀草素磷脂复合物已有专利报道,木犀草素与磷脂(大豆磷脂、卵磷脂质量比为5∶1)的质量比为1∶3,溶剂为丙酮和甲醇,加热回流搅拌5 h,回收溶剂,真空干燥[45]。该复合物极大地改善了木犀草素的溶解度、溶出度和稳定性,从而提高了药效。此外,该复合物可以制成各种制剂,如胶囊剂、片剂和注射剂等;还可以和其他活性成分组成药物组合物。
李阳杰等[46]以四氢呋喃为制备溶剂,采用溶剂挥发法制备磷脂复合物,以正交试验筛选出最佳工艺,该工艺复合率可接近100%,即按1∶1.2 称取木犀草素、大豆卵磷脂,加入适量四氢呋喃使药物质量浓度为15 mg/mL,在55 ℃下搅拌5 h,回收溶剂,40 ℃真空干燥。X 射线衍射结果表明木犀草素在磷脂复合物中以无定型状态存在。与木犀草素相比,其复合物在水和正辛醇中的表观溶解度均显著升高。药动学参数显示磷脂复合物油制剂的达峰时间(tmax)、Cmax、AUC0~t显著高于木犀草素混悬液,生物利用度可提高2.09 倍,但是磷脂复合物混悬液与木犀草素混悬液无明显差异,只是略高,可能是木犀草素与磷脂的作用力太弱,受到水相干扰而发生解离,而在油相中较稳定,因此需选择油制剂给药以进一步提高生物利用度。
Khan 等[42]制备木犀草素磷脂复合物(LPC)应用于氨基半乳糖/脂多糖诱导的肝损伤,磷脂具有保肝作用,制备的LPC 收率为84.79%,载药量为74.14%,平均粒径为(147.4±2.73)nm,可被动靶向局部毛细血管通透性增强的炎性和肿瘤部位,Zeta 电位为(-21.6±2.1)mV,负ζ 电势可以通过静电相互作用来最小化与血浆和血细胞的非特异性相互作用。药时曲线显示,LPC 曲线呈两相,具有尖锐的吸收峰,表明药物迅速吸收到体循环中,随后排泄较慢;LPC 的Cmax是木犀草素的2.87 倍,生物利用度是木犀草素的535.31%。毒性研究的结果证实LPC 口服给药安全,体内研究结果显示LPC的肝保护作用明显比木犀草素更好,甚至强于市售的水飞蓟素。可见LPC 是有效的木犀草素口服给药系统,具有更高的生物利用度和肝保护潜力。此外,Khan 团队还将LPC 用于体内抗炎,同样得到了可观的生物利用度及药效[43]。但是,LPC 具有较高的吸湿性,需要通过改变配制的磷脂的纯度和性质来谨慎应对,并且还需要储存在干燥环境中。
磷脂复合物除了作为中间体制成普通的药用剂型,还可以与各种制剂新技术相结合,如纳米粒、脂质体和亚微乳,以加快药物的溶出,延长药物在体内循环时间,进一步提升药物的生物利用度[47]。
5 水凝胶
水凝胶是由亲水性聚合物链交联形成的三维网状结构,具有良好的生物相容性,可以通过溶胀及响应特定刺激(如pH 值、温度、酶和活性氧物质)调控药物释放的量与速率,实现药物缓释。Kim 等[48]制备由温度敏感的聚(N-异丙基丙烯酰胺)和pH 值敏感的透明质酸组成的双交联互穿聚合物网络水凝胶用于木犀草素的透皮给药,以治疗牛皮藓。该制剂的制备过程为以过硫酸铵为引发剂,N,N,N,N-四甲基乙二胺为促进剂,采用自由基聚合法制备聚(N-异丙基丙烯酰胺)和交联剂N,N-亚甲基双丙烯酰胺的主要网络;再通过迈克尔加成制备透明质酸和二乙烯基砜的二级网络,并通过红外光谱和13C-NMR证实双网络共存。制备的水凝胶具有三维网络结构,孔径在50 μm以内。在接近皮肤病皮肤状况的37 ℃和pH 7.4 下,体外药物释放遵循non-Fickian 扩散,2 种药物释放速率共存并且药物释放缓慢。体外皮肤渗透实验表明,双交联互穿聚合物网络水凝胶有效地将木犀草素递送至表皮和真皮。因此双交联互穿聚合物网络水凝胶可以开发用于牛皮藓治疗。
6 2种制剂载体组合物
6.1 磷脂复合物固体分散体
磷脂复合物固体分散体系指在一定条件下,难溶性药物与大豆卵磷脂(或磷脂酰胆碱)通过共价结合而形成不同于原型药物的一种复合物,进一步将磷脂复合物分散到水溶性高分子材料制备成磷脂复合物固体分散体(PC-SD)。邓向涛等[49]用溶剂挥发法制备木犀草素固体分散体(木犀草素-SD),且以PVP K30 为载体制备木犀草素磷脂复合物固体分散体(木犀草素-PC-SD),其分别将木犀草素溶解度由(61.09±0.09)μg/mL 提高至(365.33±0.38)、(401.14±0.19)μg/mL,体外溶出度也均得到提高。药动学研究结果显示,与木犀草素相比,木犀草素-SD 和木犀草素-PC-SD 的Cmax分别提高了2.47、2.87倍,生物利用度分别提高至150.10%、204.52%,木犀草素-PC-SD 的tmax显著延后,而木犀草素-SD 无显著性变化,可能是因为木犀草素-PC 提高了木犀草素的亲脂性,透过生物膜时发生滞留。总之,木犀草素-SD 和木犀草素-PC-SD 均可显著提高木犀草素的口服生物利用度,但木犀草素-PC-SD 的效果更佳。
6.2 双仿生载体phytochylomicron
Elnaggar 等[50]阐述了一种双仿生载体phytochylomicron,可模拟体内内源性乳糜微粒的结构,通过制备木犀草素磷脂复合物,并将其装入乳糜微粒纳米载体中获得。其中乳糜微粒由脂质组成,具有生物相容性、可生物降解性、可靶向肿瘤组织,并通过受体介导的内吞作用进行细胞摄取。phytochylomicron 体外缓慢持续释放,到达肝脏前药物泄漏最少。细胞培养研究表明,与游离药物相比,phytochylomicron 对人肝癌Hep G2 细胞表现出最高的生长抑制作用,吸收率最高。体内抗肿瘤研究发现,phytochylomicron 表现出最显著的肿瘤生长抑制作用,比游离木犀草素高出近6 倍,且肿瘤大小明显减小。可见,phytochylomicron 是一种有效的肿瘤靶向制剂。
6.3 胶束复合温敏原位凝胶
原位凝胶是一类以溶液状态给药后,在给药部位受到外界因素的作用进而转变成非化学交联半固体凝胶的新型药物剂型。温敏型原位凝胶是以温度作为溶液相转变调节因素的原位凝胶。原位凝胶可在给药部位形成药物贮库,避免药物的流失,增加滞留时间,实现药物的持续缓慢释放。将原位凝胶与聚合物胶束结合可以很好地发挥两种给药系统的优点,提高药物的溶解度和稳定性,达到更好的缓释和靶向治疗的效果,提高药效[51-52]。Hu 等[53]以普朗尼克F127 作为温敏凝胶基质,包封在自组装的甲氧基聚乙二醇-聚(ε-己内酯)胶束(木犀草素-M)外面,形成胶束复合温敏原位凝胶(木犀草素-M-F127),用于结直肠癌腹膜转移治疗。体外释放研究发现木犀草素-M-F127 实现了木犀草素的持续释放;在结直肠癌腹膜转移模型中,腹膜注射局部给药木犀草素-M-F127 比木犀草素-M 表现出更强的抗肿瘤作用,这可归功于原位胶凝持续释放药物。
6.4 囊泡凝胶
Abidin 等[54]提出了一种新型透皮制剂niotransgel,即囊泡凝胶。非离子型表面活性剂囊泡是由非离子形式的两亲性物质和胆固醇在亲水介质中自组装形成的具有闭合双分子层膜结构的封闭体系,其结构与脂质体十分相似,兼容了脂质体的优点且由于囊材由非离子表面活性剂组成,对皮肤和黏膜刺激性小且渗透性大大优于脂质体。将囊泡制成囊泡凝胶,高分子凝胶可为囊泡提供骨架支撑,避免囊泡聚集,提高其稳定性,作为透皮制剂,囊泡凝胶可作为药贮库,提高关节部位的药物浓度,提高疗效[55]。通过薄膜水化技术制备载有木犀草素的非离子型表面活性剂囊泡,使用卡波姆934 作为胶凝剂,将脂质体配方转化为凝胶。制备的所有囊泡均在534.58~810.22 nm,有利于有效的透皮递送,且药物渗透量提高,因为磷脂和非离子表面活性剂都可以充当渗透促进剂。体内生物活性研究表明,niotransgel 具有良好的抗关节炎活性,其结果与用于抗关节炎和镇痛药的双氯芬酸凝胶相当,而镇痛作用强于双氯芬酸凝胶。可见,装载木犀草素的niotransgel 可有效透皮递送木犀草素,达到良好的抗关节炎活性。
7 结语
近年来木犀草素的制剂研究,从治疗领域上分析,主要针对肿瘤、皮肤或骨科关节炎症,其中肿瘤的治疗领域宽泛,包括肺、头颈、乳腺、肝、结肠、胶质母细胞瘤等,使众多学者在不断挖掘其使用的最佳制剂形式。
从大量研究中不难看出,总体的制剂设计思路旨在提高生物利用度、提高靶向性,进而提高药物的疗效。可喜的是,通过大量的微粒载药系统的研究、固体分散的技术、包合技术、磷脂复合物、水凝胶、多元技术的应用,都针对不同的治疗靶点,起到了促进吸收、提高生物利用度的效果,与原药相比生物利用度最大可提高10 倍,为后续的研究提供了宝贵的研究基础。但是大多数研究仍然停留在小试制剂研究、体外理化性质评价、细胞水平毒性评价、动物体内药动学药效学研究的阶段。且制备工艺中多用到了甲醇、丙酮等有机溶剂,且有的制备工艺也仅停留于实验室的研究阶段,这限制了木犀草素商品化的步伐。从成为商品的角度评价,微粒给药制剂普遍存在包封率低、载药量小的问题,药物突释、泄露、降解、聚集等稳定性问题也比较凸显[56]。在现有的制剂研究中也出现了许多前沿性的给药思路,如三维网状水凝胶给药体系;多种新型载体的应用,诸如嵌段聚合物、改性的聚合物,新型表面活性剂、蛋白类载体、仿生载体、温敏、pH 值敏感的高分子材料、自组装纳米技术等都给木犀草素的制剂研究注入了活力和应用前景,笔者认为磷脂复合物的技术工业化可能性较高,在今后木犀草素的制剂研究中应在此基础上不断运用新型的制剂手段、不同的载体加以挖掘,开发出有实际应用价值的木犀草素制剂。
利益冲突所有作者均声明不存在利益冲突
