一测多评法同时测定痔舒适洗液中7种成分的含量
2021-02-03赵志国姚建华王婧宁翟莹莹辽宁中医药大学附属医院制剂管理部沈阳0032沈阳飞龙药业有限公司本溪7004
赵志国,姚建华,王婧宁,翟莹莹(.辽宁中医药大学附属医院制剂管理部,沈阳 0032;2.沈阳飞龙药业有限公司,本溪 7004)
痔舒适洗液由苦参、白及、三七、艾叶、蛇床子和败酱草等14味中药配伍加工而成,临床主治痔疮急性发作[1]。现代研究表明,痔舒适洗液能有效促进混合痔术后患者创面愈合,缓解患者术后疼痛,缩短创面愈合所需时间[2-3],可明显改善肛门病术后的疼痛、出血和水肿诸症[4];其联合光子治疗仪、卤米松乳膏治疗肛周湿疹疗效好、显效快、复发率低[5-6];采用一次性根治术联合痔舒适洗液可明显提高肛周脓肿患者的整体治疗有效率和患者治疗满意度[7]。方中苦参[8]清热燥湿,槐角清热泻火、凉血止血,三七散瘀止血、消肿定痛,共为君药;白及收敛止血、消肿生肌,蛇床子祛风燥湿、杀虫止痒,败酱草、金银花和马齿苋清热解毒、凉血止血,合为臣药;艾叶祛湿止痒,防风胜湿止痛,硼砂清热解毒,白矾解毒止痒,冰片清热止痛,共为佐药;甘草缓急止痛、调和诸药,为使药。诸药合用,共奏清热燥湿、化瘀解毒、止血消肿、止痛止痒之功。现行质量标准[1]和文献报道中均未对痔舒适洗液所含成分进行定量研究,中药及其制剂具有多成分、整体协同作用的特点,本文采用一测多评(QAMS)法对痔舒适洗液中君药苦参所含主要成分三叶豆紫檀苷、苦参醇Ⅰ和苦参酮,臣药白及所含特征成分贝母兰宁和山药素Ⅲ,佐药艾叶所含有效成分棕矢车菊素和异泽兰黄素含量进行同时测定,建立痔舒适洗液多指标成分的质量评价模式,为全面、科学地评价痔舒适洗液的质量提供参考。
1 仪器与试药
1.1仪器 Waters 2695型HPLC色谱仪(美国Waters公司);UltiMate 3000型HPLC色谱仪(美国Thermo Fisher Scientific公司);BT-125D型电子天平(德国Sartorius公司);Agilent Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm,美国Agilent公司);Phenomenex C18色谱柱(250 mm×4.6 mm,5 μm),美国Phenomenex公司;Kromasil C18色谱柱(250 mm×4.6 mm,5 μm),瑞典Akzo Nobel公司。
1.2试药 三叶豆紫檀苷(批号18061121,CAS号:6807-83-6,质量分数为96.2%),苦参酮(批号18060822,CAS号:34981-26-5,质量分数为97.7%),异泽兰黄素对照品(批号18041621,CAS号:22368-21-4,质量分数为98.2%),均购自上海同田生物技术股份有限公司;苦参醇Ⅰ(批号PRFM90307-43,CAS号:99119-69-4,质量分数为98.5%)和棕矢车菊素对照品(批号PRF8060702,CAS号:18085-97-7,质量分数为98.5%),均购自成都普瑞法科技开发有限公司;贝母兰宁(批号CFS201801,CAS号:82344-82-9,质量分数为98.0%)和山药素Ⅲ对照品(批号CFS202001,CAS号:56684-87-8,质量分数为98.0%),均购自武汉天植生物技术有限公司;乙腈(色谱纯),德国Merck公司;其他试剂为分析纯;痔舒适洗液(规格:220 mL·瓶-1,批号:20190501,20190703,20190801),均购自云南名扬药业有限公司。
2 方法与结果
2.1溶液的制备
2.1.1混合对照品溶液 精密称取7种成分对照品各适量,用体积分数为70%的甲醇制成质量浓度分别为0.204,0.396,1.532,0.318,0.876,0.124,0.258 mg·mL-1的混合对照品储备液;精密吸取上述混合对照品储备液2.5 mL,用体积分数为70%的甲醇稀释至50 mL,制成7种成分质量浓度分别为10.2,19.8,76.6,15.9,43.8,6.2,12.9 μg·mL-1的混合对照品溶液。
2.1.2供试品溶液 精密量取痔舒适洗液3.0 mL,置于25 mL量瓶中,用体积分数为70%的甲醇稀释至刻度,摇匀,过滤,即得。
2.1.3阴性样品溶液 按照痔舒适洗液质量标准项下的工艺处方分别制备不含苦参、白及、艾叶和14味中药材的阴性样品,再按照2.1.2项下方法分别制成阴性样品溶液。
2.2色谱条件 色谱柱:Agilent Eclipse XDB-C18柱(250 mm×4.6 mm,5 μm);柱温:25 ℃。流动相:乙腈(A)-2 mL·L-1甲酸(B),梯度洗脱(0~8.0 min,35.0%A;8.0~19.0 min,35.0%A~43.0%A;19.0~31.0 min,43.0%A~49.0%A;31.0~44.0 min,49.0%A~65.0%A;44.0~50.0 min,65.0%A~35.0%A)。流速:0.9 mL·min-1;检测波长:295 nm(0~19.0 min检测三叶豆紫檀苷、苦参醇Ⅰ和苦参酮)[9-10],270 nm(19.0~31.0 min检测贝母兰宁和山药素Ⅲ)[11-12],330 nm(31.0~50.0 min检测棕矢车菊素和异泽兰黄素)[13-14];进样量:10 μL。
2.3专属性实验 取2.1项下制备的混合对照品溶液、供试品溶液及4种阴性样品溶液,按照2.2项下色谱条件进样检测,色谱图见图1。结果表明,色谱图基线平稳,图1B中7种成分色谱峰峰形对称,与相邻色谱峰分离度均>1.5,理论板数按照各成分色谱峰计算均≥4 500,阴性样品对痔舒适洗液中7种成分的测定无干扰。
2.4线性关系考察 分别精密吸取2.1.1项下制备的混合对照品储备液0.1,0.5,1.0,1.5,2.0,2.5 mL,分别用体积分数为70%的甲醇稀释至20 mL,制成系列混合对照品溶液,按照2.2项下色谱条件检测7种成分色谱峰的峰面积,以质量浓度为横坐标(x)、峰面积为纵坐标(y)进行线性回归,结果见表1。

表1 7种成分的线性关系考察
2.5精密度实验 取2.1.1项下制备的混合对照品溶液,重复进样6次,测得7种成分色谱峰峰面积的RSD值分别为1.29%,1.05%,0.57%,1.11%,0.72%,1.33%,0.96%,表明仪器精密度良好。
2.6重复性实验 取2.1.1项下制备的混合对照品溶液,重复进样6次,测得7种成分色谱峰峰面积的RSD值分别为1.29%,1.05%,0.57%,1.11%,0.72%,1.33%,0.96%,表明实验重复性良好。
2.7稳定性实验 取2.1.2项下制备的同一份供试品溶液,分别于0,2,4,6,12,18 h检测7种成分的峰面积,计算得峰面积的RSD值分别为1.35%,0.99%,0.60%,1.08%,0.74%,1.27%,1.01%,表明供试品溶液在18 h内稳定性良好。
2.8回收率实验 取7种成分含量已知的痔舒适洗液样品9份,每份1.5 mL,根据《中国药典》2015年版四部要求,分别按已知含有量的50%,100%,150% 3个水平精密加入加标对照品溶液(7种成分质量浓度分别为0.073,0.149,0.541,0.106,0.293,0.047,0.089 mg·mL-1)1.0,2.0,3.0 mL,各3份,再按照2.1.2项下方法制备加样供试品溶液,按照2.2项下色谱条件进样检测,结果测得7种成分的平均回收率(RSD值)分别为96.94%(1.30%),99.59%(0.74%),100.13%(0.65%),98.42%(1.43%),99.37%(1.26%),97.52%(1.11%),98.50%(0.98%)。
2.9相对校正因子(RCFs)的测定及耐用性考察
2.9.1RCFs测定 精密吸取2.4项下制备的6个系列混合对照品溶液适量,按照2.2项下色谱条件进样测定7种成分的峰面积,以苦参酮为内参物,按照公式RCFs/k=fs÷fk=(Cs×Ak)÷(Ck×As)(式中C代表质量浓度,A代表峰面积,s代表内参物,k代表其他成分)分别计算三叶豆紫檀苷、苦参醇Ⅰ、贝母兰宁、山药素Ⅲ、棕矢车菊素和异泽兰黄素6种成分的RCFs,结果见表2。

表2 6种成分的RCFs
2.9.2不同仪器、色谱柱对RCFs的影响 精密吸取2.1.1项下制备的混合对照品溶液,按照2.2项下色谱条件进样测定7种成分的峰面积,以苦参酮为内参物,对比考察UltiMate 3000型、Waters 2695型高效液相色谱仪及Agilent Eclipse XDB-C18、Phenomenex C18和Kromasil C18色谱柱对6种成分RCFs的影响,结果见表3。

表3 不同仪器、色谱柱对RCFs的影响
2.9.3不同柱温对RCFs的影响 精密吸取2.1.1项下制备的混合对照品溶液,按照2.2项下色谱条件进样测定7种成分的峰面积,以苦参酮为内参物,对比考察不同柱温(20,22,25,28,30 ℃)对6种成分RCFs的影响,结果见表4。
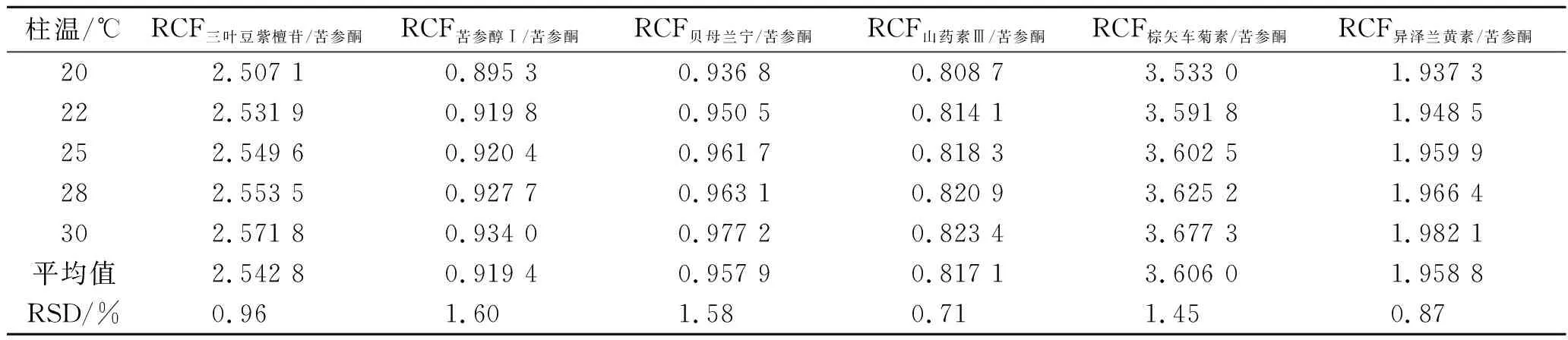
表4 不同柱温对RCFs的影响
2.9.4不同流速对RCFs的影响 精密吸取2.1.1项下制备的混合对照品溶液,按照2.2项下色谱条件进样测定7种成分的峰面积,以苦参酮为内参物,对比考察不同流速(0.7,0.8,0.9,1.0,1.1 mL·min-1)对6种成分RCFs的影响,结果见表5。

表5 不同流速对RCFs的影响
由表3至表5可知,不同仪器、色谱柱、柱温和流速对所建立的RCFs无显著影响,RSDs值均<5.00%,表明本实验所建立的RCFs耐用性良好,在2.2项色谱条件(Agilent Eclipse XDB-C18色谱柱,柱温:25 ℃,流速:0.9 mL·min-1)下能够确保所测结果的可靠性。
2.10色谱峰的定位 精密吸取2.1.1项下制备的混合对照品溶液,按照2.2项下色谱条件进样测定,记录7种成分色谱峰的保留时间,以内参物苦参酮的色谱峰为基准峰,在UltiMate 3000型、Waters 2695型高效液相色谱仪及Agilent Eclipse XDB-C18、Phenomenex C18和Kromasil C18色谱柱条件下采用相对保留时间值法(RRT)对待测成分色谱峰进行定位,结果见表6。

表6 不同仪器、色谱柱对RRT的影响
2.11QAMS法与外标法(ESM)测定结果比较 取3批痔舒适洗液,按照2.1.2项下方法每批平行制备供试品溶液3份,按照2.2项下色谱条件进样测定7种成分的峰面积,分别采用ESM和QAMS法计算7种成分的含量,结果见表7。

表7 各成分含量测定结果 (n=3)
3 讨论
3.1检测波长的选择 取2.1.1项下制备的混合对照品溶液,采用DAD检测器在190~400 nm范围内进行全波长扫描,结果显示,三叶豆紫檀苷、苦参醇Ⅰ和苦参酮在275~298 nm波长范围内有较大吸收,贝母兰宁在205.0,274.5 nm波长处有较大吸收,山药素Ⅲ在193.0,270.0 nm波长处有较大吸收,棕矢车菊素和异泽兰黄素分别在330.0,327.5 nm波长处有较大吸收,为避免紫外末端吸收对检测结果的影响,同时参考相关文献[9-14]选取295 nm作为三叶豆紫檀苷、苦参醇Ⅰ和苦参酮的检测波长,270 nm作为贝母兰宁和山药素Ⅲ的检测波长,330 nm作为棕矢车菊素和异泽兰黄素的检测波长。在此条件下,所记录的色谱图基线噪声较低,7种待测成分色谱峰峰形对称,均能达到有效分离,各成分色谱峰响应值较大。
3.2流动相的选择 本实验在选择流动相时,首先对甲醇-水[10,15]和乙腈-水[9,12,16-18]流动相系统进行对比考察,以痔舒适洗液中7种成分的色谱峰峰形、杂质峰干扰和分离度情况为主要指标,同时兼顾色谱图基线平稳情况,结果发现,乙腈-水系统优于甲醇-水系统,但基线不平稳,苦参酮和棕矢车菊素色谱峰出现拖尾现象,干扰检测结果。因此,在流动相水相中加入一定比例的磷酸[19-21]和甲酸[11,13-14,22-23]进行对比考察,通过摸索优化,最终确定采用乙腈-2 mL·L-1甲酸为流动相进行梯度洗脱,对痔舒适洗液中7种活性成分进行同时检测。
3.3内参物的选择 在痔舒适洗液7种待测成分中,苦参酮在样品中含量较高,保留时间相对居中,峰形对称,对照品易获得,同时苦参酮为痔舒适洗液君药苦参所含主要药效成分,故选取苦参酮为内参物。
本文采用QAMS法对痔舒适洗液中7种成分的含量进行同时测定,建立了痔舒适洗液多指标成分质量控制模式,该方法操作简便、易行,准确度高,为全面、科学地评价痔舒适洗液的质量提供了依据。
