长方案全胚胎冷冻保存后首次冻融胚胎移植时机研究
2021-02-03王莉云马荣花白雪
王莉云 马荣花 白雪
自1978年Edward等报告世界首例试管婴儿诞生以来,人类体外受精与胚胎移植在世界各地已被广泛应用。随着人类辅助生殖技术(ART)的不断发展及应用范围的不断拓展,人们的需求也随之增多,医源性相关疾病也在增加。在ART中控制性超促排卵是常规技术,可在一个助孕周期获得多个卵子,体外受精后可有多个胚胎,从而增加妊娠几率,但同时使得卵巢过度刺激征(OHSS)、多胎妊娠等并发症增加,因此通常每次移植胚胎数在3个以内,剩余的胚胎进行冷冻保存备用。世界首例玻璃化冻融人胚胎于1990年移植获得妊娠,该技术具有不需额外购买仪器、用时短、操作简单、最大限度地降低冷冻技术对于胚胎的影响、胚胎复苏率高等优点,随着胚胎玻璃化冷冻技术的成熟和进步,使冻融胚胎移植(FET)临床应用逐渐扩展。FET周期数和比例逐年增加。继之全胚胎冷冻策略成为一种发展趋势,更多的中心将其作为一种首选的治疗方案。等待冻融胚胎移植患者也越来越多,研究者也更关注技术本身的安全性以及患者的获益,如何选择最佳冻融胚胎移植时机尽量减少进行辅助生殖技术的达活产时间显得尤为重要,但相关研究报道尚不多见。目前未见研究证实经过超促排卵取卵后母体子宫内膜环境多久才能恢复的报道。既往经验为避免超排卵的不良影响,常选择患者自然恢复排卵大约2个月后进行FET,有些患者甚至时间更久,但过长时间的延迟移植使患者处于长时间的渴望期待中,甚至会产生焦虑紧张情绪,从而对未来FET可能造成不良影响。本中心利用部分体外受精-胚胎移植(IVF-ET)患者资料进行分析,旨在探讨首次冻融胚胎移植的时机。
材料与方法
一、研究对象
选择2017年1月至 2018年12月在青海省人民医院生殖中心行体外受精-胚胎移植术(IVF-ET)后行全胚冷冻患者共171例。经患者知情同意并获本院伦理委员会批准实施本研究。
1.纳入标准:(1)常规IVF或单精子卵母细胞浆内注射(intracytoplasmic sperm injection,ICSI)后因取卵前高孕酮、取卵后发热、卵巢过度刺激综合征高风险或者发生其他不可预料的意外等取消新鲜移植(embryo transfer,ET);(2)促性腺激素释放激素激动剂长方案;(3)患者年龄介于20~40岁之间;(4)胚胎冻存均采用玻璃化冷冻方法。
2.排除标准:(1)合并多发子宫内膜息肉、重度不典型增生、多发子宫肌瘤、重度宫腔粘连;(2)反复种植失败(repeated IVF-ET failure,RIF);(3)合并卵巢或其他系统肿瘤;(4)合并病情未控制的甲状腺亢进或减退;(5)除染色体多态性以外的染色体异常。
3.分组:根据患者是否首次行经来诊准备FET,连续序贯治疗不间断,移植间隔最长时间约69 d确定为分组时间点,分为两组,连续序贯治疗间隔时间≤69 d的为间隔短(≤69 d)组共80例,等待时间治疗且间隔时间>69 d为间隔长(>69 d)组共91例。
二、研究方法
1. 基础资料:患者的年龄、BMI、不孕类型、不孕原因、基础内分泌均来自本中心建档记录。BMI=体重[kg]/身高2[m2],患者在试管周期前在本中心测量身高、体重,计算获得BMI;不孕类型分为原发不孕和继发不孕;不孕原因分为子宫输卵管因素、子宫内膜异位症、男方因素及其他;基础内分泌指标为患者在本中心建档后测量的性激素5项(FSH、LH、E2、PRL、T)。
2.控制性超排卵(COH)方案:长方案超排卵,于治疗前月经周期的黄体中期(周期第21天或排卵后7天)应用GnRH-a 1.25 mg,在月经的第3~5天(约降调节14 d)开始促排卵;当主导卵泡的直径≥18 mm,当晚8时注射HCG 5 000~10 000 IU,以诱导卵泡最后成熟,并在注射HCG后36~37 h行取卵术,取卵术后常规IVF或ICSI受精,受精后形成的全部可利用D3胚胎及囊胚均玻璃化冷冻保存。
3.内膜准备方案:(1)自然周期方法:在月经第8~10天B超监测卵泡,当优势卵泡直径达15 mm时,每天测尿LH峰,卵泡直经大于18 mm或出现尿LH峰,当日肌注HCG 5 000 IU,B超监测排卵后第3天移植卵裂期胚胎或第5天移植囊胚。(2)降调节人工周期,用于自然周期无排卵、自然周期内膜不佳,黄体期给予达菲林1.25 mg,降调节14 d后开始雌孕激素准备内膜给予β17雌二醇(芬吗通)2 mg。每日根据内膜生长情况逐渐增加剂量至6 mg/日,通常当雌激素应用大于10 d,内膜厚度超过8 mm时进行内膜转化给予安琪坦胶丸0.4~0.6 g/d阴道塞入,内膜转化3 d后移植卵裂期胚胎或者转化5 d后移植囊胚。
4.指标定义:卵裂率=(授精卵裂胚胎数/受精卵数)×100%,优胚率=(优质胚胎数/正常受精卵裂胚胎数)×100%,ET优胚率=(移植的优质胚胎数/移植的胚胎数)×100%,获胚数指获得的可利用的胚胎数,ET胚胎数指移植的胚胎数量。

结 果
一、两组患者一般情况比较
两组患者年龄、BMI、不孕类型、不孕原因、基础内分泌差异无统计学意义(P>0.05),见表1。
二、两组患者不同内膜准备方案比较
两组患者采用降调节人工周期及自然周期行内膜准备,其差异无统计学意义(P>0.05),见表2。
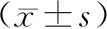
表1 两组一般情况分析(均数±标准差)Table 1 Basic characteristics between the two groups

表2 两组不同内膜准备方案的比较[例(%)]Table 2 Comparison of different endometrial preparation schemes between the two groups [n(%)]
三、两组患者移植囊胚和卵裂期胚胎情况比较
两组患者移植囊胚和卵裂期胚胎所占比例相比较,差异无统计学意义(P>0.05),见表3。
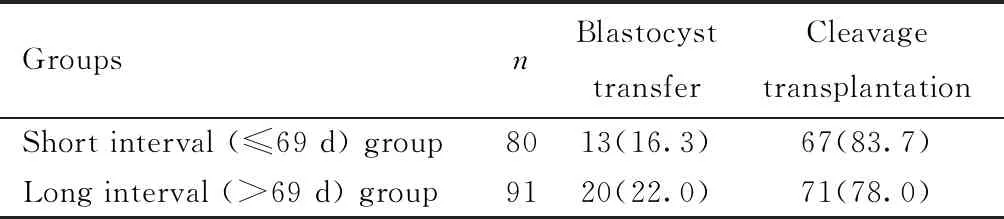
表3 两组囊胚和卵裂期移植情况比较[例(%)]Table 3 Comparison of blastocyst and cleavage transplantation between the two groups [n(%)]
依据获卵数多少再进行分组,获卵数>15个组有90例,获卵数≤15个组有81例,两组妊娠率无统计学差异,但获卵数>15个组的妊娠率有增高趋势,见表4。
四、两组患者妊娠结局的比较
间隔短(≤69 d)组患者在HCG日E2值低于间隔长(>69 d)组,差异有统计学意义(P<0.05)。间隔短(≤69 d)组患者卵裂率、优胚率、ET优胚率及临床妊娠率均高于间隔长(>69 d)组,差异有统计学意义(P>0.05)。两组患者在HCG日的LH值、P值、获卵数、受精率、获胚数比较,差异无统计学意义(P>0.05),见表5。

表4 根据获卵数分组[例(%)]Table 4 Pregnancy rate according to the number of ovums [n(%)]
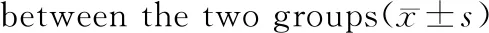
表5 两组妊娠结局比较(均数±标准差)Table 5 Comparison of pregnancy outcomes
讨 论
本研究结果显示间隔短(≤69 d)组妊娠率略高于间隔长(>69 d)组,差异有统计学意义,考虑与间隔短(≤69 d)组患者移植优质胚胎比例和数量相对高有关,使其临床妊娠率有增高趋势,但是否与间隔短(≤69 d)组患者移植时间间隔较短,患者心理状态及依从性好有关系,还需大样本的研究进一步证实。2018年Ozgur[1]等对1 121例全胚冻存后行FET患者进行不同移植时间间隔研究报道,756例32~46 d 行FET,226例47~61 d行FET,139例大于62 d行FET,结果显示1次月经后FET的活产率为57.8%与4次月经后FET的活产率(54.9%)相似。2018年梁利东[2]等研究报道全胚冻存后79例≤45 d为邻近组,276例>45 d为非临近组,两组临床妊娠率分别为51.9%和48.2%,活产率分别为43%和38.4%,差异无统计学意义,认为取消IVF新鲜周期移植后的第一个周期中立即行FET的临床妊娠率和活产率与至少经历一次月经周期后的FET无明显差异。通过本研究及以上相关报道,可以认为全胚胎冻存后,首次行经即可开始行冻融胚胎移植准备,不影响成功率且这种连续序贯治疗,可使患者心理适应性好从而可以减少焦虑紧张情绪相关。
本研究纳入的患者均采用促性腺激素释放激素激动剂长方案进行控制性超促排卵,因此方案可抑制内源性峰提早出现,从而改善卵子质量,提高排卵率和优质胚胎率,开启了IVF-ET 的里程碑,但即使如此优化的方案仍摆脱不了妊娠率低的难题,其中子宫内膜容受性及胚胎-子宫对话异常被认为是引发胚胎着床失败、导致妊娠率低的关键因素[3]。吴琼等研究发现,GnRHa 超排卵后,多个卵泡同时发育成熟排出,引起小鼠着床期雌、孕激素失衡,子宫内膜形态结构发生改变,不能为胚胎着床提供良好的微环境,并可能通过下调 LIF、p-STAT3、HBEGF 和 glycodelin A 蛋白的表达影响子宫内膜容受性的建立和胚胎-子宫对话,进而对胚胎着床产生一定的不利影响,导致胚泡发育缓慢,着床数量减少[4]。本结果显示两组患者获卵数均较多,间隔短(≤69 d)组获卵数约17枚,间隔长(>69 d)组约15枚,HCG日E2值显著增高,超排卵期间及取卵术后除外易导致OHSS发生,雌孕激素失衡明显,不利于胚胎着床,因此选择全胚冷冻后择期FET移植在一定程度上是合理的。另外,研究证明,超排卵可导致卵母细胞发育或者随后的胚胎植入过程中患者血中雌二醇、孕酮、血管内皮生长因子等在内的多种激素水平明显增加[5],超过正常的生理水平。因此,异常的激素环境对卵母细胞的发育潜能、子宫内膜容受性、胚胎的植入等产生了什么样的负面影响?超排卵后激素水平及子宫内膜多久才可以恢复到正常生理状态呢?研究表明,超排卵期间卵巢中存在多个卵泡,每个卵泡均分泌雌二醇(E2)进入循环,使循环中E2水平显著升高,可高达1 500~5 000 pg/mL,卵巢高反应的患者E2水平甚至更高,而高剂量的E2会影响子宫内膜。在一项体外研究中发现,将小鼠胚胎与从人类可生育的妇女获得的子宫内膜组织一起培养,将胚胎暴露在高浓度E2环境下,其胚胎发育异常,粘附力下降[6]。其次,超排卵导致孕激素的提前升高使子宫内膜接受窗发生改变,而这一环境的改变可引起胚胎的表观遗传学改变,其效应可能影响子代生长受限,且这种变化会贯穿于后代整个生命周期[7]。然而子宫内膜容受性是影响胚胎着床率的重要影响因素,研究表明超排卵可使子宫内膜从组织学上发生变化,主要表现为子宫内膜腺体的上皮细胞管腔表面出现胞饮小泡[8],超排卵期间这种改变会出现的比自然状态下更早。IVF周期取卵当天的子宫内膜活检发现,获卵数更多、更年轻的患者子宫内膜的组织学改变会更早发生[9],这一系列的改变可降低子宫内膜与“种植窗期”有关的特殊整合素的表达,影响其接受胚胎的最佳时机[10],从而降低胚胚胎着床率及妊娠率。本研究中所纳入的均为年轻患者,获卵数多,间隔短(≤69 d)组患者E2值为(5 660.7±2 650.4),间隔长(>69 d)组E2值为(5 958.9±3 944.1),E2值间隔短(≤69 d)组明显高于间隔长(>69 d)组,差异有统计学意义;间隔短(≤69 d)组临床妊娠率为68.7%(55/80),间隔长(>69 d)组临床妊娠率为52.7%(48/91),间隔短(≤69 d)组临床妊娠率明显高于间隔长(>69 d)组,表明全胚冻存后首次来月经后子宫内膜容受性基本恢复。2017年Lattes[11]等对512周期冻胚移植周期的妊娠结局做了对比,其中263例取卵后历经一个月经周期后行移植术,249例取卵后历经2个月经周期后移植,两组相比,1个月经周期后活产率(37.6%)高于2个月经周期后的活产率(27.3%),差异有统计学意义,且多因素回归分析表明对活产率有显著影响的变量是母亲的年龄、移植胚胎的数量、移植时胚胎发育的天数和内膜准备类型,而与移植的时间间隔没有关系。
是否全胚胎冻存时代已经到来?当今国内外众多研究充分证明FET各种优势所在,似乎胚胎“冻一冻”会更好。甚至有科学家提出了“非选择性全胚胎冷冻移植(freeze-all ET)”的概念。从2013年到2015年美国辅助生殖技术年报显示新鲜周期移植率从86.7%到73.6%下降[12],同期,中国中华医学会生殖医学分会(CSRM)辅助生殖技术数据上报系统中显示新鲜周期移植率从67.7%下降到53.1%,2016年继续下降为47.8%[13]。
为什么胚胎“冻一冻”会更好?首先从母体方面看,新鲜胚胎移植时超排卵周期母体处在高雌激素水平环境及促排卵药物使用超出正常生理范畴,对子宫产生不利影响,冷冻胚胎保存后,待母体恢复到自然的状态再解冻移植,可以避免新鲜周期母体超生理水平状态移植产生的不利影响。在妊娠期高血压、妊娠期糖尿病、围产期出血等妊娠并发症方面,FET是否较新鲜胚胎移植增加上述风险目前各种研究结果不一、尚无定论,有研究认为FET妊娠期高血压增高[14]、胎盘粘连发病率高[15]、产后出血的发生率高[16]、也有研究认为子痫、妊娠期糖尿病、产后出血并无差异[17-18],各研究不一致可能与研究人群、研究方案不同有关。
从胚胎方面看,冷冻保存的胚胎经过了冷冻、解冻过程,可以“优胜劣汰”,此时仍然存活并正常发育的胚胎也许是更适应外界环境,更具有生存潜能的健康宝宝。国内外有学者研究报道全胚胎玻璃化冷冻复苏移植患者分娩孕周、早产、出生胎儿体重等各项指标均与新鲜周期移植无差异[19-21]。王桂泉综述了近年来FET与鲜胚移植的相关研究,报道FET组低出生体重、小于胎龄儿、早早产 、早产的发生率明显低于新鲜胚胎组,而大于胎龄儿、巨大儿、过期妊娠、围生期死亡的发生率高于新鲜胚胎组。新生儿先天畸形发生率、重症监护室入院率无显著差异。研究认为这可能与新鲜胚胎移植时母体的高雌激素水平,而FET后胚胎的表观遗传学改变有关[22]。
本中心数据依据获卵数再进行组,统计显示获卵数>15个组和获卵数≤15个组妊娠率无统计学差异,但获卵数>15个组妊娠率有增高趋势,提示在长方案促排卵获卵数多的患者行全胚胎冻存可能可以减轻早发OHSS病情,避免晚发OHSS风险。对于非长方案促排卵及卵巢低反应患者,国外有学者回顾性研究显示,在应用微刺激促排卵时,FET组与新鲜胚胎移植组各项临床结局指标均无显著差异,卵巢低反应全胚胎冻存似乎并无明显获益[23]。这有待进一步研究。
综上所述,本研究显示长方案促排卵高反应和正常反应患者全胚胎冻存后首次行经即可开始冻融移植准备,连续序贯治疗缩短移植时间,并不降低妊娠率且可缩短患者TTLB,使患者更加获益。但非长方案促排卵及卵巢低反应患者结局是否一致有待进一步研究。因此,是否全胚胎冻存需根据患者的促排卵方案及卵巢反应性,在患者充分知情同意后选择个体化的移植策略。
