富马酸丙酚替诺福韦片健康人体生物等效性评价
2021-02-02高彩杰郭慧娟石景曼刘建芬张红蕾
高彩杰,郭慧娟,石景曼,刘建芬,张红蕾
富马酸丙酚替诺福韦片(TAF)是一种乙型肝炎病毒(HBV)核苷类似物逆转录酶抑制剂,适用于治疗患有代偿性肝病的成人慢性HBV感染,是近10年来唯一全球批准的一个治疗乙型肝炎新药[1]。替诺福韦二吡呋酯(TDF)是目前国内为治疗慢性乙型肝炎的首选药物之一[2];其最常见的不良反应包括恶心、呕吐、腹泻和腹胀、慢性肾小管损伤、肾功能异常和骨密度下降等[3-4];此外,还可能引起乳酸中毒及与脂肪变性相关的肝肿大等,且有引起Fanconi综合征而改为ETV治疗的病例报告[5-9]。本研究以华北制药华坤河北生物技术有限公司研制的富马酸丙酚替诺福韦片为受试制剂,以GILEAD公司研究开发的富马酸丙酚替诺福韦片为参比制剂,依据NMPA(CFDA)颁布的《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,研究中国健康受试者在空腹和餐后单次口服受试制剂与参比制剂的药代动力学参数,观察人体的药动学行为、生物等效性及安全性,为临床用药提供依据。
1 材料与方法
1.1 药品与试剂
1.1.1 药品:受试制剂:富马酸丙酚替诺福韦片(华北制药华坤河北生物技术有限公司生产,批号:TT04-001,规格:25 mg/片);参比制剂富马酸丙酚替诺福韦片[商品名:韦立得(Vemlidy®),Gilead Alberta ULC生产,批号:013162,规格:25 mg/片]。
1.1.2 试剂:磷丙替诺福韦对照品:磷丙替诺福韦(替诺福韦艾拉酚胺:Tenofovir alafenamide,批号:6-CGS-169-1,纯度98.00%),内标富马酸磷丙替诺福韦-d5(富马酸替诺福韦艾拉酚胺-d5:Tenofovir alafenamide-d5 Fumarate,批号:12-XAL-35-3,纯度:98.10%);空白基质:人血浆(抗凝剂 K2EDTA)来自健康捐献者(衡阳华程医院药物临床试验中心、安徽蚌埠医学院第二附属医院医院采集);人全血(抗凝剂K2EDTA)来自健康捐献者(上海市公共卫生临床中心Ⅰ期临床试验研究室采集并用于制备溶血血浆)。
1.2 试验对象 空腹试验入组44例,共计筛选受试者116例。餐后试验入组51例,共计筛选受试者109例。
入选标准:(1)年龄18~50岁男性和女性受试者(包括18岁和50岁)。(2)男性受试者体质量≥50 kg,女性受试者体质量≥45 kg;体质量指数19~28 kg/m2,体质量指数(BMI)=体质量(kg)/身高2(m2)。(3)受试者同意在给药期间及给药后3个月内采取有效的避孕措施。其中女性受试者应为非哺乳期、妊娠检查阴性或无生育潜能(已绝经连续时间>1年或无子宫的女性被认为无妊娠潜在可能)。(4)试验前问询病史,并进行生命体征、体格检查、12-导联心电图、实验室项目及试验相关各项检查,检测结果均正常或无临床意义的轻度异常,临床研究医师判定认为合格者。(5)无变态反应性疾病史、哮喘史;无本试验相关药物、生物制剂或磷丙替诺福韦产品辅料中任何成分过敏史。(6)受试者自愿参与本次临床试验,了解研究程序且签署书面知情同意书。
试验方案经北大医疗鲁中医院药物临床试验伦理委员会批准,临床试验备案号201900110-01。
1.3 给药方法及血样采集时间点设计 参加空腹试验的受试者于给药前1晚18∶00时统一进食清淡食物,给药前10 h禁食不禁水过夜。临床试验机构工作人员根据随机分配表中的给药序列为每阶段试验分配研究药物,共2个周期。
参加餐后试验的受试者将在试验过程的第1、15、29天(共3个周期),分别口服受试制剂和参比制剂中的1种。各周期给药方法均为单次口服给药,240 ml温水送服,受试者给药前1 h至给药后1 h内禁止饮水。给药后,由研究人员对受试者口腔进行检查,以确保服用药物。给药4 h后和给药10 h后分别为受试者提供标准午餐和晚餐。研究人员应观察研究药物用药情况。给药后2 h内,受试者可坐位或半卧位,禁止平躺。
各周期的药代动力学采血点为:每周期给药0 h(给药60 min内)和给药后15 min,30 min,40 min,50 min,1 h,1.25 h,1.5 h,2 h,2.5 h,3 h,3.5 h,4 h,5 h,6 h,8 h,12 h,24 h,48 h,72 h,96 h和120 h(共22个采血点),分别采集静脉血4 ml至EDTA-K2抗凝管中,采血管放置于冰浴中,离心分离血浆,测定血浆中磷丙替诺福韦的血药浓度。给药前受试者前臂处安放一留置针,每次采集血液样本前抽约1 ml封管液弃去。各时间点采集样本并颠倒混匀后,放置于冰浴中,离心分离血浆,进行分样处理。
2 结 果
2.1 入组及完成情况 空腹试验计划入组44例,共计筛选了116例受试者。44例合格受试者入选进行了随机,随机的44例受试者中43例接受了给药且全部完成试验,受试者“105/S119”完成第1周期给药后,因个人原因退出试验。
餐后试验计划入组51例,共计筛选了109例受试者。51例合格受试者入选并进行了随机,其中49例受试者接受了三周期给药且全部完成试验,受试者“221/S050”完成第一周期给药后,因个人原因退出试验,受试者“222/S052”完成第二周期给药后,因个人原因退出试验。
2.2 药动学参数 受试者单次口服受试制剂和参比制剂药动学参数见表1、2。
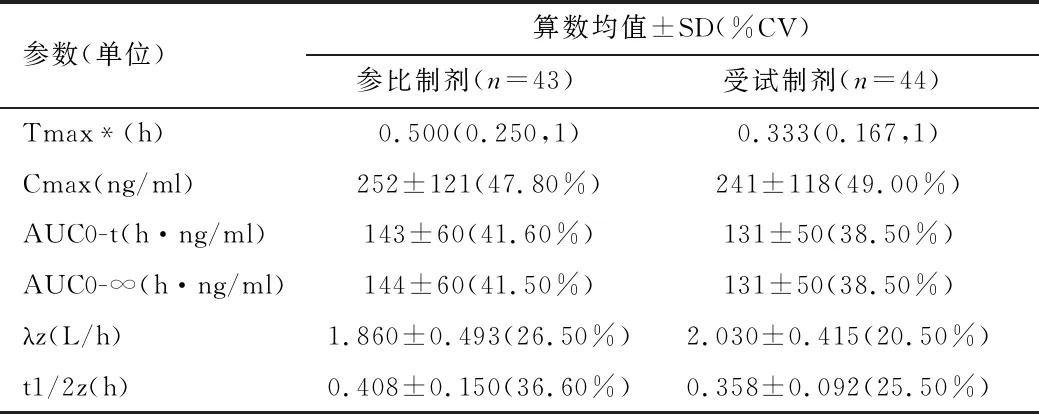
表1 空腹试验药动学参数均值汇总表

表2 餐后试验药动学参数均值汇总表
2.3 生物等效性评价 受试制剂对于参比制剂磷丙替诺福韦的平均相对生物利用度F值:Cmax的比值为(105.56±48.71)%,AUC0-t为(94.72±25.38)%,AUC0-∞为(94.68±25.29)%。受试制剂与参比制剂磷丙替诺福韦Cmax、AUC0-t及AUC0-∞的几何均值的比值分别为96.33%、91.65%和91.63%,各参数几何均值比对应的90%置信区间分别为85.20%~108.91%(Cmax)、85.34%~98.42%(AUC0-t)、85.34%~98.38%(AUC0-∞),把握度分别为91.2%(Cmax)、100%(AUC0-t)、100%(AUC0-∞)。受试者申办单位:华北制药华坤河北生物技术有限公司临床试验总结报告(空腹),报告编号:2019-TAF-001-CSR-01版本:1.0,日期:2020.01.10,54/100 Cmax、AUC0-t、AUC0-∞个体内变异系数分别为34.88%、19.85%和19.80%。采用平均生物等效性(ABE)方法评价生物等效性,各参数几何均值比对应的90%置信区间均符合等效范围要求(80.00%~125.00%),可判定受试制剂与参比制剂的药动学评价指标(AUC和Cmax)具有生物等效性。
2.4 安全性评价 空腹试验期间,受试制剂组2例受试者发生2例次不良事件,不良事件发生率为4.50%,无不良事件判断为与药物相关不良事件,全部不良事件严重程度均为Ⅰ级,不良事件转归为痊愈;参比制剂组4例受试者发生5例次不良事件,不良事件发生率为9.30%,全部不良事件判断为与药物相关不良事件,有1例次不良事件严重程度为Ⅱ级,其余不良事件严重程度均为Ⅰ级,4例次不良事件转归为痊愈,1例次不良事件转归为好转。
餐后试验期间,受试制剂组中3例受试者发生3例次不良事件,不良事件发生率为6.00%,其中2例次不良事件判断为与药物相关不良事件,药物相关不良事件发生率为4.00%,全部不良事件严重程度均为Ⅰ级,转归为痊愈;参比制剂组中10例受试者发生14例次不良事件,不良事件发生率为19.60%,全部不良事件判断为与药物相关不良事件,药物相关不良事件发生率为19.60%,有1例次不良事件严重程度为Ⅱ级,其余不良事件严重程度均为Ⅰ级,10例次不良事件转归为痊愈,3例次不良事件转归为好转,1例次不良事件转归为未知。
综上可知,受试制剂与参比制剂安全性均较好。
3 讨 论
TAF在慢性HBV感染患者中具有较好的降低血清HBV-DNA水平、抑制HBV复制、改善肝功能作用,与TDF相比,具有用量小、疗效好、不良反应少等特点。故可有效提升患者的治疗效果,延缓病情进展,延长存活时间[10]。对于年龄>60岁的骨病及肾功能异常患者,TAF被推荐为治疗慢性乙型肝炎的首选药物[1]。根据Global Data数据,预计到2020年,我国乙型肝炎用药市场规模将达到200亿元,远期将达300亿。TAF 2018年全球制剂销售达11292.2百万美元,增长率约59.6%,且伴随原料药消耗持续上升。因此,该药物在慢性乙型肝炎的治疗中具有广阔的应用前景。
综上所述,富马酸丙酚替诺福韦片受试制剂与参比制剂吸收的速度与程度基本一致,在空腹和餐后给药条件下生物等效性和安全性均良好。
