海南濒危植物蕉木种群结构与动态特征
2021-02-02江杏香陈玉凯吴石松
江杏香,陈玉凯*,吴石松,陈 庆
(1.热带岛屿生态学教育部重点实验室,海南师范大学生命科学学院,海南 海口 571158;2.海南会山省级自然保护区管理站,海南 琼海 571400;3.海南霸王岭国家级自然保护区管理局,海南 昌江 572722)
蕉木(Chieniodendronhainanense)属于番荔枝科蕉木属,为中国特有、单种属,也是我国极小种群植物之一[1]。目前只在中国广西壮族自治区以及海南省部分区域有分布,其生境主要在热带雨林海拔相对较低的沟谷两侧地区[2-3]。其分布面积受砍伐、农垦开发等人类活动的影响而急剧减少,植株数目极少,若不对其施加保护,将有灭绝的危险。
目前对蕉木的研究主要从叶片形态[4]以及花瓣结构[2]等方面开展,鲜有学者对蕉木的种群结构与动态特征展开研究。蕉木种群濒危状况加剧,对濒危植物蕉木的种群结构以及其动态分析是研究其种群生态学的关键方法之一[5-6],而种群结构、生命表、生存分析函数和时间序列预测模型对分析濒危植物天然种群结构、阐明种群受外界干扰状况及未来的发展趋势具有重要意义[7],同时对保护及管理濒危种群植物有至关重要的作用。
本研究在海南全岛自然分布的蕉木典型群落结构分析基础上,进一步对人为干扰程度强和弱两种生境中的野生蕉木种群进行对比;运用种群动态量化方法、静态生命表、生存分析和时间序列模型等种群特征指标,揭示不同干扰程度下蕉木种群生存现状和动态变化趋势,探索蕉木种群濒危的原因,为维护和恢复蕉木种群提供科学参考。
1 材料与方法
1.1 研究区概况
海南岛地势呈中央高四周低,主要的山脉为五指山、鹦哥岭,海拔由中央向外逐渐降低,呈现明显的梯级状。岛内土壤主要成土母岩为玄武岩、花岗岩,砖红壤、黄壤和赤红壤为该地区常见的3种基本土壤种类[8]。
对海南岛内的蕉木所处群落中的典型植被采用“样方法”,每个样方的大小为20 m×20 m。调查样方中所有群落个体的树高、胸径等,同时采用“实测法”进行蕉木种群调查,调查每个样方内和其他非典型群落分布点的蕉木个体(包含小树、幼树和幼苗)的树高、胸径等,并将蕉木种群分为两大生境:受人为干扰较强和较弱生境。其中,“实测法”调查主要在海南岛的中南部山区进行,“样方法”调查集中在霸王岭、吊罗山、尖峰岭、鹦哥岭等国家级自然保护区内及周边地区,共选取了9个典型样方。
1.2 蕉木种群分析方法
1.2.1 群落的结构和组成分析
采用立木级结构法分析蕉木所在群落的结构特征[9],并通过蕉木群落优势物种的重要值和常见的物种多样性指数对蕉木样方范围内的物种分布情况进行分析[10-11]。
1.2.2 径级划分
以胸径(DBH,量符号为DDBH)大小取代年龄大小来探究蕉木种群动态[12]。将蕉木种群分为以下7个龄级:DDBH≤2.5 cm为龄级Ⅰ阶段;2.5 cm
1.2.3 种群动态量化方法
使用种群动态量化方法[13]分析蕉木种群动态:
(1)
(2)
式中:Vn表示蕉木种群各龄级之间的动态指数,且Vn值的范围为-1~1;Sn表示第n龄级蕉木植株的数量值。Vpi表示蕉木种群未遭受到外界因素干扰情况下的种群结构数量动态变化指数,k表示蕉木种群龄级数目。当种群遭受外部干扰时,需将式(2)进行修改:
(3)
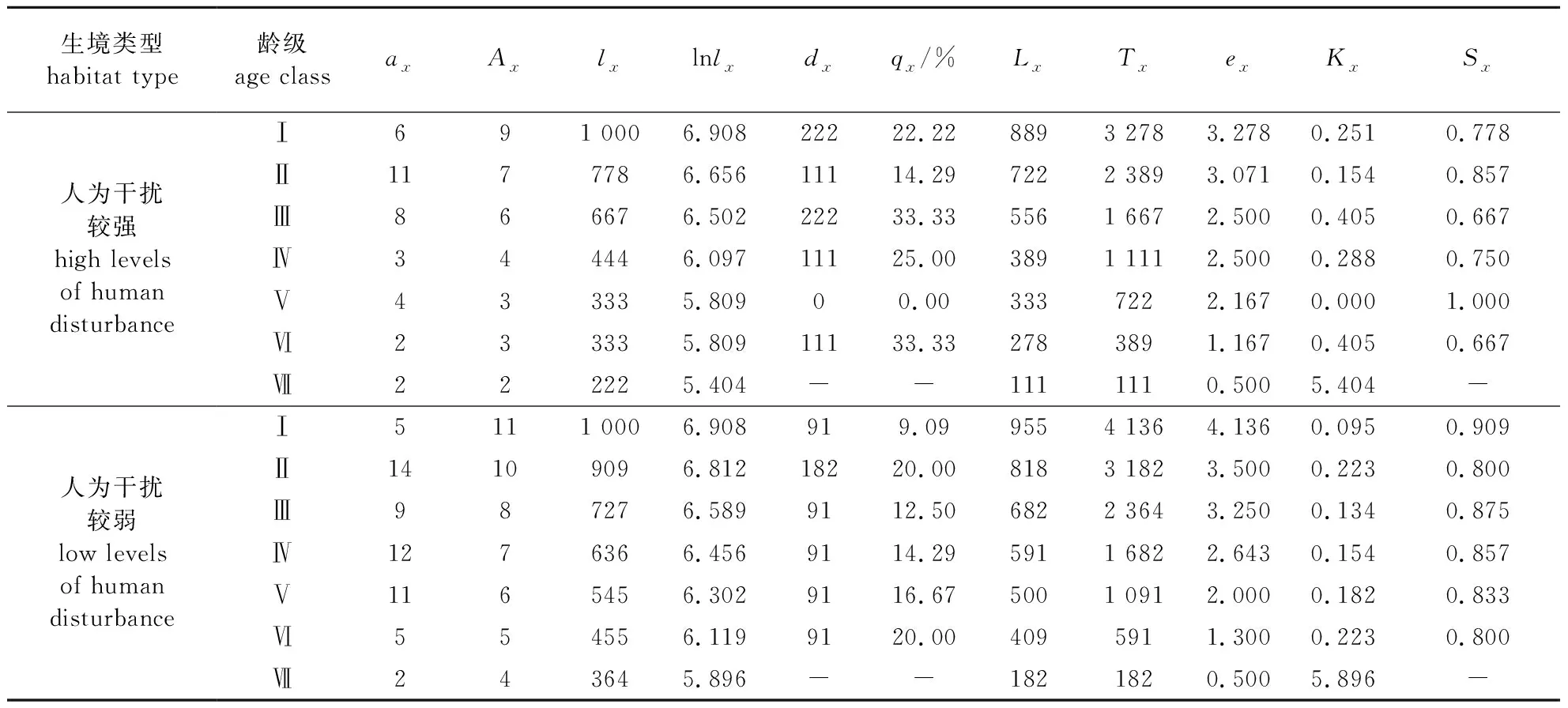
1.2.4 种群静态生命表建立
根据静态生命表的编写体系,编写蕉木种群的静态生命表。为避免生命表中存在死亡率为负值的情况,本研究使用匀滑处理技术对各个龄级内的蕉木实际数目进行匀滑修正[14-15]。
1.2.5 种群生存分析
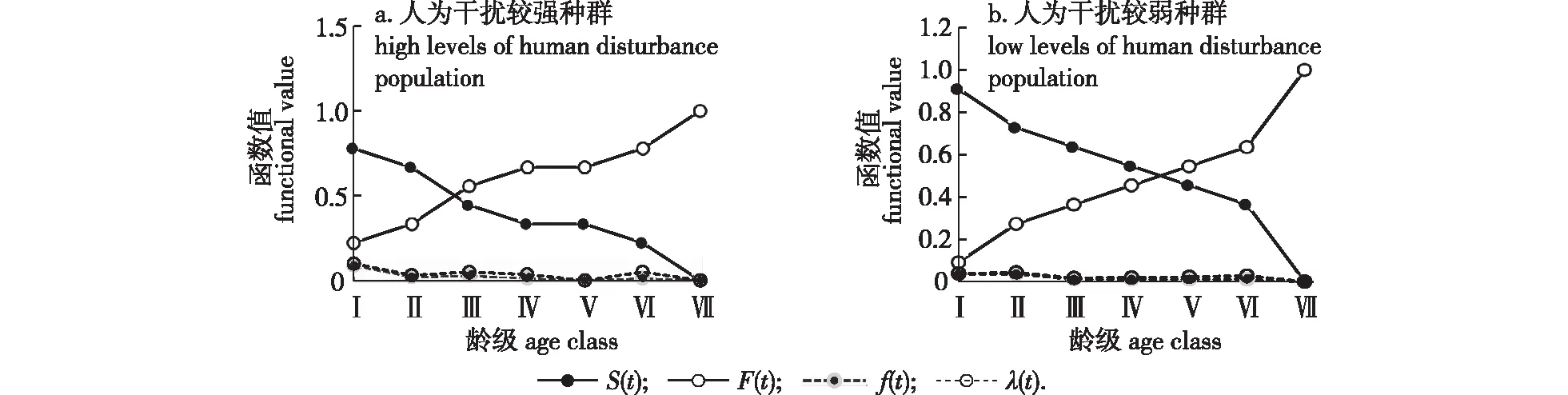
本研究引入生存分析4个函数[16]:λ(t)、f(t)、F(t) 以及S(t),其分别表达的是各龄级的危险率、死亡密度、积累死亡率以及生存率。通过这4个函数来分析蕉木种群的生存动态,以径级对应的龄级为横坐标,以标准化存活数为纵坐标,绘制蕉木种群的存活曲线。
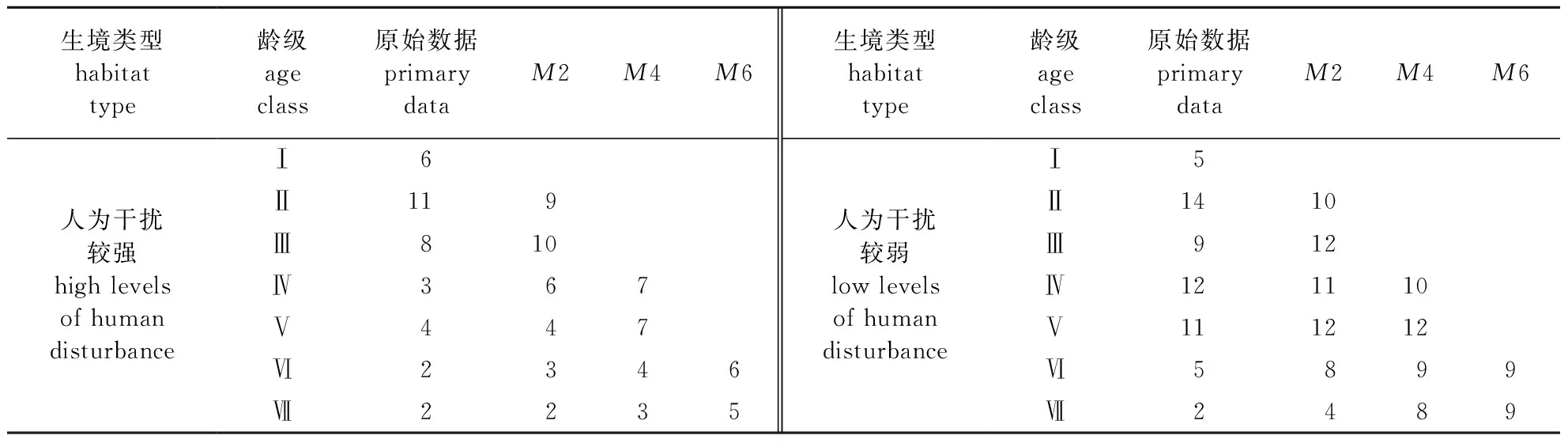
1.2.6 种群数量动态的时间序列预测
通过时间序列模型模拟并推测蕉木种群在将来2、4、6 年时的龄级结构情况[16]。
(4)
式中:n表示进行模拟的将来时间,a;t表示龄级大小;Xk表示k龄级种群植被的实际存活数目;Mt表示t龄级蕉木在n年之后的种群实际存活数目。
2 结果与分析
2.1 海南蕉木所在群落的结构和组成特征
经调查发现(表1),海南蕉木群落的成层结构中,乔木层的最主要优势种是砂糖椰子(Arengapinnata)、大叶鼠刺(Iteamacrophylla)、蕉木(Chieniodendronhainanense)、野荔枝(Litchichinensis)、山苦茶(Mallotuspeltatus)、白茶树(Koilodepashainanense)等(重要值大于2.0)。乔木可分为3个亚层,第1亚层高12~20 m,主要树种为野荔枝、橄榄(Canariumalbum)、海南韶子(Nepheliumtopengii)等;第2亚层高8~12 m,主要树种有鸭脚木(Scheffleraheptaphylla)、砂糖椰子、蕉木等;第3亚层高6~8 m,主要树种有大叶鼠刺、厚壳桂(Cryptocaryachinensis)等。灌木层以白茶、山苦茶、海南暗罗(Polyalthialaui)等为优势种;草本层以穗花轴榈(Licualafordiana)、百足藤(Pothosrepens)等为优势种。
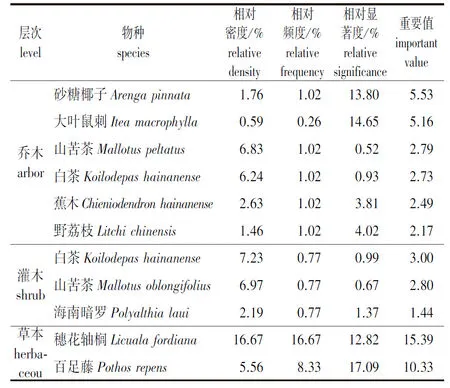
表1 蕉木群落优势物种的重要值概况
在蕉木群落中灌木层的物种丰富度最高,草本层的最低。而Simpson优势度指数、Shannon-Wiener多样性指数、Pielou均匀度指数的值,均是群落中乔木层最高,分别为0.920、3.310和0.659,该结果表明乔木层发育良好,物种组成较丰富、优势度和多样性最高。
2.2 海南蕉木种群分布的基本特征
本次共调查9个典型样方内(33株)和其他区域(61株)蕉木个体共94株。其中,受人为干扰较强生境的蕉木种群个体株数为36株,生境条件和群落发育一般,分布海拔较低(小于600 m),群落郁闭度为0.5~0.7,林分稀疏、群落结构简单(1~3层),受到旅游开发或农垦活动等的影响较大,干扰方式多样;而受人为干扰较弱生境的蕉木种群个体株数为58株,生境条件和群落发育良好,分布海拔较高(600 m以上),郁闭度为0.7~0.9,林分较密闭、群落结构复杂(3~5层),人为活动较弱。因此,受干扰较弱生境种群的个体数量、种群和群落发育情况以及生境条件均比受干扰较强生境中蕉木种群的高。
2.3 海南蕉木种群结构特征
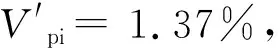
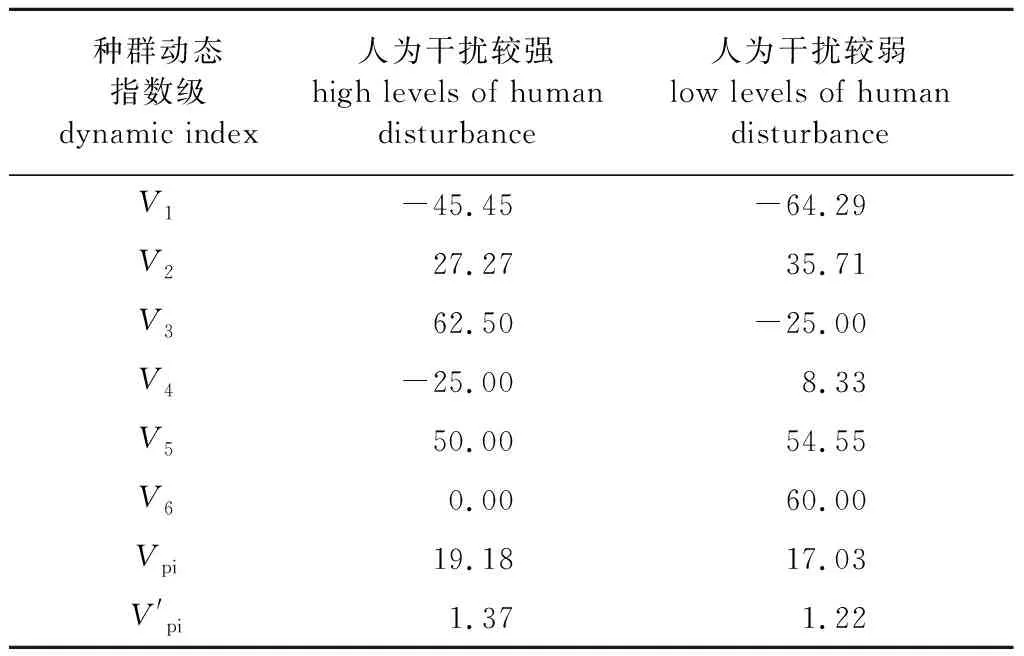
表2 蕉木种群动态变化指数
两种生境中蕉木种群各龄级均未出现个体缺失的现象(图1)。
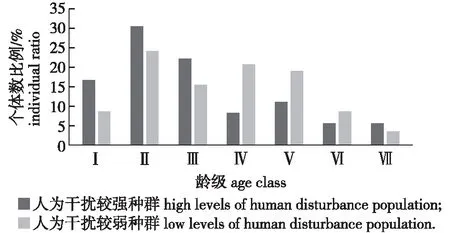
Ⅰ. DDBH≤2.5 cm;Ⅱ. 2.5 cm 人为干扰程度较强生境的Ⅰ—Ⅱ龄级(幼龄)个体占比达到47.22%,Ⅱ龄级植株所占比例为所有龄级中最高的,达到30.56%,Ⅲ—Ⅴ 龄级(中龄)个体占比达到41.67%,而Ⅵ—Ⅶ龄级(老龄)个体占比仅占11.11%。人为干扰程度较强生境当前其种群的结构趋向于增长型。人为干扰程度较弱生境的Ⅰ—Ⅱ龄级(幼龄)个体占比达到32.76%,Ⅱ龄级植株所占比例为所有龄级中最高的,达到24.14%,Ⅲ—Ⅴ 龄级(中龄)个体占比达到55.17%,而Ⅵ—Ⅶ龄级(老龄)个体占比仅占12.07%。总之,人为干扰程度较弱的生境当前其种群的结构趋向于稳定型。 蕉木静态生命表结果显示(表3),两个区域蕉木随着龄级的升高种群存活数(lx) 逐渐减小,并且伴随龄级的增高,蕉木种群的生命期望值(ex)呈下降趋势,这样的变化规律是由于种群渐渐接近生理寿命,基本上符合种群的生物学特点。人为干扰程度较强生境蕉木种群死亡率(qx)种群消失率(kx)均在第Ⅲ和第Ⅵ龄级出现高峰,在Ⅴ龄级时值为0,说明受干扰程度较强生境较适合Ⅴ龄级植株的生存。受干扰程度较弱的生境死亡率(qx)在第Ⅱ龄级出现高峰,而种群消失率(kx)在第Ⅱ和第Ⅵ龄级时出现高峰。 表3 蕉木种群静态生命表 指数方程Nx=N0e-bx、幂函数方程Nx=N0x-b分别用于描述Deevey-Ⅱ型和Deevey-Ⅲ型曲线[17],检验蕉木种群存活曲线类型。通过两方程对不同生境的蕉木种群所倾向的类型进行检验,得出受干扰程度较强的种群为:Nx= 7.217 8e-0.04x(R2=0.973 1),Nx=7.125 1x-0.121(R2=0.891 6)。受干扰程度较弱种群为:Nx=7.142 7e-0.026x(R2=0.989 4),Nx=7.071 7x-0.078(R2=0.878 0)。 图2 不同干扰强度下蕉木种群生存率、积累死亡率、死亡密度和危险率曲线Fig.2 Survival rate, cumulative death rate, mortality density rate and hazard rate of Chieniodendron hainanense population in different disturbance levels 两个生境的蕉木种群指数函数式的R2值(0.973 1和0.989 4)均略大于幂函数式的R2值(0.891 6和0.878 0),表明两种干扰生境的蕉木种群存活曲线均更趋于Deevey-Ⅱ型(对角线曲线),即海南蕉木种群不同龄级之间具基本相同的死亡率。但对于受干扰程度较弱地区的蕉木存活曲线而言,受干扰程度较强地区的存活曲线成下降趋势更甚。由此可知,人为干扰程度较强的地区的蕉木种群存活能力略低于人为干扰程度较弱的地区。 经分析发现(图2),两种生境的蕉木种群生存率和累计死亡率的值之和为1,龄级逐渐升高的情况下,蕉木种群的S(t)值逐渐降低,而F(t)值逐渐升高。人为干扰程度较强生境中蕉木种群的死亡密度f(t)值及危险率变化曲线λ(t)值先快速下降,后稍有波动,在Ⅴ龄级时值为0,种群进入下一龄级植株死亡密度以及危险率极低,虽然在Ⅵ龄级处死亡密度处于较低的水平,但由于进入衰老阶段,种群危险率升高。人为干扰程度较弱区域蕉木种群死亡密度曲线在Ⅰ—Ⅱ以及Ⅲ—Ⅳ龄级时呈现上升趋势,在Ⅱ进入Ⅲ龄级阶段死亡密度呈较大幅度下降。危险率变化曲线与死亡密度曲线的变化有所相似,但在Ⅰ—Ⅱ以及Ⅲ—Ⅳ龄级时呈现不变的趋势。 根据蕉木种群时间序列分析结果(表4),在经历未来的2、4、6个龄级后,人为干扰较强蕉木种群中、老龄植株的数量有逐渐增长趋势,表明蕉木种群具有一定的恢复潜力。蕉木种群Ⅱ龄级在未来2个龄级后显现出衰退的趋向,体现蕉木幼苗数目匮乏,自我更新能力较差。人为干扰较弱的蕉木种群Ⅱ、Ⅳ龄级也显现出衰退的趋向,其他龄级数量在2、4、6个龄级后逐渐增长;Ⅳ龄级出现衰退趋势是由于干扰程度较弱地区Ⅲ龄级的植株数量较为匮乏所致。两种生境蕉木幼苗的自我更新能力不足,所以必须对蕉木幼龄个体采取适宜的保护措施,并加强对老龄植株的保护,同时应在干扰程度较弱区域加强对Ⅲ龄级植株的保育工作。 表4 蕉木种群动态变化的时间序列预测 海南岛两种不同干扰程度生境蕉木种群的幼树和中树个体的数量虽然都较丰富但幼苗个体缺乏,老树个体所占比例也较小,种群自我更新能力不佳,这与馨香木兰种群的特点相似[17];幼龄的植株数量得到保证是决定一个种群能否维持稳定的根本[14],对许多濒临灭绝的植物更是维持种群稳定的基本条件[18]。因此,若蕉木种群的幼苗个体长时间缺失,现存蕉木种群结构及其稳定性将难以保持,将进一步加剧种群衰退趋势。 受人为活动影响,蕉木种群Ⅱ龄级在未来2个龄级后将显现出衰退的趋向,该原因与海南苏铁低龄幼苗在五指山部分地区较缺失原因类似[19]。同时,种群的存活曲线表明,蕉木种群在干扰程度较强的生境中生长发育较不适应,这与蕉木内轮花瓣近轴面瘤状突起发育及功能研究中所提及的蕉木生存情况不相同[2];蕉木种群存活曲线更趋向于Deevey-Ⅱ型,可能由于进入幼苗阶段后更能适应生活环境,抵抗力有所增加;而群落内资源充沛、竞争压力较小也可能是其主要原因之一。除此之外,与其他种群相同[20]的是老龄级蕉木的数量较少,其原因是该龄级个体进入衰老的生理年龄,其营养生长滞缓,导致对环境的抗逆性较弱。 本研究中蕉木种子寿命短,形成落下之后易腐烂,这样的生理特性容易导致种子还未萌发就已失去活性。目前野外现存的蕉木果实常被动物取食,造成蕉木种子数量减少,这也成为一些呈衰退种群有效种子减少的主要原因[21]。另外,在野外调查发现蕉木种群多生活在岩石裸露率较高的地区,种子成熟后易掉落于岩石上无法萌发。特别是干扰程度较强地区的人类活动较为频繁,容易导致蕉木适宜的生存环境不断减少,而干扰程度较弱地区可能由于群落郁闭度较高,在缺乏光照或土壤条件不好的环境中,也容易导致种子无法正常萌发。本研究中当蕉木种群生长至幼苗后,存活率呈现相对稳定趋势,表明蕉木只要成功过渡到幼苗期,其生存能力可较大程度地提高,这些特点与青冈栎次生林的研究结果相似[21-22]。两种干扰生境中种子萌发率低导致的幼苗个体数量及其自我更新能力不足可能是蕉木种群成为濒危种群的重要原因之一。因此,将蕉木种子成功转化为幼苗是恢复种群的关键。 针对蕉木种群濒危的现状,应对蕉木植株较密集区域,在果实成熟季节(冬季至次年春季)安排相关人员定期采收蕉木种子;将成熟的蕉木种子收集后,加以一定的人工辅助的手段帮助种子萌发。当幼苗长至适合的大小时,将蕉木幼苗再移植回原种群生境或类似的适宜生境中;对于蕉木种群较分散地区,需在中龄植株生境的一定范围面积内采取就地保护措施。同时,需要对中树加以一定人工抚育,使其竞争能力得以增加,防止成树的缺失而导致种子生成率降低;也可通过适当修剪老龄的蕉木个体促进其萌芽,提高开花结实率。2.4 海南蕉木种群静态生命表及存活曲线
2.5 海南蕉木种群的生存分析
2.6 海南蕉木种群数量的时间序列分析
3 讨 论
