稻瘟病抗性基因Pita2的克隆及其介导的防御相关基因表达分析
2021-02-02徐鑫姜伟高梁华兵王晓婉刘松青王春台
徐鑫,姜伟高,梁华兵,王晓婉,刘松青,王春台
(中南民族大学 生命科学学院&武陵山区特色资源植物种质保护与利用湖北省重点实验室&生物技术国家民委重点实验室,武汉430074)
由稻瘟病菌(Magnaportheoryzae)引起的稻瘟病是水稻最严重的病害之一[1].稻瘟病在水稻的整个生育期都可以发生,每年可造成10%~20%水稻减产,严重时减产40%~50%,甚至颗粒无收[2].稻瘟病在全球各地稻区均有发生,严重威胁着水稻的增产稳产[3].长期的实践证明,利用水稻自身对稻瘟病的宿主抗性,借助单个抗性基因或聚合多个抗性基因以提高水稻抗性,从而来培育抗稻瘟病水稻品种,被普遍认为是当前最为经济、有效且安全的措施[4].由于稻瘟病菌群体普遍存在高度变异性,培育的单一抗性基因抗稻瘟病水稻品种通常在种植几年后会丧失对稻瘟病的抗性[5].目前解决该问题的主要办法就是聚合多个抗性基因,从而使得水稻品种获得具有持久性的稻瘟病广谱抗性,因此在遗传资源中挖掘新的稻瘟病抗性基因尤为重要.
通过图位克隆、全基因组序列分析和转录组分析等方法,研究人员对稻瘟病抗性基因进行广泛研究,现已确定了大量的抗稻瘟病相关抗性基因[6].截至目前为止,研究人员已成功鉴定了100多个主要稻瘟病抗性基因,30个基因已经完成分子克隆[7].稻瘟病抗性基因Pita2与Pita来源于同一抗性供体品种即菲律宾籼稻Tadukan[8],两个基因聚集并定位于水稻12号染色体的着丝粒区域.Pita很早就被克隆[9],并在分子水平上研究了与相应无毒基因AVR-Pita的相互作用[10],在生产实践上得到了广泛应用.Pita2对稻瘟病菌生理小种的抗谱比Pita更广,拥有更大的应用前景[11],但由于染色体着丝粒区域存在高度重复序列和抑制重组的特性,Pita2的研究工作一直进展很慢.
通常,在病原微生物侵染植物后,被侵染的植物体部位与病原体会相互作用产生信号,并将信号传导到其他组织,进而诱发植物体产生一系列防卫防御反应.目前许多研究表明,水杨酸(Salicylic Acid,SA)和茉莉酸(Jasmonic Acid,JA)在植物体免疫应答抗病信号途径中具有重要的调控作用[12].一方面,在植物免疫应答过程中,SA主要在系统获得性抗性(Systemic Acquired Resistance,SAR)过程起到重要作用——即病原菌在成功侵染寄主植物后,寄主体内会产生大量SA,导致病程相关蛋白(Pathogenesis Related Protein,PR)基因的表达,从而增强植物的抗病性[13].NH1和WRKY45是SA信号途径的主要调控因子,过表达OsNH1或其同源基因后,成功激活SAR反应后增加水稻的抗病性;若缺失OsNH1则SA信号转导途径不能被正常激活[14].此外,SA及其衍生物苯并噻二唑(BTH)可诱导OsWRKY45的表达,大量研究表明OsWRKY45的过表达可显著增强水稻的抗病性,但该基因的沉默大大减弱了BTH诱导的稻瘟病抗性[15].另外一方面,水稻中JA可诱导OsPR1a,OsPR1b,OsPR2等PR基因的表达[16].OsAOS2是JA的合成相关基因,过表达该基因可以使PR基因表达上调,并且增强水稻抗病性.
在前期研究中,利用Co39 × Reiho(Pita2抗性亲本的Co39近等基因系材料)的2031株F2群体,根据日本晴的参考序列,将Pita2定位于水稻12号染色体10.79~10.85 Mb靠近着丝粒的区域约75 kb范围内.但由于目的区段与水稻日本晴及9311的基因组存在较大差异,无法通过常规的电子定位和长距离PCR等技术进行分离和克隆[17].本研究拟通过构建并筛选该基因供体品种的Fosmid文库,构建Pita2候选区域的物理图谱并互补验证候选基因.进一步从本实验室前期在武陵山区收集的稻瘟病菌生理小种库中,筛选出基因型接近、对Pita2致病性完全相反的菌株组对水稻进行离体接种,拟通过检测接种稻瘟病菌前后相关防御基因的表达量变化,分析在抗病过程中Pita2基因与水稻抗病信号通路的关系.
1 材料与方法
1.1 Fosmid文库构建
用CTAB法提取PiNo.4植株(Pita2抗性亲本)的基因组DNA,经酶切处理回收总长度25~50 kb的条带.将回收的片段进行末端平滑化和磷酸化处理,再连接到pCC1FOS(EPICENTRE)载体上.4 ℃连接过夜,连接产物转化后涂布平板.根据效价公式,titer(CFU/mL)=(克隆数×稀释倍数×103μL/mL)/所用稀释未扩增文库的量(μL),得出文库的滴度为(2.7~4.3)×105CFU/mL.构建的文库预计总共获得克隆为10万多个,其平均插入片段为35 kb,按照大小约为430 Mb的日本晴水稻基因组,该文库覆盖基因组约为8.0~11.4倍.
1.2 真菌材料和疾病的评估
稻瘟病菌菌株来自本实验室在武陵山区收集的病菌生理小种库.菌株在燕麦培养基上培养14 d后,灭菌的去离子水清洗,然后在蓝光环境下培养7 d(25 ℃,高湿度).用分生孢子悬浮液[(2~3)×105分生孢子/mL]喷洒接种4~5叶期幼苗.接种后在湿度培养箱(25 ℃,100%相对湿度)中培养30 h,再将水稻幼苗移至温室,当其出现病斑10 d后对其进行复查.在调查发病情况时,选择病斑长度最长的植株.
1.3 农杆菌介导的遗传转化
处理后的日本晴水稻种子在N6诱导培养基上28 ℃光照培养6 d之后,在水稻胚的一端长出浅黄色致密的愈伤组织;用含有候选基因的农杆菌侵染生长状态良好的愈伤组织,在28 ℃暗培养3 d后,置于筛选培养基上培育至长出新的愈伤组织;将新生长出的愈伤组织置于分化培养基上,28 ℃光照培养,根据分化状态再选择性地进行分化继代工作.最后将分化出来的小苗移植到生根培养基上2周左右.
1.4 qPCR分析
用TRIzol法对接种前后水稻叶片提取RNA,在DNase处理后经反转录形成cDNA.用Actin引物进行PCR扩增,条带大小符合预期.以cDNA为模板,进行RT-PCR程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共36个循环;72 ℃再延伸10 min,制备1%琼脂糖凝胶检测PCR产物.内参基因与目的基因同时扩增,每个样品3次技术重复.qPCR在实时荧光定量PCR仪上进行,采用2-△△Ct算法分析计算结果.
2 结果与分析
2.1 Pita2物理图谱的构建和候选基因的预测
通过对本课题组前期筛选出的分子标记的进一步验证,挑选出8对特异性分子标记,进行PiNo.4文库的筛选,获得覆盖Pita2候选区域的3个Fosmid克隆,构建了Pita2区域基于抗性亲本PiNo.4的物理图谱(图1),并对该区域的候选基因进行了功能预测(表1).

图1 稻瘟病抗性基因Pita2的物理图谱以及候选基因的分布Fig.1 The physical map of the rice blast resistance gene Pita2 with the candidate ORF
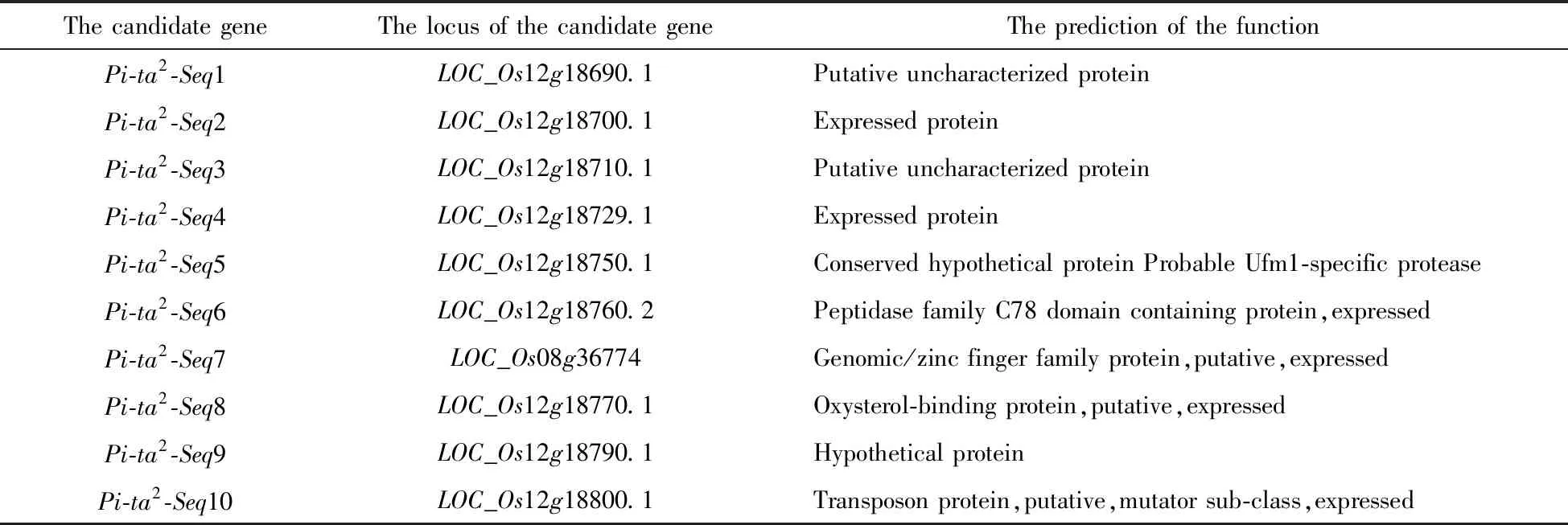
表1 Pita2候选基因功能预测Tab.1 The function prediction of the Pita2 candidate genes
2.2 Pita2候选基因的互补验证
通过反转录PCR扩增来分析Pita2候选基因表达情况,确认有5个具有表达的基因(Pi-ta2-Seq4,Pi-ta2-Seq5,Pi-ta2-Seq6,Pi-ta2-Seq8和Pi-ta2-Seq9).选用这些基因进行农杆菌介导的遗传转化,经鉴定为阳性的转基因植株培育至四叶期后,采摘剑叶,离体接种稻瘟病菌生理小种race007.观察统计10 d后接种情况如图2所示,与阴性对照Nip(“日本晴”品种,表现为稻瘟病感病表型)相比,含有候选基因Pi-ta2-Seq5、Pi-ta2-Seq6、Pi-ta2-Seq8和Pi-ta2-Seq9的植株表现出与Nip相近的病斑情况——表现出感病表型.而含有候选基因Pi-ta2-Seq4植株表现出与阳性对照PiNo.4一致的病斑情况——表现出对稻瘟病极强的抗病性,揭示了候选基因Pi-ta2-Seq4就是稻瘟病抗性基因Pita2.

图2 转基因T1阳性植株接种稻瘟病菌race007Fig.2 The symptom of the T1 progeny inoculated with M.oryzae race 007
2.3 Pita2介导的抗性反应中相关防御基因表达量检测
从前期在武陵山区收集的稻瘟病病菌生理小种库中,筛选出了一组遗传距离相近、对PiNo.4致病性差异较大的菌株13014和13015进行离体接种.NIP(粳稻,水稻标准测序品种)、LTH(丽江新团黑谷,籼稻,稻瘟病易感品种)、Co39(粳稻,稻瘟病易感品种)、Pita2供体品种PiNo.4繁种移栽培育至4~5叶期后,采摘剑叶或下一叶,离体接种稻瘟病菌13014和13015.观察统计接种10 d后情况如图3所示,与感病植株Nip、LTH、Co39相比,PiNo.4对稻瘟病菌13014的侵染表现出感病情况,然而PiNo.4对稻瘟病13015的侵染则表现出抗病情况.这两组菌表现的致病性结果与筛选菌株时所用的致病性分析结果完全吻合,可以作为研究防御基因变化接种使用的稻瘟病菌.

图3 四种水稻植株接种不同稻瘟病菌的感病情况Fig.3 Four rice cultivars inoculated with different rice blast fungus
对接种稻瘟病菌株13014和13015前后水稻中稻瘟病相关的防御基因(WRKY45、PR1b、NPR1和AOS2)进行检测,结果如图4所示.PiNo.4植株中WRKY45基因本底表达水平比其他易感植株高,在接种稻瘟病菌13014和13015后,易感株WRKY45基因均无明显变化;在PiNo.4植株中WRKY45基因呈显著下调,说明该信号通路可能受到抑制.在SA信号通路中,WRKY45和OsNH1基因独立表达,互不干涉[18].PiNo.4株中OsNH1基因在接种稻瘟病菌后呈显著上调,表明PiNo.4植株通过基因OsNH1介导SA免疫信号通路.位于OsNH1下游的OsPR1b在接种稻瘟病菌13014后显著下调,说明该基因的表达受到稻瘟病菌的抑制;在接种稻瘟病菌13015后上调,表明稻瘟病菌13015不足以抑制OsPR1b的表达.在接种稻瘟病菌13014和13015后,PiNo.4植株中OsAOS2表达量均出现显著上调的现象,表明稻瘟病菌的侵染成功激活了水稻中JA抗病信号通路.上述稻瘟病相关防御基因的表达量表明PiNo.4植株在稻瘟病菌侵染后均成功激活了SA和JA抗病信号通路,但在接种了稻瘟病菌13014的PiNo.4植株中,SA信号通路的OsPR1b受抑制,下游免疫信号途径受抑制,表现出感病症状;而接种了稻瘟病菌13015的植株中,OsPR1b表达上调,能成功激活下游抗病基因,从而产生抗病反应,与离体接种的实验结果完全吻合.
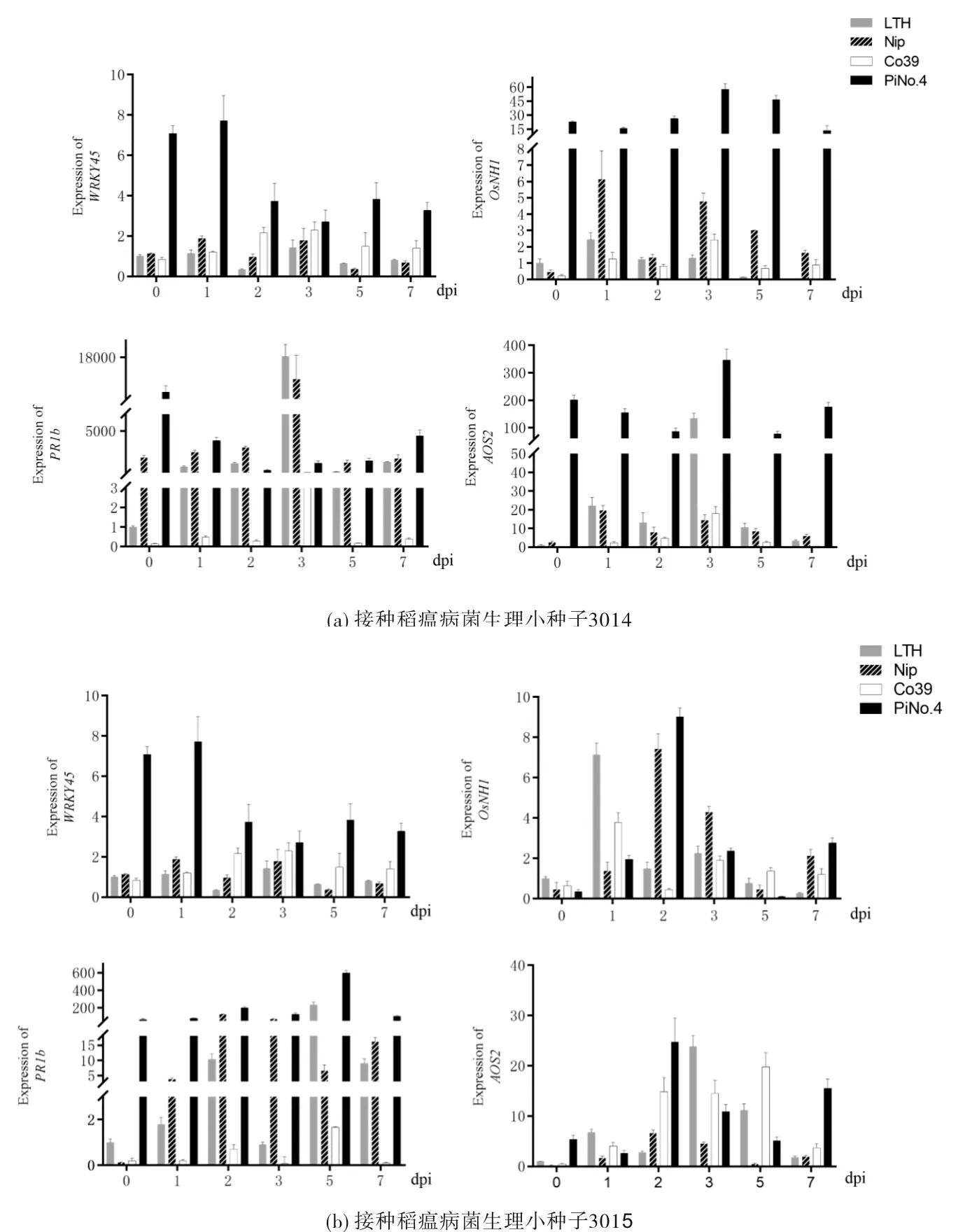
图4 接种前后与抗病防御相关基因的表达量Fig.4 Expression level of defense-related genes before and after inoculation
3 结语
在前期研究中利用近等基因系群体,通过HEGES系统和SNPs测序对PCR标记进行研究,成功分离Pita和Pita2基因,对Pita2进行了精细定位.鉴于该区段与日本晴序列差异很大,通过常规长片段PCR克隆的方法很难得到目的基因,本研究通过构建基于抗性亲本 PiNo.4的Fosmid 文库,筛选了覆盖目标约75 kb区段的3个Fosmid克隆,构建了基于抗性亲本的物理图谱.通过候选基因的互补验证,确定了候选基因Pita2-Seq4就是稻瘟病抗性基因Pita2.贾育林课题组在抗性亲本Katy克隆了Ptr基因,发现其特异性地参与Pita/Pita2介导的抗稻瘟病过程,Ptr的突变消除了Pita2相关的AVR-Pita和Pita2特异性AVR基因的识别.同时Ptr与Pita2的抗谱也高度相似,推测其可能就是Pita2[19].Ptr与候选基因Pita2-Seq4的日本晴同源基因一致,因此本研究通过在Pita2标准抗性亲本中的基因克隆及互补验证,确定Ptr和Pita2为同一基因.
一组稻瘟病菌基因型接近、对Pita2致病性相反的菌株对Pita2抗性水稻进行离体接种,结果表明Pita2基因在稻瘟病菌侵染后均成功激活了SA和JA抗病信号通路,但主要是通过参与水稻SA信号通路,从而赋予水稻抗性.
