氧掺杂g-C3N4的制备及其吸附性能
2021-02-02徐启红
徐启红
(漯河职业技术学院,河南漯河 462000)
染料废水对人体有致癌、致畸作用,如不经有效处理直接排放到环境中,会严重危害人体健康[1-2]。染料废水的处理方法主要有氧化工艺和吸附法。氧化工艺包括光催化、微波催化、光降解、Fenton、光-Fenton、超声和臭氧氧化等,可将有机污染物转化为无毒物质;但氧化工艺会产生有害副产物,并且成本较高,在大规模应用中受限[3-6]。吸附法具有处理成本低、操作简便、适用范围广、不产生二次污染等优点,适合实际大规模处理染料废水。吸附法处理染料废水的效果主要取决于吸附剂结构、表面形态,因此制备具有良好吸附性能的吸附剂是实现染料废水高效处理的关键[7]。石墨相氮化碳(g-C3N4)具有合适的禁带宽度和独特的类石墨相结构,广泛应用于光催化降解、能量转换与存储等领域[8-9],但g-C3N4表面缺乏官能团、比表面积较小,在吸附领域较少被关注。增加g-C3N4表面官能团和比表面积,提高吸附性能,对扩大g-C3N4应用领域具有重要意义。本实验通过三聚氰胺缩聚法和溶剂热法制备氧掺杂石墨相氮化碳(g-C3N4-O)吸附剂,并用XRD、FTIR、XPS、UV-Vis等进行表征,研究氧化处理对g-C3N4吸附性能的影响,并对吸附过程进行热力学、动力学研究。
1 实验
1.1 试剂与仪器
试剂:三聚氰胺、H2O2(35%)、甲基橙(分析纯,国药集团化学试剂有限公司),实验用水为自制去离子水。
仪器:LD4-2A台式低速离心机(常州杰博森仪器有限公司),TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司),D8型X射线粉末衍射仪(德国Bruker公司),1730傅里叶红外分光光度计(日本岛津公司),S-570扫描电子显微镜(日本日立公司),JEM-2100F型透射电子显微镜(日本电子株式会社),K-Alpha X射线光电子能谱仪(美国赛默飞世尔科技公司),BETA201A比表面及孔径分析仪(北京冠测精电仪器设备有限公司)。
1.2 g-C3N4-O的制备
采用三聚氰胺缩聚法制备g-C3N4吸附剂[10]:将10 g三聚氰胺粉末放入陶瓷坩埚中,在空气气氛下550 ℃煅烧4 h,自然冷却至室温,得到的黄色固体用玛瑙瓷研钵研磨成粉末,即g-C3N4吸附剂。
采用溶剂热法制备g-C3N4-O吸附剂:称取0.2 g g-C3N4分散于60 mL H2O2溶液中,然后25 ℃恒温搅拌30 min,转移到高压釜中120 ℃反应4 h,自然冷却至室温后取出,离心过滤,用去离子水清洗3次,得到g-C3N4-O吸附剂。
1.3 吸附实验
称取一定量吸附剂加入50 mL去离子水中,超声5 h使其分散均匀,加入40 mg甲基橙,得到初始质量浓度为0.8 mg/mL的染料废水溶液。将溶液置于遮光条件下进行吸附实验,每隔20 min离心一次,取上清液,用紫外-可见分光光度计测量最大吸收波长处的吸光度,根据标准曲线转换为对应的质量浓度,通过下式计算吸附率、吸附量:
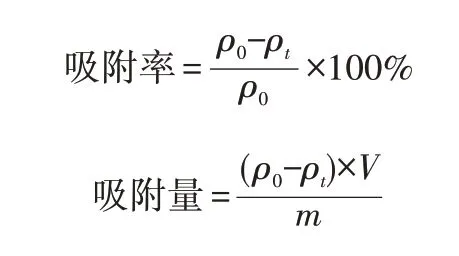
其中,ρ0为染料初始质量浓度;ρt为t时刻染料质量浓度;V为溶液体积;m为吸附剂质量。
2 结果与讨论
2.1 吸附剂的表征
g-C3N4和g-C3N4-O的XPS图谱见图1。

图1 g-C3N4(a)和g-C3N4-O(b)的XPS图谱
由图1可以看出,在g-C3N4和g-C3N4-O中均检测出C、N、O 3种元素,与g-C3N4相比,g-C3N4-O的氧含量明显增高,表明g-C3N4被氧化。
由图2可以看出,13.2°处的衍射峰对应g-C3N4中s-三嗪结构形成的平面(100)特征峰,27.3°处的强衍射峰对应g-C3N4的层间距(002)特征峰[11]。氧掺杂后,层间距(002)特征峰的位置由27.3°移动到27.6°,表明氧掺杂减小了g-C3N4的层间距,这是由于氧的引入增加了g-C3N4晶体内层的极性,增加了层间的分子间作用力。另外,g-C3N4-O的峰更尖锐,强度更高,且半峰宽明显小于g-C3N4,表明氧掺杂可以显著提高g-C3N4的结晶度。

图2 g-C3N4(a)和g-C3N4-O(b)的XRD图谱
由图3可知,g-C3N4在3 100~3 300 cm-1处出现较宽的吸收峰,表明存在由胺基引起的N—H伸缩振动带。1 200~1 650 cm-1处存在一系列吸收峰,对应杂环C—N伸缩振动,其中1 250、1 321、1 410和1 640 cm-1处的吸收峰分别对应CN杂环中NH—C2、N—C3、C—N和CN的伸缩振动,810 cm-1处的吸收峰对应3-s-三嗪环的伸缩振动[10]。g-C3N4-O的吸收峰与g-C3N4基本一致,表明氧化后依然保持共轭杂环结构。此外,g-C3N4-O在1 208 cm-1处出现一个新的吸收峰,对应C—O—C的伸缩振动[12]。
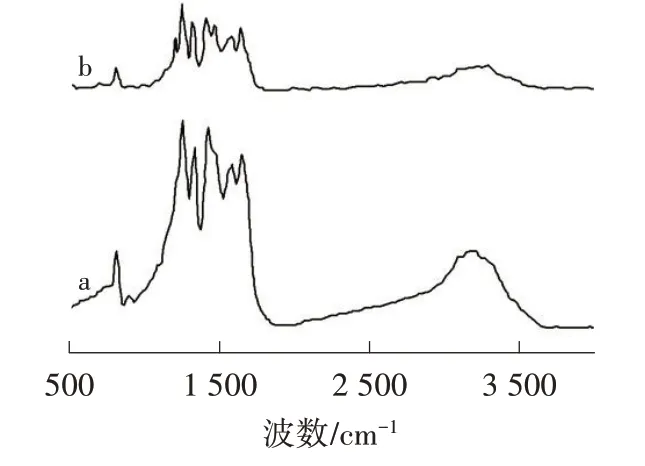
图3 g-C3N4(a)和g-C3N4-O(b)的FTIR
由图4可以看出,g-C3N4和g-C3N4-O均呈现Ⅳ型等温线,在较高的相对压力范围内存在滞后回线,表明g-C3N4和g-C3N4-O均为介孔结构,g-C3N4-O相比g-C3N4有更大的比表面积和孔容。

图4 g-C3N4和g-C3N4-O的等温吸附曲线
由图5可知,g-C3N4为微米级颗粒或分层结构,氧化后层状结构仍然保留,但横向尺寸减小,并出现大量孔洞[13]。

图5 g-C3N4(a)和g-C3N4-O(b)的SEM图
2.2 g-C3N4-O分散液的表征
在g-C3N4中引入含氧官能团可增加亲水性,改善分散液的稳定性,有利于其在染料废水处理中的实际应用。配制0.3 mg/mL的g-C3N4和g-C3N4-O分散液。由图6可以看出,g-C3N4和g-C3N4-O分散液在230、320 nm处出现主要特征峰,分别对应CN结构的π→π*转变和N孤电子对的n→π*转变[14]。
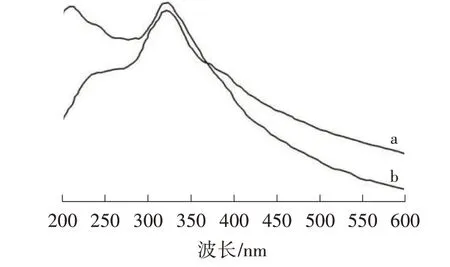
图6 g-C3N4(a)和g-C3N4-O(b)分散液的UV-Vis消光光谱
利用UV-Vis测试g-C3N4和g-C3N4-O分散液静置不同时间后上清液在320 nm处的光吸收强度,研究其稳定性,结果见图7。

图7 g-C3N4和g-C3N4-O分散液的沉降率
由图7可以看出,g-C3N4分散液静置后迅速沉淀,80 min后吸光度只有最初的19.7%,g-C3N4-O分散液80 min后的吸光度为最初的90.5%。静置400 min后,g-C3N4吸附剂几乎完全沉淀,而g-C3N4-O吸附剂仍有约50%分散在溶液中,表明g-C3N4-O具有更好的稳定性。
由图8可知,g-C3N4吸附剂为连续光滑的片状结构,横向尺寸为微米级;g-C3N4-O吸附剂为松散的纱状片层结构,存在大量孔洞。纱状片层结构有利于维持g-C3N4-O分散液的稳定性,增大吸附剂的比表面积,有利于提升对染料分子的吸附能力。

图8 g-C3N4(a)和g-C3N4-O(b)分散液的TEM图
2.3 g-C3N4-O的吸附能力
g-C3N4-O吸附剂在水中的分散性和稳定性较好,官能团较丰富,暴露面较大,是理想的水相分子吸附剂。由图9a可看出,在吸附甲基橙的过程中,g-C3N4迅速达到吸附-解吸平衡,对甲基橙的吸附率为18.2%;g-C3N4-O在前20 min快速吸附而后慢速吸附,120 min左右达到吸附-解吸平衡,吸附率为98.5%。由图9b可看出,当g-C3N4-O用量小于0.3 g/L时,随着吸附剂用量的增加,吸附率迅速增大,继续增加g-C3N4-O用量,吸附率增速减缓。

图9 吸附时间和吸附剂用量对吸附率的影响
2.4 吸附热力学和动力学
在恒温条件下,吸附剂对有机污染物的吸附平衡属于动态平衡,等温吸附模型主要有:
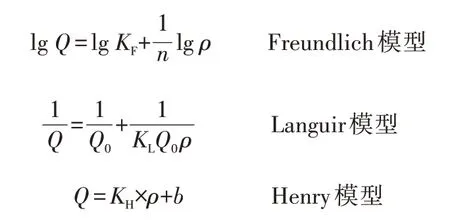
其中,Q为吸附量,mg/g;Q0为饱和吸附量,mg/g;ρ为吸附质的平衡质量浓度,mg/L;KF、n、KL、KH和b为常数。
由图10可知,g-C3N4-O对甲基橙的吸附行为比较符合Freundlich等温吸附模型,1/n=0.373<0.5,表明g-C3N4-O对甲基橙的吸附容易进行(对于Freundlich模型,1/n<0.5,表示吸附过程容易进行;1/n>2,表示吸附过程难以进行),属于优惠吸附,且可能以多相界面的化学吸附为主。

图10 g-C3N4-O吸附甲基橙的Freundlich、Langmuir以及Henry等温吸附曲线
采用准一级和准二级吸附速率方程进行吸附动力学研究,吸附动力学模型如下:

由图11可知,准二级模型的拟合相关系数R2为0.992,更接近1,因此g-C3N4-O对甲基橙的吸附更符合准二级动力学模型。
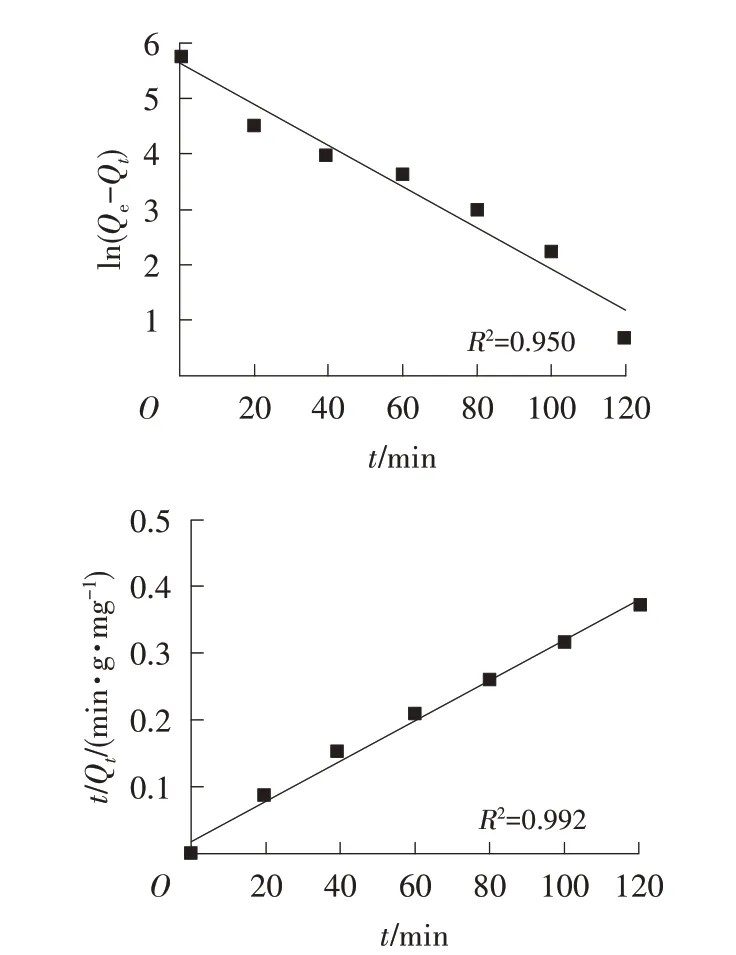
图11 g-C3N4-O吸附甲基橙的准一级、准二级动力学曲线
3 结论
(1)采用三聚氰胺缩聚法以及溶剂热法制备g-C3N4-O吸附剂,相比g-C3N4,g-C3N4-O吸附剂为含氧基团更多的介孔结构,具有更好的分散稳定性。
(2)与g-C3N4相比,g-C3N4-O吸附剂对甲基橙有更好的吸附效果,随着吸附剂用量的增加,吸附率逐渐增大,当g-C3N4-O吸附剂用量超过0.3 g/L后,吸附率变化较小。g-C3N4-O吸附甲基橙的过程符合准二级动力学模型、Freundlich热力学模型。
