LC-MS/MS测定果汁饮料中乳酸链球菌素
2021-02-01陈召桂杨晋青朱玲琳
陈召桂,杨晋青,朱玲琳
1. 浙江五芳斋实业股份有限公司(嘉兴 314031);2. 上海市质量监督检验技术研究院(上海 200233)
乳酸链球菌素(Nisin)是一种由部分乳酸乳球菌(Lactococcus lactis)或乳酸链球菌(Streptococcus uberis)菌株产生的一种阳离子多肽,能够有效抑制大多数革兰氏阳性细菌的生长。乳酸链球菌素作为一种新型天然的生物防腐剂,较之传统防腐剂苯甲酸钠、山梨酸钾、丙酸盐、富马酸二甲酯,具有效果好、用量少、对人和生物生存环境没有破坏和副作用等优点[1-4]。GB 2760—2014《食品安全国家标准食品添加剂使用标准》[5]规定乳酸链球菌素使用范围和最大使用量,在饮料(14.01包装饮用水除外)中的最大使用量为0.2 g/kg(固体饮料按冲调倍数增加使用量)。国内外对乳酸链球菌素的检测方法研究成果较少,目前主要是使用琼脂扩散法、酶联免疫吸附法、高效液相色谱法、高效液相色谱质谱法等[6-9]。这些检测方法各有优缺点,而高效液相色谱-串联质谱法具有溶剂用量小、分离效率高、检测灵敏度高、假阳性低等优势[10]。目前针对饮料中乳酸链球菌素的检测鲜有报道,故此次试验采用超高效液相色谱-串联质谱对果汁饮料中乳酸链球菌素进行检测,从而弥补这方面的空白,为乳酸链球菌素的检测方法标准的建立提供技术支撑。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
乙腈、甲醇(色谱纯,赛默飞世尔科技(中国)有限公司);乳酸链球菌素标准品(Sigma公司)。
乳酸链球菌素标准储备液(1.0 mg/mL):称取0.100 0 g乳酸链球菌素于100 mL容量瓶中,用含0.1%甲酸的20%乙腈水溶液溶解并定容至刻度,存放于4 ℃冰箱中备用。
乳酸链球菌素标准工作液:取1.0 mL乳酸链球菌素标准储备液,用含0.1%甲酸的20%乙腈水溶液溶剂稀释至1.0 mg/L,备用。
乳酸链球菌素标准工作曲线溶液:用含0.1%甲酸的20%乙腈水溶液稀释乳酸链球菌素标准工作液,使其质量浓度分别为100,80,50,20,10和5 μg/L。
1.1.2 仪器与设备
Agilent 1290液相色谱仪(美国安捷伦科技公司);AB SCIEX QTRAP®6500质谱仪(美国Sciex公司);TB-114型分析天平(Mettler Toledo公司);涡旋混合器(德国IKA公司);超声波清洗器(上海鲸德公司);高速离心机(Eppendorf公司)。
1.2 试验方法
1.2.1 液相色谱-串联质谱条件
色谱柱Agilent PLRPS-S C18(2.1 mm×150 mm,3.0 μm);流动相为0.1%甲酸水溶液和乙腈,梯度洗脱;流速为200 μL/min;柱温为30 ℃;进样体积为20 μL。
质谱条件:离子化方式,ESI;扫描方式,正离子扫描;检测方式,多反应监测(MRM);气帘气(CUR)10.0 psi;雾化气(GS1)40.0 psi;加热气(GS2)10.0 psi;喷雾电压(IS)5 000 V;去溶剂温度(TEM)400 ℃;去簇电压(DP)70 V;定量离子对m/z667.2/805.4,碰撞能(CE)20 eV;定性离子对m/z667.2/739.1,碰撞能(CE)20 eV。
1.2.2 样品前处理条件
准确称取5.00 g试样于50 mL离心管中,加入50.0 mL含0.1%甲酸的20%乙腈水溶液,涡旋1 min,超声5 min,以9 000 r/min离心1 min,上清液经0.22 μm滤膜过滤,滤液作为待测溶液。
2 结果与分析
2.1 质谱方法
使用10 μg/mL乳酸链球菌素标准溶液,通过流动注射泵进入质谱进行母离子和子离子扫描优化,得到乳酸链球菌素的母离子、子离子及碰撞能量等质谱采集参数,如表1所示,其中m/z667.2/805.4为定量离子。

表1 质谱采集参数
2.2 液相色谱方法
2.2.1 色谱柱选择
乳酸链球菌素属于大分子类物质,色谱柱的大小、颗粒形状及粒径、颗粒表面积、孔径、封端技术等对其分离度有决定性影响,因此选择实验室常用XDB-C18、SB-C18、PLRPS-S-C18等色谱柱对乳酸链球菌素标准品进行分离研究,以便找出合适的色谱柱。最终发现PLRPS-S-C18柱效高、选择性好、分析速度快,因此将其作为乳酸链球菌素的检测。
就国内其它行业成功实施案例分析来看,为了在当下的环境下更好地生存与发展,充分地利用了信息化和移动化的技术手段,并引入了先进的JIT(准时至)的管理理念,对铁路企业审批业务环节上进行了改革性的创新和应用,让审批业务由线下操作成功的转型到线上操作,不仅大大提高了工作的效率,同时也节约了大量的时间成本和资源的消耗,取得很好的应用效果。具体效果体现在以下几个方面:
2.2.2 流动相的选择
流动相的种类及配比直接影响组分的分离,因此需要对流动相组成选择进行优化。因Nisin易溶于水,极性较强,质谱电离时带多个正电荷,故选择有机相-甲酸水体系作为流动相。使用100 ng/mL的乳酸链球菌素标准溶液进行液相色谱方法优化,分别选择甲醇-质量分数0.1%甲酸水和乙腈-质量分数0.1%甲酸水作为流动相进行梯度洗脱,洗脱梯度条件如表2所示。其中A相为质量分数0.1%的甲酸水溶液,B相为有机相,比较发现使用乙腈-质量分数0.1%甲酸水作为流动相时,洗脱能力好,质谱响应高且色谱峰较窄,故选择乙腈-质量分数0.1%的甲酸水溶液作为乳酸链球菌素检测的流动相。色谱图如图1所示。

表2 梯度洗脱条件
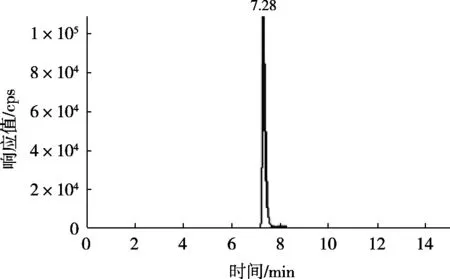
图1 乙腈-0.1%甲酸水的梯度洗脱色谱图
2.3 样品前处理方法
2.3.1 提取溶剂的选择
由于乳酸链球菌素易溶于水,并且溶解度随着pH的降低而显著增加,不能完全溶解于纯的甲醇、乙腈等有机溶剂,所以选择水、乙腈水溶液、含0.1%甲酸的乙腈水溶液分别作为提取溶剂,考察这3种不同提取溶剂对果汁饮料中乳酸链球菌素的提取效果。试验选取苹果汁饮料为基质样品,称取5.0 g试样并向其中加入500 μg/kg的乳酸链球菌素标准品,分别选用水、20%乙腈水溶液、含0.1%甲酸的20%乙腈水溶液作为提取溶剂,然后对其进行超声提取(提取相同时间),重复测定6次,考察提取效率,结果见表3。
3种提取溶剂均能提取饮料中乳酸链球菌素。水对乳酸链球菌素提取效率较差,含0.1%甲酸的20%乙腈水溶液提取效率明显较高,而且纯水难以过滤上机,存在杂质难以沉淀的问题,不便于前处理过程;含0.1%甲酸的20%乙腈水溶液明显高于乙腈水溶液,而且考察到乳酸链球菌素在低pH下的溶解度较好,因此选择含0.1%甲酸的20%乙腈水溶液作为最终的提取溶剂。

表3 不同提取溶剂对果汁饮料中乳酸链球菌素的提取效率
2.3.2 超声时间和温度的选择
超声提取时间是对测定结果影响较大的因素之一,因此选取不同的超声时间进行试验。分别选取5,10,15,20和30 min,在相同条件下进行分析测定,结果见表4。结果表明,随着超声提取时间的延长,提取效果提高不明显。由于样品是可溶性液体类饮料,乳酸链球菌素基本溶解在其中,只需满足基质效应低的提取溶剂下提取,故选择超声提取时间10 min。

表4 不同提取时间对果汁饮料中乳酸链球菌素的提取效率
2.3.3 线性范围与检出限
分别取20 μL质量浓度为100,80,50,20,10和5 μg/L乳酸链球菌素标准液,按上述色谱-质谱条件进行分析。以相应的色谱峰面积(y)为纵坐标、待测组分的质量浓度x(μg/L)为横坐标,绘制标准工作曲线,经线性回归求得相关系数,结果见表3。结果表明待测组分在该浓度范围内均具有良好的线性关系。
检出限定义:响应信号为噪音的3倍(S=3N)时所需的样品量;定量限定义:响应值为10倍基线噪音时所需的样品量。当取样量为5.0 g时,将一定浓度的乳酸链球菌素标准样品添加在空白基质样品中,定容体积为50.0 mL,在相同检测条件下进样6针,按检出限的定义分析数据,结果如表6所示。乳酸链球菌素的检出限为20 μg/kg,定量限为50 μg/kg。

表5 线性范围
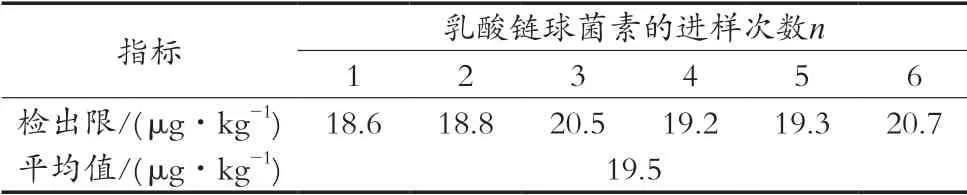
表6 检出限结果
2.3.4 方法回收率和精密度
选取阴性空白样品基质(苹果果汁),分别添加低、中、高3个浓度水平(50,100和500 μg/kg),每一个添加水平重复测定6次,其回收率和精密度结果如表7所示。可以看出,回收率在79.5%~111.5%之间,且相对标准偏差(RSD)<10%,能够满足试验要求。

表7 回收率和精密度试验结果(n=6)
2.3.5 市售样品分析
采集30个市售果汁饮料样品,按照样品处理方法对样品进行处理,根据仪器分析方法,对样品中的乳酸链球菌素上机分析,样品中均未检出乳酸链球菌素,可能是由于乳酸链球菌素较化学防腐剂价格较贵等原因,在果汁饮料领域使用较少。
3 结论
通过优化色谱条件和质谱条件,选择合适的提取溶溶液类型以及相应体积,建立LC-MS/MS测定果汁饮料中乳酸链球菌素含量的检测方法。该方法灵敏、准确、专一性强,适用于果汁饮料中乳酸链球菌素的定性与定量检测,可为果汁饮料中超限量使用添加剂提供有力的技术支撑,也为拓展到其他食品中乳酸链球菌素的检测提供理论基础。
