免疫分子MHC-Ⅰ在小鼠不同脑区的分布
2021-02-01李慧萍
李慧萍 徐 秀
(复旦大学附属儿科医院儿童保健科 上海 201102)
由于血脑屏障的存在,中枢神经系统一直被认为是一个“免疫豁免器官”。近年来越来越多的研究发现免疫系统在神经发育及认知、社交功能中发挥调控作用[1]。多种免疫相关分子与哺乳动物大脑发育和功能有关[2]。
主要组织相容性复合物(major histocompatibility complex,MHC)是一组高度多态性、紧密连锁的基因簇,在脊椎动物中编码蛋白参与免疫应答。MHCⅠ类分子(MHC classⅠ molecule,MHC-Ⅰ)特异性表达于有核细胞表面,提呈细胞内抗原给特定的细胞毒性淋巴细胞及自然杀伤细胞介导免疫应答[3]。MHC-Ⅰ具有异三聚体结构,由1条跨膜重链、1条非共价附加的β-2-微球蛋白亚单位(β2m)及1条8~15个氨基酸的短肽(主要用于区分自身蛋白或外来蛋白)组成[4]。MHC-Ⅰ在不同细胞类型中表达水平有所差异[3]。由于中枢神经系统中极少见淋巴细胞及自然杀伤细胞,大脑被认为缺乏MHC-Ⅰ表达[5-6]。但是动物实验发现,MHC-Ⅰ在神经元中表达[7-8],并参与突触形成、重构、可塑性等与免疫应答完全无关的生理过程[9-12],MHC-Ⅰ调节活性依赖的视觉投射修剪,负向调节神经元突触密度,并且在海马依赖的记忆以及NMDAR门控依赖的海马LTD中发挥重要作用[11]。
已知MHC-Ⅰ分子表达于神经细胞,但是其在脑中不同脑区的分布情况尚不清楚。本研究运用OX-18抗体标记成年野生型小鼠脑片,从不同脑区观察MHC-Ⅰ蛋白分布情况,以深入了解MHC-Ⅰ在中枢神经系统中的表达谱。
材料和方法
实验动物C57BL/6J小鼠购自上海斯莱克实验动物有限责任公司,联合免疫缺陷(severe combined immuno-deficiency,SCID)小鼠购自美国Jackson实验室。动物均在清洁标准环境饲养,12 h/12 h光暗周期。实验操作符合复旦大学附属儿科医院伦理委员会对动物实验伦理的要求。
免疫荧光染色组织制备出生后2月龄小鼠用过量12%水合氯醛处死,打开胸腔,从心脏灌流预冷的0.1 mol/L PBS,然后灌流4%PFA固定。打开颅骨,分离出小鼠全脑,4℃下浸没于4%多聚甲醛(paraformaldehyde,PFA),固定4 h。同样在4℃下分别使用15%及30%蔗糖溶液梯度脱水48 h,直至组织沉底。组织脱水后吸干表面液体,低温包埋于OCT(日本Sakura公司)。使用德国LEICA公司冰冻切片机,冠状切片,切片厚度为40μm,切片漂浮保存于4℃0.1 mol/L PBS中,用于免疫荧光染色。
免疫荧光染色取3~4片脑片于24孔板中,用PBS清洗3次,去除多余的PFA及OCT。使用含5% 牛血清蛋白(bull serum albumin,BSA)、0.2%Triton X-100和0.1%Tween20的PBS溶液作为封闭液,在室温环境下封闭1 h。标记一抗:去除封闭液,加入相应的一抗,按照抗体要求浓度稀释于封闭液中。一抗使用小鼠来源OX-18抗体(1∶500,英国AbDSerotec公司)及兔源Alex Fluor 647-NeuN抗体(1∶500,英国Abcam公司)。4℃孵育过夜,PBS漂洗3次,每次15 min。荧光标记二抗,室温下避光孵育1.5 h,根据一抗来源确定抗体特异性。细胞核使用二脒基苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)(美国Sigma公司)标记,PBS漂洗3次,每次15 min。然后贴片,待组织微干,使用封片液封片。
图像采集及分析图像采集使用德国Leica公司TCS SP8型共聚焦显微镜。图像分析使用FIJI软件(美国国家卫生研究院)。小鼠脑区分布参考Allen小鼠脑图谱(Allen Mouse Brain Atlas)。
结 果
MHC-I分子在各脑区分布广泛小鼠大脑冠状切面染色如图1所示,分别为2月龄野生型小鼠(图1A)和相应月龄SCID小鼠(图1B)。野生型小鼠MHC-Ⅰ阳性细胞广泛分布于大脑皮层、海马、丘脑、下丘脑、杏仁核等脑区,但不同脑区蛋白表达水平不同,同一脑区中不同细胞间MHC-Ⅰ表达水平也不相同。B细胞、T细胞均缺失的SCID小鼠中,MHC-Ⅰ同样在大脑各脑区分布,与野生型小鼠基本相仿。
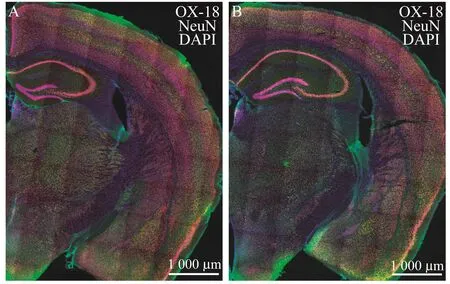
图1 MHC-Ⅰ在小鼠大脑广泛表达Fig 1 MHC-Ⅰwildly expressed in the brains of mice
初级躯体感觉皮层MHC-Ⅰ表达模式野生型小鼠初级躯体感觉皮层MHC-Ⅰ染色如图2所示,距Bregma点-1.70 mm,距中线1 mm左右。MHC-Ⅰ集中分布于2/3层、5层神经元胞体,4层部分神经元胞体表达MHC-Ⅰ,而6层神经元仅有少量神经元细胞高表达MHC-Ⅰ,并可见MHC-Ⅰ表达延伸至树突及树突末梢(1层)。
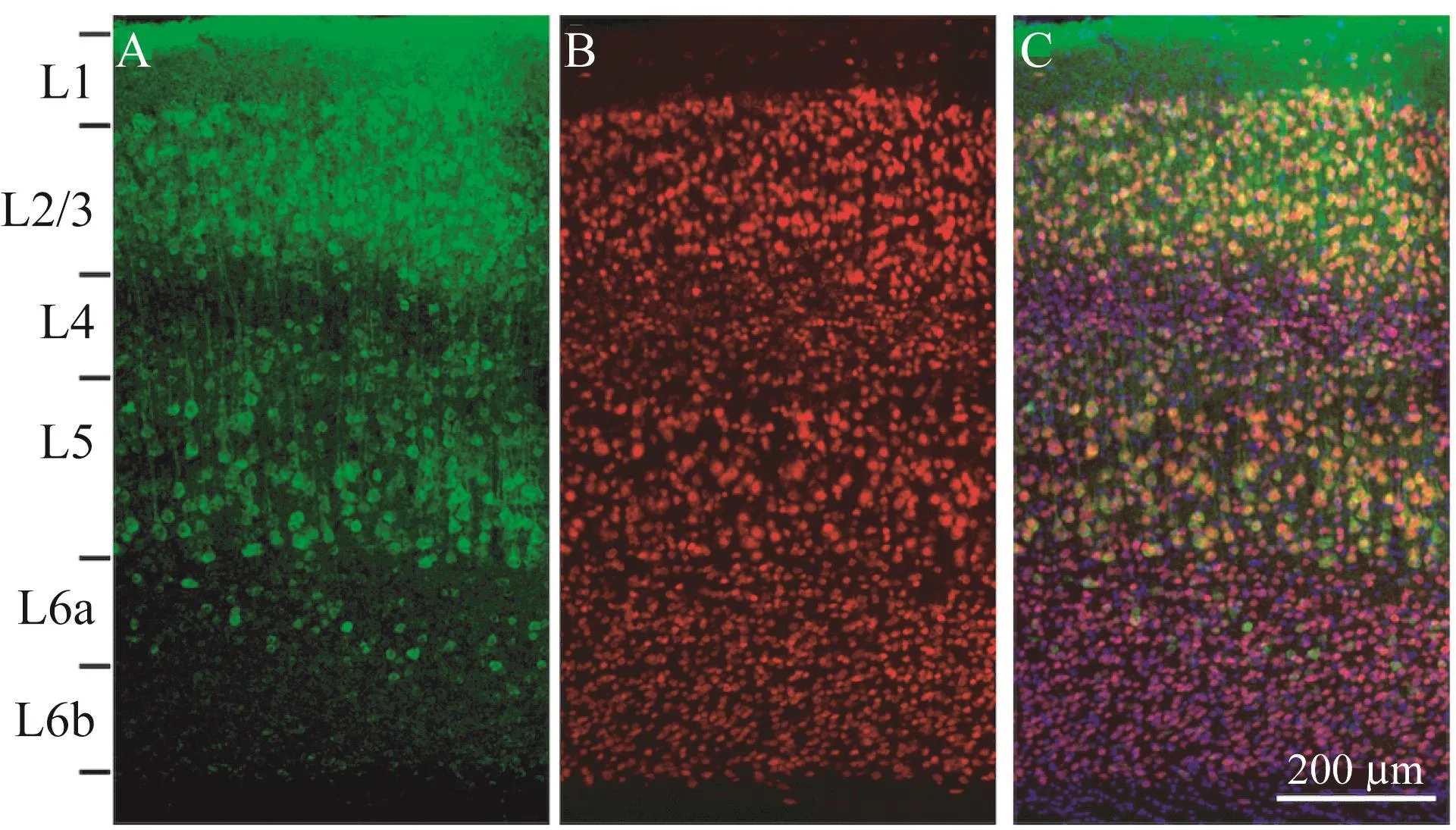
图2 MHC-I阳性细胞在野生型小鼠初级躯体感觉皮层的分布Fig 2 The expression pattern of MHC-Ipositive cells in primary somatosensory cortex of wild-type mice
海马MHC-Ⅰ表达模式从野生型小鼠的冠状切面海马来看,在齿状回(dentate gyrus,DG)、海马角1(cornuammonis 1,CA 1)、CA 2、CA 3颗粒细胞层及锥体细胞层MHC-Ⅰ表达水平均不高。许多散在分布的神经元核特异性标记(NeuN)阳性细胞高表达MHC-Ⅰ(图 3)。
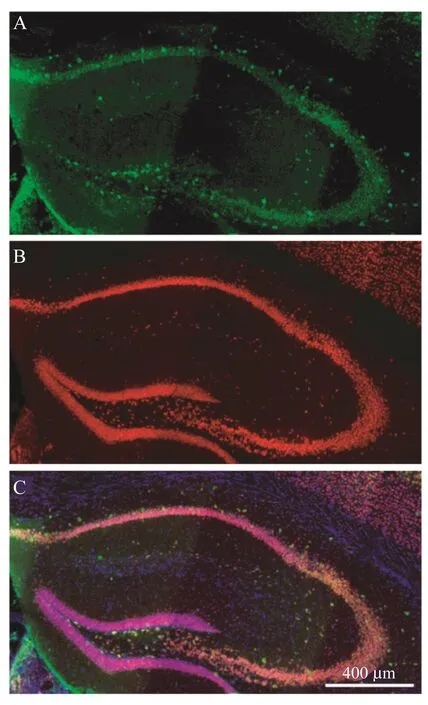
图3 MHC-I高表达神经元在野生型小鼠海马中散在分布Fig 3 MHC-Ihighly expressed neurons scattered in the hippocampus of wild-type mice
杏仁核MHC-Ⅰ表达模式MHC-Ⅰ高表达神经元特异性聚集于底外侧杏仁核前部(basolateral amygdala nucleus,anterior part,BLAa),而在相邻的外侧杏仁核(lateral amygdalar nucleus,LA)及底外侧杏仁核后部(basolateral amygdalar nucleus,posterior part,BLAp)仅有少量细胞低表达MHC-Ⅰ(图4)。
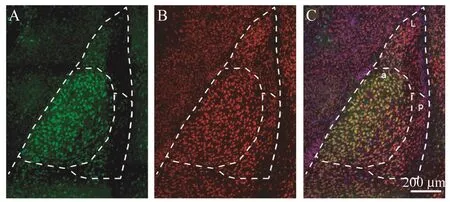
图4 野生型小鼠底外侧杏仁核前部MHC-I阳性神经元密度高Fig 4 The density of MHC-Ipositive neurons was high in the basolateral amygdala nucleus,anterior part(BLAa)of wild-type mice
MHC-Ⅰ在中脑、丘脑核团高表达距Bregma点-2.8 mm的小鼠大脑切面(图5)可见:在中脑位置的 环 状 核(nucleus circularis,NC)、后 连 合 核(nucleus of the posterior commissure,NPC)、运动相关上丘,灰质间层,b亚层(superior colliculus,motor related,intermediate gray layer,sublayer b,SCig-b)、顶盖前核(anterior pretectal nucleus,APN)、黑质网状 带(substantia nigrareticular parts,SNr)高 表 达MHC-Ⅰ;在部分丘脑结构中,外侧膝状体背部(dorsal part of the lateral geniculate complex,LGd)、外侧膝状体腹部(ventral part of the lateral geniculate complex,LGv)、内 侧 膝 状 体(medial geniculate complex,MG)高表达 MHC-Ⅰ。
讨 论
本文检测了MHC-Ⅰ在小鼠大脑中的分布情况。结果表明,MHC-Ⅰ在大脑分布非常广泛,各个脑区均可见到在不同神经元细胞间的非均匀分布。
OX-18是一种特异性单克隆小鼠抗体,多篇文献曾报道OX-18抗体用于检测MHC-Ⅰ表达水平[13],OX-18 抗体抗 MHC-Ⅰ RT 1A 的胞外段 α3 结构域在多种MHC-Ⅰ变体中保守结构稳定,一直以来被用于免疫亲合纯化、免疫染色等检测MHC-Ⅰ分子。OX-18抗体可以特异性识别非神经组织MHC-Ⅰ蛋白,也可以识别中枢神经系统MHC-Ⅰ。已有研究使用OX-18抗体检测MHC-Ⅰ蛋白在大鼠视皮层中的表达情况[13]:在出生7天后的大鼠中,MHC-Ⅰ在视皮层5层高表达,浅层表达水平低,6层基本无表达。在年纪较大的动物中,MHC-Ⅰ在整个浅层大脑皮层分布,但在6层表达水平仍较低[13]。孕中期小鼠大脑中同样检测到MHC-Ⅰ蛋白表达于胚胎期神经元及神经前体细胞[14]。本研究中大脑皮层 MHC-Ⅰ染色结果与 Needleman 等[13]的视皮层染色结果基本一致,外侧膝状体也与Corriveau等[15]报道的该部位神经元高表达MHC-Ⅰ相一致,说明MHC-Ⅰ染色准确可信。

图5 MHC-I阳性神经元在野生型小鼠中脑和丘脑部分核团中聚集性分布Fig 5 MHC-I selectively high-expressed in the nucleiof midbrain and thalamusof wild-type mice
MHC-Ⅰ被认为参与神经元突触形态和功能调控,与神经环路形成有关,且在SCID小鼠神经元中的表达分布与普通小鼠基本相仿。为什么在不同的神经元中会出现如此明显的表达差异?哪些神经元需要更高的 MHC-Ⅰ水平?Needleman 等[13]认为,神经元具有MHC-Ⅰ储存库作用,当神经突触需要修剪时,MHC-Ⅰ可被运输表达于神经元突触前膜及后膜,而当突触修剪减少时MHC-Ⅰ回流至胞体储存。按照该理论,本研究MHC-Ⅰ高染色的神经元为突触修剪较少的神经元,但目前尚无充足的实验证实该假设。有文献报道MHC-Ⅰ受到神经元活化钙信号调控[15-17]。外侧膝状体(lateral geniculate nuclei,LGN)灌注河豚毒素(tetrodotoxin,TTX)降低神经兴奋性,局部MHC-ⅠmRNA水平降低。通过单眼注射TTX下调视网膜膝状体活性,也可以下调 LGN MHC-Ⅰ mRNA 水平[15]。然而,在神经元激活即刻MHC-Ⅰ与早期基因c-fos共染实验中,MHC-Ⅰ与c-fos并不完全共定位。参考海马区域GABA能神经元分布及形态特征研究[18],在海马区域MHC-Ⅰ高表达的神经元从分布及形态来看是GABA能神经元。此外,黑质是大脑皮层直接或间接通过纹状体与网状结构发生联系的中间站,分为背侧的致密带和腹侧的网状带,致密带细胞富含黑色素颗粒,能合成多巴胺,而网状带主要为GABA能神经元[19]。从染色来看,网状带可见的神经元均为MHC-Ⅰ阳性,而致密带多巴胺能神经元均MHC-Ⅰ阴性。我们猜测MHC-Ⅰ更倾向于在GABA能神经元中表达。但杏仁核中,MHC-Ⅰ阳性神经元高度集中于BLAa。BLA参与恐惧记忆及成瘾的行为过程[20],包括 LA、BLAa、BLAp。BLAa有靶向特异性投射神经元,这些神经元胞体及树突形态互不相同。该区域GABA能神经元占比据估计在10%~15%,显然低于被染色的MHC-Ⅰ阳性神经元比率。而LA、BLAp区域的GABA能神经元未见同样MHC-Ⅰ染色。因此GABA能神经元高表达MHC-Ⅰ并不能解释MHC-Ⅰ表达特点。躯体感觉皮层染色来看也可见到有一批MHC-Ⅰ阳性神经元为椎体神经元。
MHC-Ⅰ在中枢神经系统表达不仅在发育中存在并发挥作用[11],而且在成年期大脑中同样表达。已知MHC-Ⅰ表达异常参与孤独症谱系障碍、帕金森症等神经精神疾病进程[21-23]。研究发现MHC-Ⅰ在大脑多数脑区表达,但仅局限于脑区中的部分神经元,MHC-Ⅰ选择性表达的因素尚不明确,深入探究其决定因素对了解MHC-Ⅰ在中枢神经元中的作用具有重要意义,可能为理解孤独症谱系障碍、帕金森症等难治性神经精神疾病提供帮助。
致谢Jonathan kipms教授及付忠孝博士给予建议及指导。
作者贡献声明李慧萍 完成实验,分析数据,撰写论文。徐秀 研究构思,论文修订。
利益冲突声明所有作者均声明不存在利益冲突。
