组蛋白脱乙酰酶2-核转录因子-κB/激活蛋白-1介导的重度哮喘对糖皮质激素不敏感的分子机制
2021-02-01邹依宁闵智慧曾瑜真毛若琳姜志龙陈智鸿
邓 至 邹依宁 毕 晶 闵智慧 曾瑜真 毛若琳 姜志龙 陈智鸿△
(1复旦大学附属中山医院急诊科,2病理科,3呼吸科,4实验研究中心 上海 200032)
哮喘是最常见的呼吸系统慢性疾病,影响全球3.6亿人口,患病率约为12.6%,每年导致至少40万人死亡[1],中国约有三千万哮喘患者[2]。糖皮质激素(glucocorticoid,GC)是治疗哮喘的一线药物,大部分患者正规使用吸入糖皮质激素(inhaled corticosteroid,ICS)能达到疾病控制效果[3]。然而,有5%~10%的患者在使用高剂量ICS或长期口服GC情况下仍有哮喘的持续症状,这些患者被归为重度哮喘或难治性哮喘,其病情控制一直是哮喘治疗的难题[4-5]。
GC因其强大的抗炎作用,在慢性气道炎性疾病的治疗中占据重要地位。抗炎作用的发挥主要通过糖皮质激素受体(glucocorticoid receptor,GR)介导。GC穿过细胞膜并与细胞质中的GR结合,使GR构象发生改变并与热休克蛋白90(heat shock protein 90,HSP90)解离,GR随之磷酸化,从而暴露核定位信号而转入细胞核。在细胞核内,GR通过直接基因调控和间接基因调控调节靶基因转录,发挥抗炎作用。直接基因调控主要依赖GR形成同二聚体并结合抗炎基因启动子区的糖皮质激素反应元件(glucocorticoid response element,GRE),促进组蛋白脱乙酰酶(histone deacetylase,HDAC)的结合,从而增加抗炎基因转录;间接基因调控主要是通过活化的GR结合HDAC等抑制因子而发生去乙酰化,从而与核因子-κB(nuclear transcription factorkappa B,NF-κB)和激活蛋白-1(activating protein,AP-1)等促炎基因转录因子形成复合物,并使之失活,最终减少促炎基因的表达[6-7]。在哮喘中,GC主要通过间接基因调控作用发挥抗炎效应。
近年来诸多研究致力于探讨重度哮喘对激素敏感性下降的机制,包括炎性转录因子的过度表达,组蛋白乙酰化异常,免疫介导的细胞因子的失调,GR的结合活性及核转移降低等[8-10],从GC/GR及HDAC角度研究的并不多见。本研究以健康对照者、轻中度哮喘者及重症哮喘者为对象,对比其外周血单个核细胞(peripheral blood molecule cells,PBMCs)中GR的表达量、核转运功能、HDAC2活性及转录因子NF-κB、AP-1的激活情况,研究重度哮喘患者对GC敏感性下降的发生机制,为寻求重度哮喘治疗新靶点和新方法提供科学依据。
资料和方法
研究对象招募来自复旦大学附属中山医院呼吸科的12名轻中度哮喘患者,10名重度哮喘患者和12名健康对照者(表1)。根据全球支气管哮喘防治创议(Global Initiative for Asthma,GINA)标准,将重度哮喘的定义为需要使用大剂量的药物以维持良好的症状控制或即使在使用高剂量药物治疗下,仍有哮喘的持续症状、急性发作或气流阻塞。哮喘的诊断也符合GINA的诊断标准[11]。排除标准包括吸烟史、慢性阻塞性肺病、支气管扩张症、肺纤维化和遗传性激素缺乏者。健康对照均无过敏性疾病病史。
所有受试者均告知研究目的及实验程序,并签署知情同意书。本研究经复旦大学附属中山医院医学伦理委员会批准(批号:B2014-108)。
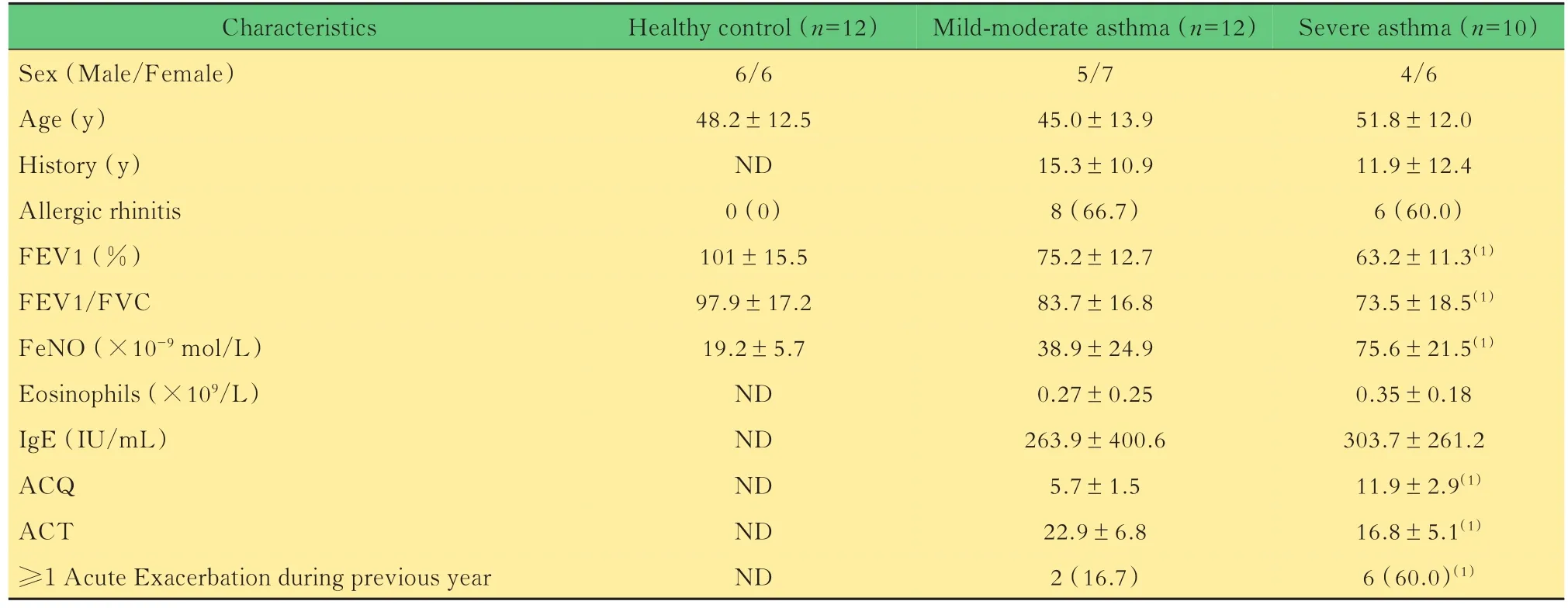
表1 研究对象的基本信息Tab 1 Baseline characteristics of research subjects [Mean±SD or n(%)]
主要试剂和抗体使用以下试剂:地塞米松(dexamethasone,Dex)和 TNF-α(英国 Sigma公司),HDAC2 Assay Kit(美国Abnova公司)。使用以下抗体:山羊抗兔抗体、抗GRa抗体(英国Abcam公司),NF-κB磷酸化抗体、c-Jun磷酸化抗体和c-Fos磷酸化抗体(美国Cell signaling Technology公司)。
PBMCs的分离与培养上午6~9点间抽取受试者外周静脉血15 mL(10%EDAT抗凝),用Histopaque 1077试剂(美国Sigma-Aldrich公司)按照说明书步骤分离PBMCs。获取的各组PBMCs在含有10%胎牛血清和1%抗生素(青霉素100 U/mL,链霉素100μg/mL)的1640培养液中进行培养。
各组PBMCs的刺激与处理(1)按时间梯度:0.01 ng/mL TNF-α预处理各组PBMCs,然后分别在1、2、4、6 h用0.1 μmol/L Dex处理,孵育过夜后收集上清液。(2)按浓度梯度:在各组PBMCs中分别用不同浓度的地塞米松(0.01、0.1、1、10μmol/L)或PBS预处理(空白对照组)4 h,然后用0.01 ng/mL TNF-α刺激,孵育24 h后收集上清液。
ELISA检测按照ELISA试剂盒(美国R&D公司)说明书步骤测定上清液中IL-8的浓度。
Western blot检测将上述处理过的细胞在RIPA缓冲液中裂解,并提取总蛋白。然后将样品进行SDS-PAGE凝胶电泳,将蛋白质转移至PVDF膜,以脱脂奶粉封闭后滴加第一抗体(兔抗GR、兔抗GRα、Py-NF-κB,Py-c-FOS,Py-c-JUN或GAPDH),在 4 ℃下孵育过夜(1∶2 000稀释)。然后将膜与山羊抗兔二抗(1∶10 000稀释)一起温育,并使用化学发光系统进行检测,分析总GR/GRα蛋白质水平及磷酸化的转录因子水平。以GAPDH用作蛋白质标准化的内参,使用Vision Works LS 6.3.3软件进行蛋白表达的相对定量。
免疫荧光将各组受试者的PBMCs用1μmol/L的Dex分别处理0、1、2 h后提取细胞并固定涂片,加入一抗4℃过夜,次日复温后加入二抗孵育2 h,再加入DAPI染液染色后清洗封片,用共聚焦显微镜检测和观察GRα的核内转运情况。
HDAC2活力检测使用细胞核抽提试剂盒(美国Epigenteck公司)提取核蛋白,并根据说明书使用HDAC2 Assay kit分析每组PBMCs样品中HDAC2的活力。
统计学分析采用SPSS 21.0软件进行统计学分析,数据以表示。首先使用单因素方差分析(ANOVA)对所有组进行统计分析,然后使用t检验比较组间差异的统计学意义。P<0.05为差异具有统计学意义。
结 果
重度哮喘患者PBMCs在TNFα诱导IL-8释放实验中表现出对Dex敏感性下降在时间依赖实验中,当用TNF-α对PBMCs进行孵育后,分别于 1、2、4、6 h后加入Dex,结果显示Dex能抑制健康对照组IL-8的释放,轻中度哮喘组在1 h时间点IL-8释放受抑制,而后续时间点Dex抑制程度明显下降。重度哮喘组Dex对IL-8的释放抑制作用在每个时间点均下降,且Dex加入时间越晚,抑制效果越弱(图1A)。在剂量依赖实验中,用0.1、1、10μmol/L不同浓度的Dex孵育PBMCs,再加入TNF-α诱导IL-8释放。随着Dex浓度的逐渐升高,各组抑制IL-8释放的作用均逐渐增加,但重度哮喘组IL-8的释放量较健康对照组和轻中度哮喘组高(图1B)。该结果表明,重度哮喘患者PBMCs在TNFα诱导IL-8释放实验中表现出对Dex敏感性下降。
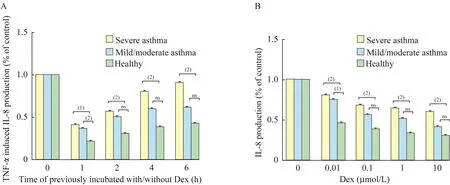
图1 TNFα诱导IL-8释放实验测定PBMCs对Dex的敏感性Fig 1 Dex sensitivity in TNF-α-induced IL-8 production of PBMCs
重度哮喘PBMCs的GR在Dex作用下的产生量及核内转运情况为进一步研究哮喘患者对GC不敏感的机制,用Western blot法测定健康对照组、轻中度哮喘组、重度哮喘组的PBMCs中总GR蛋白质水平,发现随病情严重程度加强,细胞总GR蛋白质水平表现出明显的代偿趋势(图2)。在Dex诱导GRα水平的实验中,加入不同浓度Dex后,各组GRα水平均有增加。在健康对照组和轻中度哮喘组,Dex 1μmol/L时GRα水平明显增高,且轻中度哮喘组显示出良好的剂量效应关系,而重度哮喘组在Dex 1μmol/L时仍未见明显诱导GRα水平增高(图3)。为继续了解GRα的核定位是否与重症哮喘患者对GC不敏感有关,将3组患者的PBMCs加入Dex处理,于0、1、2 h分别用共聚焦显微镜动态观察,测定核内GRα免疫荧光强度。结果显示在加入Dex前,GRα主要分布在细胞质中,加入Dex处理后,健康对照和轻中度哮喘组核内GRα免疫荧光强度随Dex作用时间呈递增趋势,尤其在2 h处均较空白对照明显增强;而重症哮喘组核内GRα免疫荧光强度随Dex作用时间增加未见明显递增现象,1 h和2 h处的荧光强度与对照组相比无明显上升(图4)。
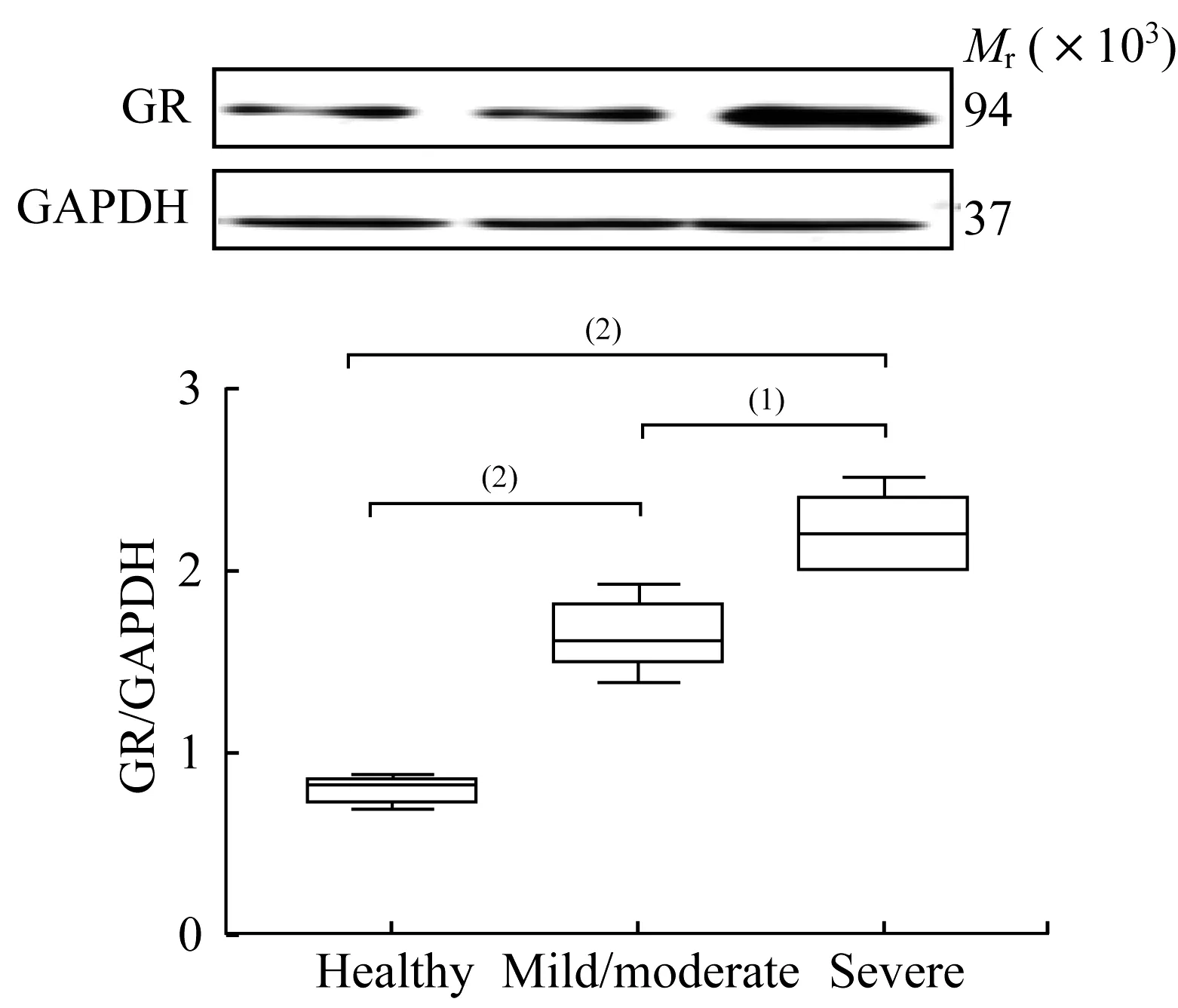
图2 Western bolt检测PBMCs中GR的表达量Fig 2 GR expression in PBMCs detected by Western bolt
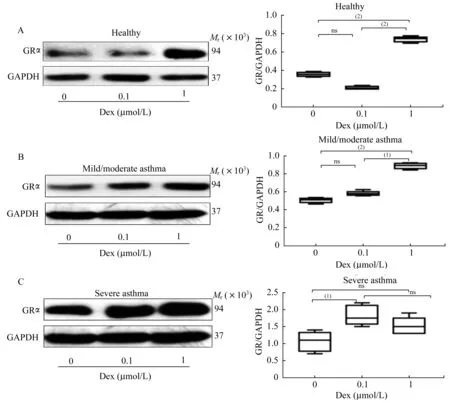
图3 Dex诱导PBMCs中GR蛋白质水平的升高Fig 3 GR expression was induced by Dex in PBMCs
重度哮喘PBMCs核蛋白HDAC2活力下降分别提取健康对照者、轻中度哮喘及重度哮喘患者PBMCs的核蛋白,并测定各组核蛋白中HDAC2的活力。研究发现,轻中度哮喘较健康对照HDAC2活力轻度降低,但差异尚无统计学意义;而重度哮喘PBMCs核蛋白中HDAC2活力较健康对照组明显降低(图5)。
重度哮喘PBMCs中促炎基因转录因子激活我们用Western blot法半定量地测定了磷酸化的NF-κB及AP-1二聚体的亚基c-Fos、c-Jun。结果表明,py-NF-κB、py-c-Fos、py-c-Jun水平在健康对照、轻中度哮喘和重度哮喘中依次升高,轻中度哮喘与健康对照相比有增高趋势,但差异无统计学意义,而重度哮喘 PBMCs中 NF-κB、c-Fos、c-Jun的磷酸化水平明显增加(图6)。
讨 论
重度哮喘患者占哮喘患者总人数的5%~10%,占比虽然小,但因其对大剂量、全身使用激素的依赖甚至激素抵抗,57.2%的重度哮喘患者病情未能得到有效控制[4]。重度哮喘导致的慢性小气道炎症具有异质性,由中性粒细胞、嗜酸性粒细胞等炎症细胞及多种细胞因子参与,诱导痰中的嗜酸性粒细胞及中性粒细胞高于轻中度患者[10]。白细胞介素-8(interleukin-8,IL-8)是中性粒细胞的重要趋化因子,主要来源于人PBMCs和内皮细胞,并在脂多糖和TNF-α等的诱导下合成和释放[12]。重度哮喘患者PBMCs中出现IL-8的高表达常预示哮喘控制不良,而糖皮质激素可通过GC-GR复合物与GRE的结合直接抑制IL-8的基因转录。因此,本研究在体外观察糖皮质激素对TNF-α诱导的IL-8的动态抑制作用,以评价糖皮质激素的反应性。我们的研究发现在重度哮喘患者的PBMCs中,无论在时序上还是不同浓度Dex处理下,GC对IL-8释放的抑制作用始终低于轻中度患者及健康对照者,证实哮喘患者外周血对GC的敏感性降低,且下降程度与哮喘的严重程度呈正相关,因此我们猜想这种累及全身的效应或与GC-GR复合物的功能状态相关。
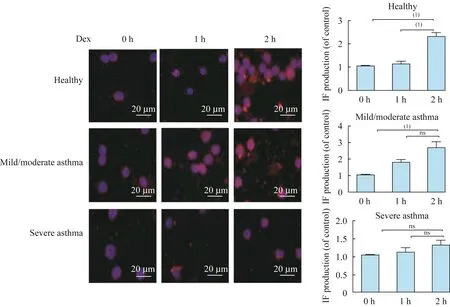
图4 免疫荧光法检测地塞米松处理下GRα的动态入核情况Fig 4 Dex-induced GRαtransnuleus activity assessed by immunofluorescent staining
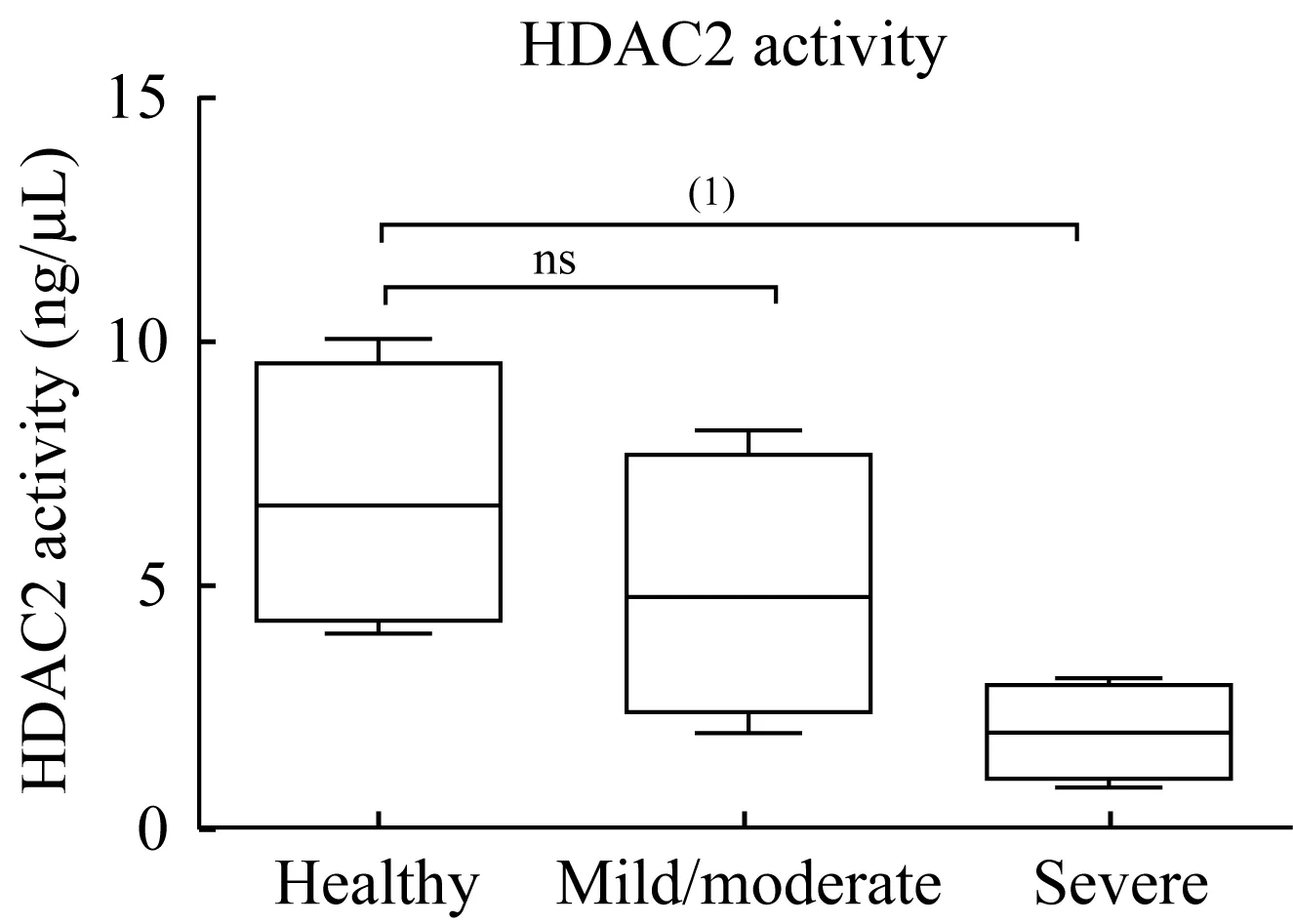
图5 PBMCs核蛋白中HDAC2活力测定Fig 5 HDAC2 activity measurement in nucleoprotein of PBMCs
重度哮喘对GC敏感性降低机制仍不完全明确,GR的表达与活性状态被认为是GC发挥抗炎作用的关键。GR 分为 GRα、GRβ、GRδ、GRγ4种亚型,研究认为GC的抗炎效应主要由GRα介导,而GRβ是其主要的负性调节因子[13]。作为皮质醇激素抗炎的基础,大量临床和实验研究表明GRα表达和活性下降导致的GC抗炎作用下降是产生GC抵抗的重要原因。有研究发现,通过选择性沉默重度哮喘患者肺泡灌洗液中巨噬细胞的GRβ基因可以提高GRα的活性与表达量,从而改善重度哮喘对激素的反应性[13]。我们的研究发现哮喘患者外周血总GR蛋白质水平并未较正常受试者降低,反而随病情严重程度表现出代偿性的增加(总GR蛋白质水平:重度哮喘组>轻中度哮喘组>健康组),进而我们考虑哮喘患者的GC不敏感与GRα的量及功能状态可能相关。在Dex诱导GRα表达的试验中发现,健康组PBMCs随着Dex孵育浓度的增高可以使GRα水平逐渐升高,但重度哮喘组即使用较高浓度的Dex孵育,也不能诱导GRα的更高表达。此外,GRα转移入核是GC发挥功能的关键,我们通过共聚焦显微镜观察健康人与哮喘患者细胞核内GRα荧光强度的动态变化,发现健康人和轻中度哮喘者核内GRα荧光强度随Dex的作用时间递增明显;但重度哮喘组并未呈现这种趋势。我们的研究表明哮喘患者对GC不敏感的形成机制与GRα在激素诱导下的水平及GRα的核内转移减弱相关。
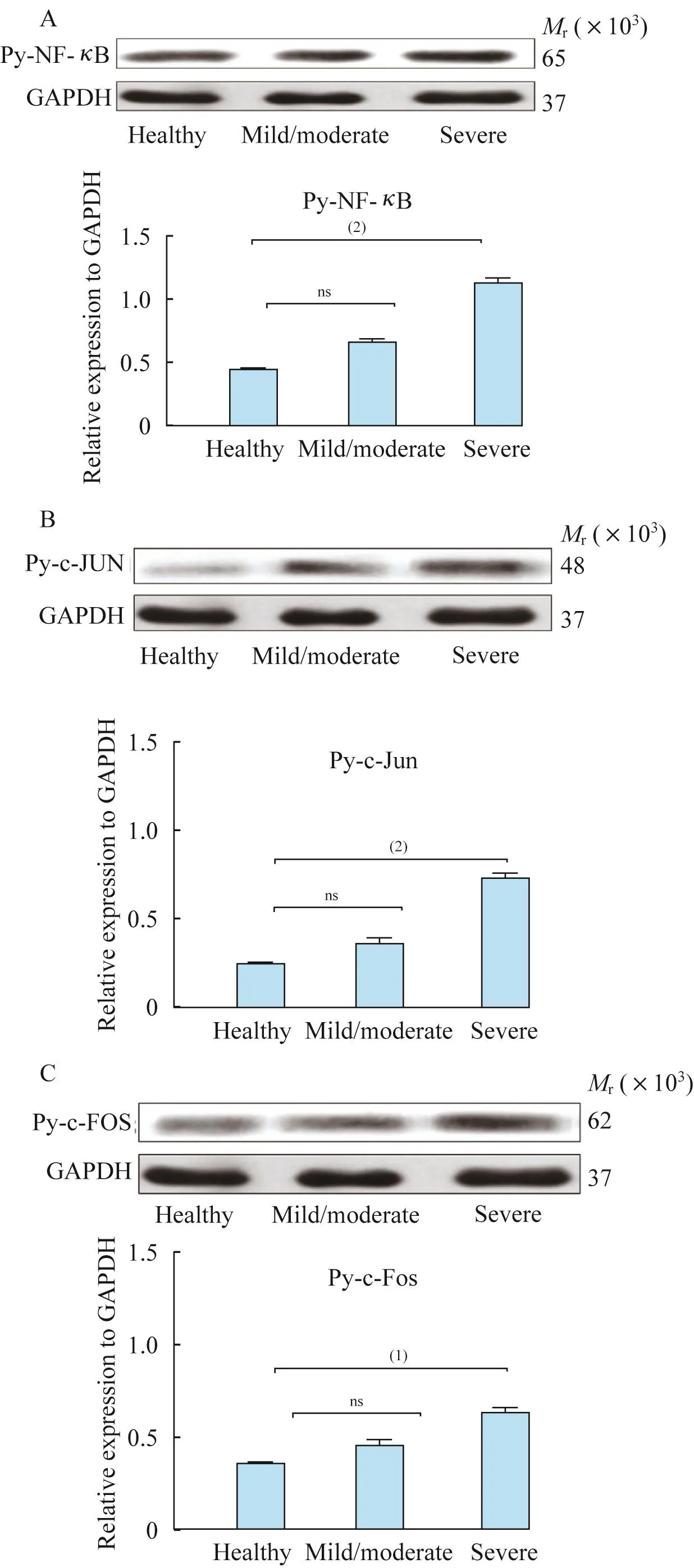
图6 Western blot检测PBMCs中促炎基因转录因子活性水平Fig 6 Transcription factor activity levels of pro-inflammatory genes in PBMCs measured by Western blot
NF-κB是在促炎症反应中起着重要作用的转录因子,它在细胞质中与抑制蛋白IκB结合,当细胞接受IL-2、粒细胞-巨噬细胞集落刺激因子、TNF-α等刺激后,IκB发生磷酸化并降解,引导NF-κB从IκB中释放并转移到细胞核中,驱动下游促炎基因的转录[14-16]。AP-1是由 Fos和 Jun蛋白质组成的异二聚体,可通过结合糖皮质激素反应元件而增强炎症基因的表达。转录因子NF-κB和AP-1的过度激活将增加下游促炎基因的转录和翻译,并可参与糖皮质激素敏感性下降的发生机制[17]。我们的研究与此观点相符,重度哮喘炎症基因转录因子的表达明显高于轻中度哮喘患者和健康对照者,其过度激活与GC不敏感的形成相关。
抗组蛋白乙酰化是GC减少炎症基因转录的重要机制,HDAC2是GC发挥转阻遏作用的关键蛋白。GC与GR结合后,可通过招募HDAC等辅助阻遏物,抑制炎症基因转录因子AP-1和NF-κB的活性,从而间接抑制炎症基因的表达。有研究表明通过保护和恢复HDAC2的活性可改善体内外试验对象的激素敏感性[18]。然而重度哮喘患者是否存在HDAC2的表达减少及活力下降,并最终影响GC的抗炎作用,目前各试验结果仍有争议[19-22]。本研究比较了重度哮喘组、轻中度哮喘组及健康对照组PBMCs胞核蛋白的HDAC2活力,发现哮喘组HDAC2活性整体低于健康组,且重度哮喘组的HDAC2活性明显低于轻中度哮喘组。说明哮喘患者存在HDAC2活力降低,且降低的程度与病情严重程度呈正相关。由此考虑重度哮喘对GC的不敏感或可因HDAC2活力的大幅下降造成,着力于恢复HDAC2蛋白活性的治疗或可有益于改善GC的敏感性。
本研究证实了在重度哮喘患者的PBMCs中存在激素不敏感,其机制与GRα产生量及核内转移障碍、炎性基因转录因子激活增加、细胞核蛋白中HDAC2活性下降相关。本研究在阐明重度哮喘患者的激素不敏感机制的同时,也为将来开发针对这一类型哮喘的新型靶向治疗提供了新的思路。
作者贡献声明邓至,邹依宁 数据采集,统计分析,论文撰写。毕晶,闵智慧,曾瑜真,毛若琳,姜志龙 数据采集。陈智鸿 论文修订。
利益冲突声明所有作者均声明不存在利益冲突。
