微小RNA-106a靶向PTEN通路对胃癌细胞的增殖与凋亡的调控作用
2021-02-01郭锦涛
李 丽 张 静 郭锦涛
胃癌是世界范围内最常见的恶性肿瘤之一,是威胁人类生命健康的重大杀手[1]。在所有预测的恶性肿瘤发病率和死亡率中,胃癌位居第三位,约占10%[2-3]。胃癌的快速增殖与凋亡失衡是胃癌患者死亡的主要原因,为改善胃癌预后结局计,需要进行早期诊断与根治[4]。胃癌的确切病因尚未完全阐明,目前认为是幽门螺旋杆菌感染、环境因素和遗传因素协同作用的结果[5-6]。磷酸酶和张力蛋白同源物(Phosphatase and tensin homologue-deleted chromosome ten gene,PTEN)为编码403个氨基酸的产物,位于10q23.3具有双重磷酸酶活性的蛋白,其可拮抗PI3激酶(PI3K)活性,从而促进肿瘤细胞的增殖、迁移和侵袭活性的增加[7-8]。microRNA是非编码的内源性小分子RNA,可参与细胞分化、凋亡、生长等过程,其异常表达与肿瘤的发生和发展密切相关[9]。miR-106a是参与细胞的增殖、凋亡和变异等过程的microRNA[10-11]。本文具体探讨了miR-106a调控JSTAT3信号通路对胃癌细胞增殖与迁移的影响,希望有助于揭示miR-106a在胃癌中的作用机制。
1 材料与方法
1.1 主要实验材料
胃癌BGC-823细胞株(购自中国科学院细胞库),鼠抗人PTEN单克隆抗体(R&D,USA),山羊抗小鼠β-actin(Santa Cruz公司),miR-106a引物、β-Actin引物(上海生工生物工程有限公司),qPCR检测试剂盒(Takara公司),miR-106a NC、miR-106a mimics、转染试剂Lipofectamine 2000(Sigma公司),胎牛血清、RPMI-1640培养基(Hyclone公司)。
1.2 细胞培养与转染
BGC-823细胞培养于含10%胎牛血清的RPIM-1640培养基中,于37 ℃、5%CO2培养箱中传代培养。取对数生长期的U87MG细胞按5×105个/ml的密度接种于培养皿中并分为三组:miR-106a组、对照组与空白组,分别转染200 ng/ml miR-106a mimic、200 ng/ml miR-NC与等体系的磷酸盐缓冲液,转染后6 h后进行换液培养。
1.3 CCK法检测细胞增殖
制成单细胞悬液(5×105个/ml),铺板96孔板,每孔加入200 μl细胞悬液,然后采用CCK-8细胞增殖与活性检测试剂盒(购自碧云天生物技术有限公司)检测细胞增殖情况,具体步骤参照试剂盒说明书,最后在490 nm处采用酶标仪中测定吸光值,读取与计算细胞增殖指数。
1.4 流式细胞仪检测细胞凋亡
调整细胞浓度为1×106个/ml,弃上清,重悬后收集细胞,采用Annexin V-FITC/PI细胞凋亡检测试剂盒(购自碧云天生物技术有限公司)检测细胞凋亡,按照试剂盒说明书进行反应后,30 min内进行流式细胞仪检测,并计算细胞凋亡指数。
1.5 Transwell小室实验检测细胞迁移与侵袭
调整浓度为2×105个/ml,在下室加入培养基(含10% FBS),上室加入细胞悬液,培养24 h;取出上室,采用多聚甲醛室温固定30 min,然后采用0.4%结晶紫室温染色15~30 min,中性树胶封片,镜下观察并计算细胞迁移指数。在检测细胞侵袭中,以2×105个细胞密度接种于24孔板的Transwell小室中,向Transwell小室下加入500 μl的培养液,培养24 h后取出Transwell小室,固定后也进行结晶紫室温染色15~30 min,中性树胶封片,镜下观察并计算细胞侵袭指数。
1.6 Western blot检测蛋白表达
全蛋白提取试剂盒(购自碧云天生物技术有限公司)提取细胞总蛋白,BCA蛋白定量检测试剂盒(购自碧云天生物技术有限公司)进行蛋白定量,上样SDS-PAGE胶,转膜后进行Western blot检测(β-Actin抗体、PTEN抗体),图像分析软件分析目的蛋白条带灰度,记录其相对表达量。
1.7 qRT-PCR检测基因表达
细胞转染后24 h与48 h,RNA提取试剂盒(购自碧云天生物技术有限公司)提取细胞总RNA,并反转录得到cDNA,并以器为模板,进行qRT-PCR检测目的基因表达。miR-106a引物:上游:5-'GCCAACGTCAGTAGGCAGA-3',下游:5-'GCCAACCATGATCTGCTGAAAC-3'。
1.8 统计方法
SPSS 22.0分析所得数据,实验数据采用均数±标准差进行表示,采用t检验和采用单因素方差分析进行组间的数据对比,以ɑ=0.05作为检验水准。
2 结果
2.1 miR-106a表达对比
细胞转染24 h与48 h后,miR-106a组的miR-106a相对表达量显著高于空白组和对照组(P<0.05),而后两组对比差异无统计学意义(P>0.05);与24 h时相比,48 h时miR-106a组细胞miR-106a相对表达量显著增高(P<0.05),另外两组两个时间点相比差异不具有统计学意义(P>0.05)。见表1。

表1 三组miR-106a相对表达量对比
2.2 细胞增殖指数对比
细胞转染24 h与48 h后,miR-106a组的细胞增殖指数较空白组和对照组显著降低(P<0.05),而后两组相比差异不具有统计学意义(P>0.05)。与24 h时相比,48 h时miR-106a组细胞增殖指数显著增加(P<0.05),另外两组两个时间点相比差异无统计学意义(P>0.05),见表2。

表2 三组细胞增殖指数对比
2.3 细胞凋亡情况对比
细胞转染后24 h与48 h,与空白组和对照组相比,miR-106a组细胞凋亡指数显著增加(P<0.05)。与24 h时相比,48 h时三组细胞凋亡指数显著增加(P<0.05),见表3。
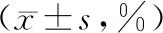
表3 三组细胞凋亡指数对比
2.4 细胞迁移与侵袭指数对比
细胞转染后24 h与48 h,与空白组和对照组相比,miR-106a组细胞迁移与侵袭指数显著降低(P<0.05)。与24 h时相比,48 h时三组细胞迁移与侵袭指数显著增加(P<0.05),见表4。
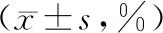
表4 三组细胞迁移与侵袭指数对比
2.5 PTEN蛋白表达对比
转染后24 h与48 h,miR-106a组PTEN蛋白相对表达水平均显著低于空白组和对照组(P<0.05)。与24 h时相比,48 h时三组细胞PTEN蛋白相对表达水平显著降低(P<0.05),见表5。

表5 三组细胞PTEN蛋白相对表达水平对比
3 讨论
胃癌是威胁人类生命健康的重大杀手。早期胃癌的5年生存率在90%以上,而晚期胃癌的生存率低于10%[12]。肿瘤增殖和凋亡是极其复杂的发展过程,对其进行早期干预能显著性地提高患者生存率[13]。miRNA是一类高度保守的非编码RNA,参与细胞生长、增殖、发育、分化、凋亡、迁移等生命活动[14]。miR-106a是miR家族中重要的一员,是与人类肿瘤密切相关的miRNA之一,调控细胞的增殖、分化、形成抗药性以及编码炎性蛋白、造血和红细胞生成、肿瘤抑制基因等过程[15-17]。本研究显示细胞转染后24 h与48 h,与空白组和对照组相比,miR-106a组的细胞增殖指数显著降低(P<0.05),细胞凋亡指数显著增加(P<0.05),表明miR-106a的过表达能抑制胃癌细胞增殖,促进细胞凋亡。
相关研究表明:miRNA可在转录后水平通过抑制靶基因mRNA翻译或诱导靶基因mRNA降解来调控靶基因的表达,从而参与早期胚胎发育、肿瘤发生发展、细胞增殖和凋亡等过程[18]。本研究显示细胞转染后24 h与48 h,与空白组和对照组相比,miR-106a组的细胞迁移与侵袭指数显著降低(P<0.05),表明miR-106a的过表达能抑制胃癌细胞转移与侵袭。
胃癌的发生包括原癌基因的激活和抑癌基因的失活,一旦它们表达失调,则有可能快速地促进肿瘤的形成。miRNA可通过靶向于不同的促癌或者抑癌基因而在胃癌形成中产生类似肿瘤抑制因子或者促癌因子的作用[19-20]。PTEN参与调节肿瘤细胞的浸润和转移,从而发挥抑癌基因作用。有研究表明PTEN或其蛋白的丢失与恶性肿瘤的进展显著相关,胃癌组织PTEN蛋白表达阳性率高于相邻正常组织,从而发挥促癌基因作用[21-22]。miRNA是通过抑制靶基因PTEN的表达而发挥作用,其可与PTEN mRNA的3'-非翻译区结合抑制其转录翻译,从而参与调控单核细胞凋亡延迟[23-24]。本研究显示细胞转染后24 h与48 h,miR-106a组的PTEN蛋白相对表达水平较空白组和对照组显著降低(P<0.05),而后两者相比差异不具有统计学意义。表明miR-106a的过表达能靶向抑制PTEN信号通路的激活。
本研究不足之处在于--仅初步阐述了miR-106a与PTEN在胃癌细胞中关系,其对于胃癌的调控作用仍需要进一步的实验研究来完善。综上所述,miR-106a的过表达可靶向抑制PTEN信号通路的激活,从而抑制胃癌细胞增殖、迁移与侵袭,促进细胞凋亡。
