miR-374a对肺腺癌细胞增殖与侵袭迁移的影响
2021-02-01孙继伟袁五营贾敬周
孙继伟 袁五营 贾敬周
肺癌是常见的呼吸系统恶性肿瘤,死亡率逐年攀升,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)作为肺癌中最为常见的发病类型,约占全部肺癌发病率的80%[1-2]。肺癌起病一般多隐匿,大部分患者在明确诊断时已处于癌症晚期,多伴有不同程度的肿瘤浸润和远处转移表现,因此预后疗效一般不甚理想[3]。MicroRNAs(miRNAs)是一类只有20~24个核苷酸的单链非编码RNAs,主要在转录后水平调控基因的表达,在肿瘤细胞的增殖、侵袭、远处转移、肿瘤血管生成以及免疫逃避等生物学行为中发挥着重要作用[4]。研究表明,NSCLC中存在多种miRNA的表达异常,如miR-146a呈明显高表达,具有一定的促癌活性[5]。miR-374a在不同物种间的序列高度保守性,在生物体的生理、病理过程中可能发挥重要的作用。但NSCLC中,miR-374a相关研究仍鲜有报道。为明确miR-374a在非小细胞肺癌中的表达和功能,本研究构建体外研究模型,探讨miR-374a在非小细胞肺癌细胞A549及H1795中的表达情况以及其对非小细胞肺癌细胞增殖、迁移、侵袭等生物学行为能力的影响,以期为临床评估提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞 实验用人正常肺上皮细胞株CCD-8L以及人非小细胞肺癌细胞株A549、人非小细胞肺癌细胞株H1975均购于ATCC(american type culture collection)。
1.1.2 主要试剂 Eagle's MEM培养基、DMEM培养基、FBS胎牛血清、胰蛋白酶购于美国Gibco公司;裂解液Trizol购于Invitrogen公司;细胞RNA提取试剂盒、实时荧光定量逆转录试剂盒、SYBR Premix Ex Taq实时荧光定量 PCR试剂盒均购于日本TaKaRa公司;Matrigel胶购于美国BD公司;二甲基亚砜(DMSO)购于美国MP公司;GenMuteTm reagent购于美国SignaGen公司4%多聚甲醛、甲醇、氯仿等购上海翊圣生物科技有限公司;miR-374a control、miR-374a mimic、miR-374a inhibitor均购于上海捷瑞生物工程有限公司。
1.2 方法
1.2.1 细胞培养 将CCD-8L细胞置于含10%FBS胎牛血清Eagle's MEM培养基中,于5% CO2、37 ℃条件下培养。将A549细胞及H1975细胞置于含10%FBS胎牛血清DMEM培养基中,于5% CO2、37 ℃条件下培养。取对数生长期细胞进行实验。
1.2.2 细胞瞬时转染 根据GenMuteTm reagent(signagen)试剂操作指南进行转染(六孔板为例),用双无DMEM培养基100 μl分别稀释miR-374a control、miR-374a mimic、miR-374a inhibitor至10 nmol/l,另各取80 μl ddH2O,20 μl 5×transfection buffer,4 μl genmute到5μl上述双无DMEM培养基中,轻轻混匀后室温下孵育20 min待用。
取对数生长期A549、H1975细胞以1.5×105个/ml分别接种于6孔板,以次日贴壁细胞量达50%~60%为宜,次日分别将稀释好的miR-374a control、miR-374a mimic、miR-374a inhibitor加入不同孔槽中,然后每孔加入1ml完全培养基,轻轻吹打混匀,常规培养48 h,采用RT-PCR实验检测转染前后miR-4500表达水平改变情况。
1.2.3 RT-PCR 各组A549、H1975细胞总RNA提取采用Trizol法。除去6孔板中细胞培养液,每孔加PBS 1 ml洗涤细胞2次,每孔中加入Trizol 1 ml,反复吹打,室温静置5~10 min。随后收集6孔板中混合液吸取至1.5 ml EP管中,冰上静置2 min。按每1 ml Trizol加入0.2 ml氯仿,用振荡器振荡EP管15s左右,使氯仿和Trizol充分混合,冰上静置3~5 min,4 ℃,12 000 g离心15 min。取上清液,加入异丙醇0.5 ml,混匀后冰上静置10 min,4 ℃,12 000 g离心5 min。弃上清,取离心沉淀加入预冷的75%乙醇1 ml,吹打混匀后,4 ℃,7 500 g离心5 min。去上清,吸取残余酒精,超净台中风干,加入20~40 μl DEPC水溶解RNA沉淀。用紫外分光光度仪测定总RNA浓度与纯度,A260/280在1.8~2.0。按照mRNA反转录试剂盒操作说明进行反转录,cDNA稀释至100 μl置冰浴待用或-20 ℃保存。各样本逆转录产物cDNA需要量为2.0 μl,利用SYBR Green I法[试剂盒 SYBR Premix Ex Taq Kit(Takara)]在荧光定量PCR仪上行qPCR检测。反应程序:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 20 s,40个循环,所有试验重复3次,采用相对定量分析按照2-(△△Ct(实验组)-△△CT(对照组))求出各组细胞中miR-374a表达水平。miR-374a引物及内参引物均由上海捷瑞生物工程有限公司设计合成,见表1。

表1 miR-374a引物及内参引物序列
1.2.4 CCK8细胞增殖实验 收集生长对数期A549、H1975细胞制成细胞悬液,离心后重悬细胞,调整悬液细胞浓度至5000个/ml,96孔板每孔加入细胞悬液100 μl,每组3个复孔,置于37 ℃ 5%CO2培养箱常规培养24 h。分别转染miR-374a control、miR-374a mimic、miR-374a inhibitor后,置于37 ℃ 5%CO2培养箱常规培养,分别于24 h、48 h、72 h、96 h、120 h时于每孔加入10 μl CCK8试剂,继续置于培养箱中放置2 h,用酶标仪测定其在450 nm处的吸光度(OD)值。以相对应OD值表示细胞增殖能力大小,绘制细胞生长曲线,观察各组细胞增殖能力变化情况。
1.2.5 细胞平板克隆实验 取对数生长期细胞A549、H1975分别用胰酶消化后制成细胞悬液,离心后重悬细胞,调整悬液细胞浓度,以每孔1×103接种于6孔板,按瞬时转染分组,分别转染miR-374a control、miR-374a mimic、miR-374a inhibitor,并添加PEDF蛋白,置于37 ℃ 5%CO2培养箱常规培养。每3天更换1次培养基,约10天后,肉眼即可看到细胞克隆时,吸去培养基,用PBS溶液轻轻漂洗2次,4%多聚甲醛固定15 min,PBS溶液轻轻漂洗2次,每孔加入1 ml 0.5%结晶紫染液染色20 min。洗去多余染液,在显微镜下观察计数大于50个细胞的克隆数,每组实验独立进行3次,每次3个复孔。
1.2.6 Transwell细胞迁移实验 取对数生长期的转染miR-374a control、miR-374a mimic、miR-374a inhibitor细胞A549、H1975常规消化,终止消化后离心弃去上清液,加无血清培养基200 μl重悬细胞,轻轻吹打混匀后细胞计数,加适量无血清培养基调整细胞密度至5×105个/ml,向每个Transwell小室中加入200μl细胞悬液,并在24孔板每孔对应加入600 μl的完全培养基,将小室放入孔中,培养箱培养24 h。取出Transwell小室,吸净孔中培养液,PBS清洗两遍,4%多聚甲醛固定30 min后,再次用PBS洗两遍,用0.1%的结晶紫染料染色3 min,再用棉签轻轻地擦掉里层未迁移细胞,用PBS洗3遍,将小室放置风干。400倍显微镜下随机四个视野观察细胞,计数穿过微孔移到滤膜下层的细胞总数,共计数中央及四周各5个视野并取其平均值。
1.2.7 Transwell细胞侵袭实验 用4 ℃预冷的无血清培养基于冰上稀释Matrigel至终浓度1 mg/ml,Transwell上室底部中央垂直加入50 μl稀释后的Matrigel,37 ℃静置2 h使其凝固成胶状,进行Matrigel胶预处理。
取对数生长期转染miR-374a control、miR-374a mimic、miR-374a inhibitor的细胞A549、H1975常规消化,终止消化后离心弃去上清液,加无血清培养基200 μl重悬细胞,轻轻吹打混匀后细胞计数,加适量无血清培养基调整细胞密度至1×106个/ml,向每个铺胶的Transwell小室中加入200 μl细胞悬液,并在24孔板每孔对应加入600 μl的完全培养基,然后将小室放入孔中,培养箱培养24 h。取出Transwell小室,吸净孔中培养液,棉签拭去小室内部的Matrigel胶,PBS清洗两遍,4%多聚甲醛固定30 min后,再次用PBS洗两遍,用0.1%的结晶紫染料染色3 min,再用棉签轻轻地擦掉里层未迁移细胞,用PBS洗3遍,将小室放置风干。400倍显微镜下随机四个视野观察细胞,计数穿过微孔移到滤膜下层的细胞总数,共计数中央及四周各5个视野并取其平均值。
1.3 统计学处理
应用SPSS 19.0统计软件进行分析。计量资料采用均数±标准差表示,若数据符合正态分布、方差齐,则采用两独立样本t检验;若方差不齐,则采用近似t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-374a在非小细胞肺癌细胞中的表达情况
RT-PCR实验结果显示,与人正常肺上皮细胞比较,在非小细胞肺癌细胞 A549、H1975中,miR-374a呈明显高表达(P<0.05),组间差异显著,具有统计学意义,见图1。
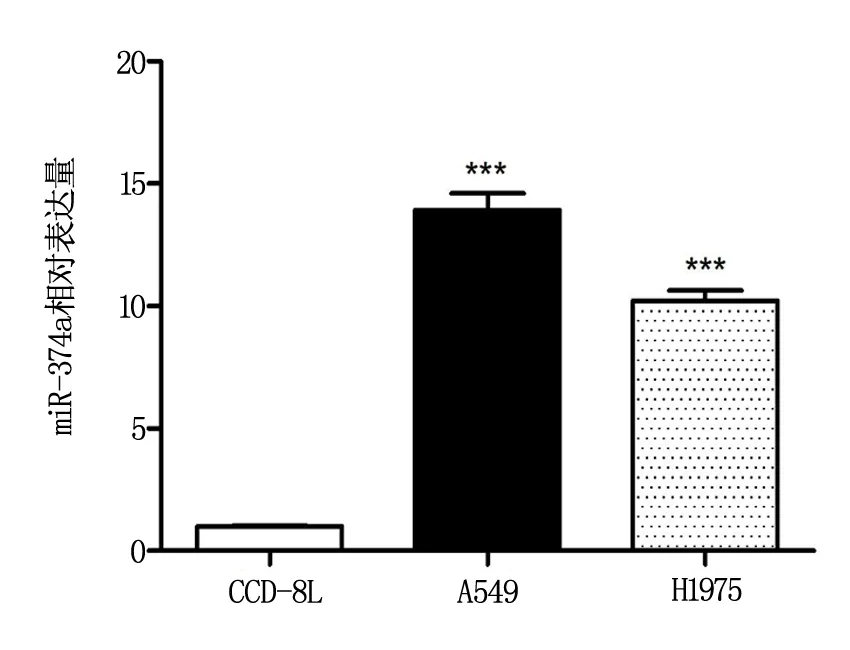
图1 miR-374a在非小细胞肺癌细胞中的表达情况
2.2 miR-374a mimic和miR-374a inhibitor转染效率情况
RT-PCR实验结果显示,在两组非小细胞肺癌细胞中,与control组比较,miR-374a mimic组细胞miR-374a表达水平均明显较高(P<0.05),miR-374a inhibitor组细胞miR-374a表达水平则明显低于control组(P<0.05),组间差异具有显著统计学意义,见图2。

图2 miR-374a mimic和miR-374a inhibitor转染效率情况
2.3 miR-374a对非小细胞肺癌细胞增殖能力的影响
CCK8细胞增殖实验结果显示,与control组细胞比较,在转染120h时,miR-374 mimic组非小细胞肺癌细胞的增殖率明显较高(P<0.05),miR-374a inhibitor组非小细胞肺癌细胞细胞的增殖率则明显较低(P<0.05),组间差异显著,具有统计学意义。见图3。
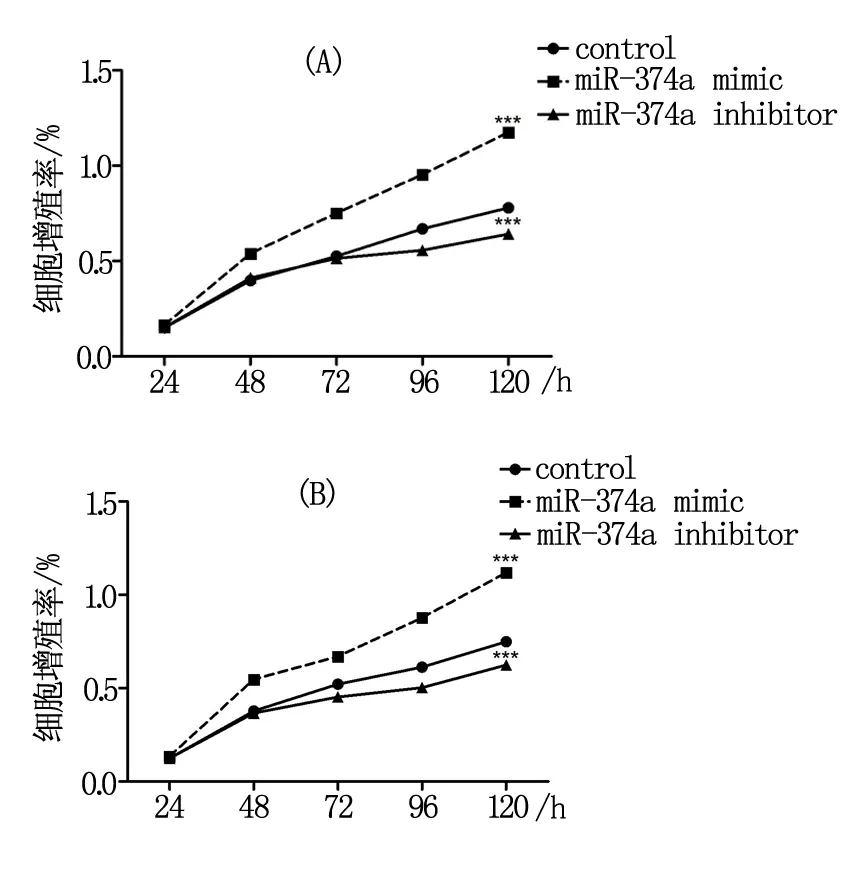
注:A为A549细胞;B为H1795细胞。
2.4 miR-374a对非小细胞肺癌细胞平板克隆形成能力的影响
细胞单克隆实验结果显示,两组非小细胞肺癌细胞中,与control组比较,miR-374 mimic组细胞单克隆能力明显较强(P<0.05),miR-374a inhibitor组细胞单克隆能力则明显受到抑制(P<0.05),组间差异明显,具有统计学意义。见图4。
2.5 miR-374a对非小细胞肺癌细胞迁移能力的影响
Transwell细胞迁移实验结果显示,与control组非小细胞肺癌细胞比较,miR-374a mimic组非小细胞肺癌细胞细胞的迁移能力明显较高(P<0.05),miR-4500 inhibitor组胶质瘤细胞的迁移能力则明显较低(P<0.05),组间差异具有统计学意义。见图5。

图4 miR-374a对非小细胞肺癌细胞平板克隆形成能力影响
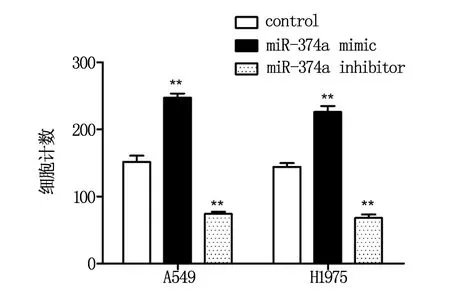
图5 miR-374a对非小细胞肺癌细胞迁移能力的影响
2.6 miR-374a对非小细胞肺癌细胞侵袭能力的影响
Transwell细胞侵袭实验结果显示,与control组比较,miR-374a mimic组细胞侵袭能力明显较强(P<0.05);且与control组比较,加入miR-4500 inhibitor处理后,miR-4500 inhibitor组细胞侵袭能力明显降低(P<0.05),组间差异具有统计学意义。见图6。

图6 miR-374a对非小细胞肺癌细胞侵袭能力的影响
3 讨论
miRNAs是1类单链小分子非编码RNA,具有物种保守性,在细胞周期、分化、生长、凋亡以及各种应激反应中扮演着重要角色[6]。近年来越来越多研究表明,miRNAs在众多肿瘤的发生发展过程中具有不同程度的异常表达,且同1种miRNAs在不同肿瘤中的表达及作用也不尽相同[7]。现已发现许多实体瘤中都有各自特异的miRNA表达谱,尽管目前并不完全清楚这些异常表达的miRNA是否是影响肿瘤发生发展及预后的根本原因,但是,这些miRNA在肿瘤中的作用却是显而易见的。
研究证实,miRNA与非小细胞肺癌(NSCLC)的发生发展密切相关,miRNA的异常表达与NSCLC患者吸烟状态、肿瘤大小、淋巴结转移和TNM分期显著相关,不仅可作为潜在的NSCLC预后预测分子标志物,部分miRNA的联合诊断还可用作NSCLC早期诊断的候选标志物[8-9]。应朝辉等探究miRNA-106b-5p表达对接受靶向治疗NSCLC患者预后的影响发现,miRNA-106b-5p高表达与靶向治疗NSCLC患者不良预后相关,miRNA-106b-5p高表达是影响靶向治疗NSCLC患者预后的独立危险因素,提示miRNA在NSCLC的预后评估中具有重要参考价值[10]。miRNA-374a是1个研究相对较少的miRNA,位于染色体Xq13.2,在肿瘤的调节中既可发挥促癌作用也可起到一定的抑癌作用[11]。有研究表明,与癌旁正常组织相比,miR-374a在早期NSCLC组织中呈现高表达,且与肿瘤细胞增殖具有一定关系[12]。比较健康人血清与NSCLC患者血清中miR-374a的表达水平,NSCLC患者血清中miR-374a含量明显较高,提示血清miR-374a有望成为1种新的生物标志物用于NSCLC的辅助诊断[13]。Wang等[14]体内外实验结果显示,miR-374a可通过靶向Wnt5a相关信号通路作用,调节NSCLC的EMT进程,抑制肿瘤细胞的增殖,提示miR-374a对于NSCLC的疾病进展具有一定的抑制作用。有学者[15]研究同样证实,过表达miR-374a可抑制肺腺癌细胞的增殖、迁移和侵袭,miR-374a可通过直接靶向负调控TGFA基因表达,发挥抑癌基因作用。目前已有多项miR-374a在肺癌中的作用研究结果相悖,提示miR-374a在肺癌中作用复杂,其调节的具体信号通路需要深入研究。
本研究拟在体外实验中,通过比较人正常肺上皮细胞及NSCLC细胞中miR-374a的表达量,明确miR-374a在NSCLC细胞中的表达,并通过瞬时转染技术上调和下调NSCLC细胞中miR-374a的表达水平,进一步探究miR-374a对NSCLC细胞增殖、迁移和侵袭能力的影响。实验结果显示,相较于人正常肺上皮细胞CCD-8L,NSCLC细胞A549、H1795中miR-374a呈稳定高表达,与既往研究一致。接着,我们对NSCLC细胞A549、H1795进行了miR-374a mimic、miR-374a inhibitor瞬时转染,调节NSCLS中miR-374a的表达情况,RT-PCR结果显示转染效率高,miR-374a mimic、miR-374a inhibitor可分别瞬时过表达、低表达非小细胞肺癌细胞A549、H1975中miR-374a表达情况(P<0.05),具有统计学意义。在此基础上,我们分别采用CCK8实验、平板克隆实验和Transwell细胞迁移、侵袭实验对改变miR-374a表达水平后NSCLC细胞的生物学行为能力进行了探究。实验结果显示,采用miR-374a mimic过表达miR-374a可促进NSCLC细胞A549、H1975的增殖、迁移和侵袭(P<0.05),采用miR-374a inhibitor则可靶向抑制miR-374a的表达,并抑制NSCLC细胞A549、H1975的增殖、迁移和侵袭(P<0.05),提示miR-374a在NSCLC的发生发展过程中发挥着促癌作用。但有既往研究指出[16],miR-374a不仅在不同的NSCLC细胞中发挥的功能不同,其在NSCLC发生发展不同阶段扮演的角色也不尽相同,在后续的实验中,我们将采用慢病毒稳转技术,在不同NSCLC细胞及同一细胞的不同生长周期中进一步探究miR-374a的作用及机制。
综上所述,miR-374a在非小细胞肺癌细胞A549、H1975中呈稳定高表达,且具有一定的促进肿瘤细胞增殖、克隆、迁移和侵袭的能力。具体的作用机制及相关靶基因有待进一步探究。
