人工耳蜗电极表面载药膜的制备与听力保护作用
2021-02-01于浩然黄玉宇陈君敏张帆孙夏雨贾欢杨军
于浩然黄玉宇陈君敏张帆孙夏雨 贾欢杨军,5*
1上海交通大学医学院附属新华医院耳鼻咽喉-头颈外科(上海 200092)
2上海交通大学医学院附属第九人民医院耳鼻咽喉-头颈外科(上海 200011)
3复旦大学附属眼耳鼻喉医院耳鼻咽喉-头颈外科(上海 200031)
4上海市耳鼻疾病转化医学重点实验室(No.14DZ2260300)(上海 200125)
5上海交通大学医学院耳科学研究所(上海 200125)
世界卫生组织最新统计表明,全球约4.66亿人患有残疾程度的听力损失(听力较好耳的听力损失:成人>40dB/儿童>30dB)[1],其中3400万是儿童。对于重度、极重度耳聋的患者,人工耳蜗已经成为常规的治疗手段。随着手术方法和科技进步,人工耳蜗植入手术适应症也在扩大,如术前高频听力重度下降但有低频残余听力者也可行耳蜗植入[2]。但由于植入时对内耳造成机械损伤,同时术后炎症反应、纤维组织增生等因素,既容易造成术后残余听力的损失,又影响人工耳蜗植入效果[3]。
糖皮质激素类药物可以有效抑制炎症反应和纤维组织形成,但全身应用该类药物存在明显副作用和特殊人群禁忌[4]。乙交酯丙交酯共聚物(Poly Lactic-co-Glycolic Acid,PLGA)具有可降解、生物相容性好和安全度高等特点,因此一直被广泛用作药物辅料。本研究报道了一种在人工耳蜗植入电极表面以PLGA为载体,利用浸涂法制备高分子载药涂层的方法,实现局部、定向、持久给药,并对其材料特性进行描述的同时以豚鼠构建动物模型,探讨该载药电极对残余听力的保护作用。
1 研究材料与方法
1.1 药品、试剂和仪器
PLGA(深圳博立生物材料,50:50,Mw=1-3万);三氯甲烷(分析纯,上海申博化工);地塞米松磷酸钠(99%,Sigma,USA);氯化钠(分析纯,国药集团)、氯化镁(分析纯,国药集团)、氯化钾(分析纯,国药集团)、氯化钙(分析纯,国药集团)、葡萄糖(分析纯,国药集团);HEPEs(99%,Amresco,USA);恒温干燥箱(上海力辰科技,DZF-6020A);人工耳蜗植入电极(HiRes 90K 1J,Advanced Bionics);人工耳蜗调机软件(Soundwave 3.1,Advanced Bionics);场发射扫描电子显微镜(S-4800,HITACHI);高效液相色谱仪(LC-10ATVP,日本岛津);色谱柱(Hypersil,ODS2,C18,5μm,4.6×200mm);视频接触角测量仪(JY-82B,鼎盛);戊巴比妥钠(99%,上海隆盛化工);碳纤维模拟电极(SDF碳素,东阳上岛);ABR测试仪(RZ6,Tucker-Davis Technologies);SPSS软件(Version 18.0)。
1.2 载药电极的制备
在室温下,用玻璃皮氏培养皿制备质量分数为5%的PLGA三氯甲烷溶液。称取所用载体PLGA总质量10%(可根据实际所需调整)的地塞米松磷酸钠(Dexamethasone Sodium Phosphate,DSP)并添加到溶液体系中混匀后即为涂料。手持人工耳蜗植入体将电极浸没于涂料中1-2秒后缓缓提出。待涂料流平及三氯甲烷挥发后,形成电极表面完整载药薄膜。最后再用硅胶刷蘸取少许三氯甲烷、轻轻擦去电极金属接触点表面覆盖的薄膜。
1.3 场发射扫描电镜分析
取新电极和载药电极,分别截取耳蜗内植入段。将截取好的样本使用场发射扫描电子显微镜(Environmental Scanning Electron microscopy,ESEM)分析并拍摄实时图像。
1.4 电极涂层前后阻抗测量
待测电极浸入人工外淋巴液(每100ml中含NaCl 0.8 g,KCl 0.04 g,CaCl20.02 g,MgCl20.017 g,Glu 0.1 g,HEPES 0.12 g)中形成检测回路,在相同条件下使用人工耳蜗调机软件分别测量新电极以及载药电极的阻抗值。
1.5 电极涂层前后表面水接触角测量
采用视频接触角测量仪测量新电极及载药电极表面静态水接触角。
1.6 体外释药试验
取5根电极为一组,置于600μl人工外淋巴液中(37℃,摇床),每24小时取样并换液。采用HPLC法(流动相:三乙胺溶液-甲醇-乙腈55:40:5;波长:242 nm;流速:1 ml/min)测定每个样品中DSP浓度,绘制载药电极体外释药曲线。
1.7 豚鼠耳蜗模拟电极植入及ABR检测
取20只豚鼠,随机分成实验和对照组各10只。采用耳后切口,暴露听泡。进入鼓室后在显微镜下于耳蜗底回侧壁磨开一骨窗。将提前准备好的经低温等离子消毒的碳纤维模拟电极缓缓插入。实验组电极表面覆盖DSP载药涂层,对照组无涂层。相同方法暴露对侧耳蜗,用钩针将其挑碎破坏。术后分别于1小时,1周,2周,4周,3个月,使用ABR测试仪测试两组豚鼠ABR阈值。ABR检测刺激声采用短纯音,频率为 16kHz、24kHz和32 kHz,每一频率的刺激声强从90 dB SPL每隔5 dB SPL下降到20 dB SPL,叠加250次,在大概确定ABR波形消失的范围后,在该声强附近重复检测,叠加1000次以进一步验证结果,并记录ABR的阈值。手术和检测时,豚鼠均在戊巴比妥钠麻醉状态。
1.8 统计分析
使用SPSS软件分析体外释药数据,并对其进行数学拟合建模。使用t检验分析电极涂层前后材料特性参数。动物实验中组间ABR阈值差异使用Mann Whitney U test进行检验。
2 结果
2.1 载药薄膜包被前后电极表面形貌
质量分数为5%的PLGA三氯甲烷溶液表现出理想的成膜粘稠度,成膜后在光镜和电镜下均呈现光滑、均一、菲薄的特点(图1)。电极金属触点表面薄膜擦去后有利于维持电极良好的导电性。由ESEM照片可见,载药薄膜局部放大至1万倍呈现气孔结构,考虑由三氯甲烷溶剂挥发导致,极大增加了释药面积和薄膜本身的降解速率。同时,利用高能电子束轰击载药涂层局部可形成断层(图2),热效应可能会造成轻微形变,故粗略估计涂层厚度约为1.02±0.05μm,相较于目前常见的300-500μm直径的植入电极而言几乎可以忽略。

图1 光镜和ESEM下显微照片。(a-1)光镜下电极原貌;(b-1)光镜下电极表面包被DSP-PLGA涂层,其中金属触点表面涂层已擦除;(a-2)ESEM下电极原貌;(b-2)ESEM下电极表面包被DSP-PLGA涂层;(a-3)电极原貌在ESEM下经10,000倍放大后;(b-3)DSP-PLGA涂层在ESEM下经10,000倍放大后;(※)电极表面局部涂层被擦除,可见一条自上而下的分界线;Fig.1 Micrographs under light microscope and ESEM:(a-1)Original morphology of electrode array under light microscope;(b-1)Electrode array coated with DSP-PLGA and the coating on metal contacts was wiped off;(a-2)Original morphology of electrode array under ESEM;(b-2)Electrode array coated with DSP-PLGA under ESEM;(a-3)Original morphology of electrode array under ESEM enlarged by 10,000x;(b-3)Electrode array coated with DSP-PLGA under ESEM enlarged by 10,000x;(※)Partial coating on the electrode array was wipped off and a top-down dividing line is visible;
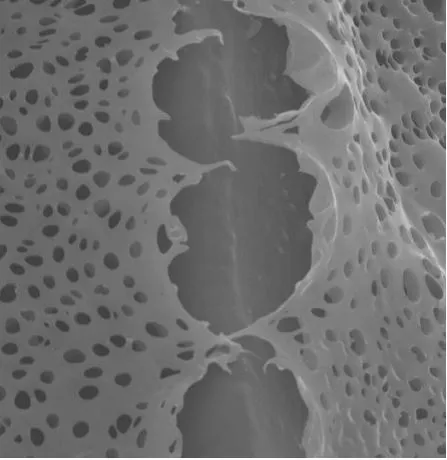
图2 载药涂层厚度估算Fig.2 Estimation of Thickness of Drug-loaded Coating:Continuous bombardment with electrons can break the coating and estimate its thickness.
2.2 电极涂层前后阻抗与水接触角
载药涂层前后对电极金属触点的保护良好,电极16对通道平均阻抗涂层前0.9±0.22 kΩ,涂层后1.0±0.18 kΩ,无统计学差异。植入电极的原有表面静态水接触角由硅胶材质本身决定为102±0.6°,涂层后为77±1.6°。涂层后电极表面静态水接触角明显减小,提示电极表面亲水性提高(图3)。

图3 电极涂层前后水接触角变化a涂层前约102°;b涂层后约77°Fig.3 Change of water contact angle before and after coating:approx.a 102°before coating;b approx.77°after coating
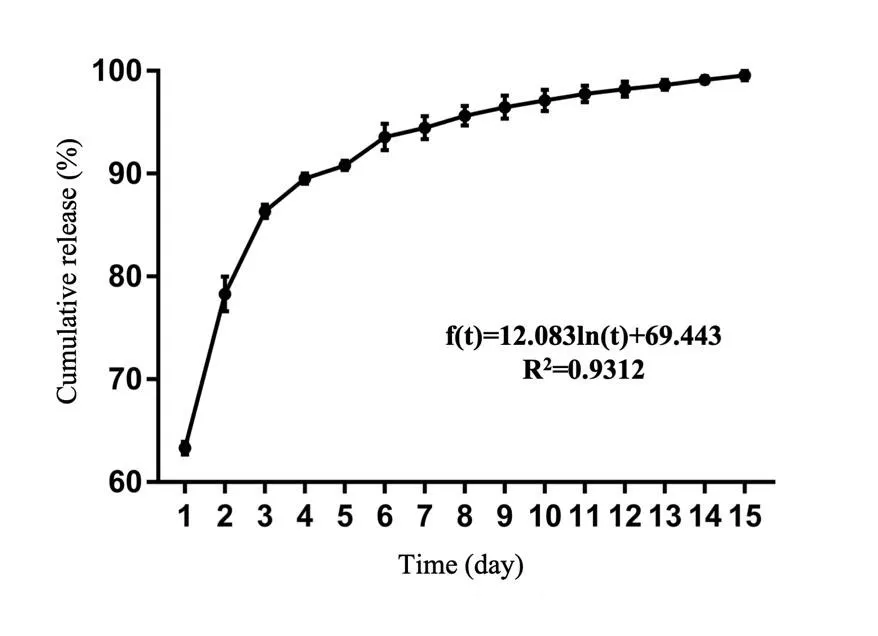
图4 载药涂层电极释药曲线Fig.4 Drug release profile of drug-loaded coating
2.3 体外释药的描述及拟合分析
载药涂层药物的累计释放量(%)与释药时间之间的关系,经SPSS软件拟合函数为f(t),相关系数R2约0.93(图4),呈现明显的对数函数关系。在第1个24小时涂层释放药物量最多,存在突释现象。当t≥15时,函数增速放缓趋向稳定。即载药电极药物完全释放需要约2周。
2.4 豚鼠耳蜗模拟电极植入后听力水平变化
实验组与对照组豚鼠耳蜗模拟电极植入后各个时间点ABR测试结果(16、24、32kHz,均值±标准差)(表1,图5)显示,电极植入后1小时两组豚鼠ABR阈值无明显差别。从第1周开始实验组豚鼠ABR阈值均明显低于对照组,且较术后1小时听力水平有所提高(P<0.001),至术后3月,ABR阈值较术后1小时减小了约10 dBnHL。而对照组豚鼠ABR阈值稳定并伴有少许增大,术后3月时与术后1小时相比,ABR阈值增大了约5 dBnHL。
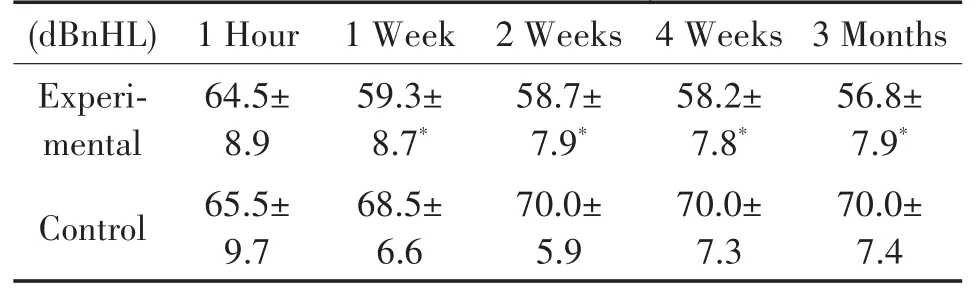
表1 豚鼠耳蜗植入模拟电极后ABR阈值(16kHz、24kHz,*P<0.001)Table 1 ABR threshold of guinea pig implanted with analog electrode(16kHz、24kHz、32kHz,*P<0.001)
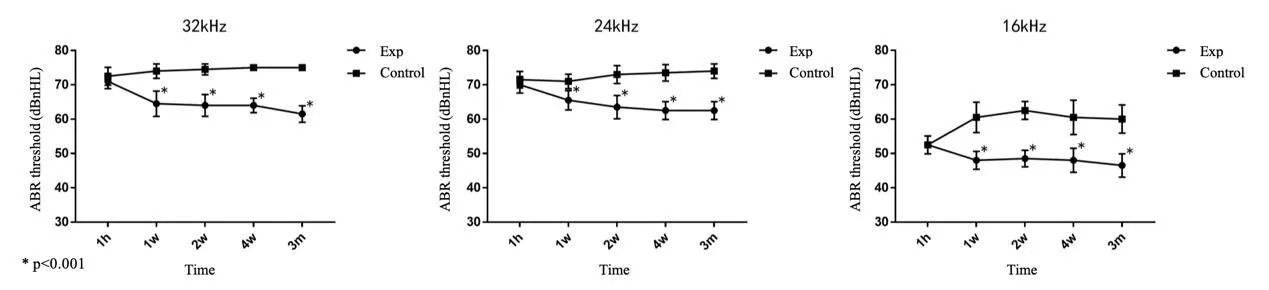
图5 豚鼠耳蜗植入模拟电极后ABR阈值(16kHz、24kHz、32kHz,*P<0.001)Fig.5 ABR threshold of guinea pig implanted with analog electrode(16kHz、24kHz、32kHz,*P<0.001)
3 讨论
糖皮质激素是目前唯一被证实对突发性耳聋有治疗作用的药物[5,6],故其对耳蜗植入后不良反应的防治研究最多见,但结果不一[7-10]。此外,由于中耳和内耳的特殊解剖结构,很多给药方式如中耳腔注射、圆窗膜渗透、内耳注射等,均无法持续、稳定地维持内耳药物浓度。研究人员便着眼于电极本身的改造,以定制含药硅胶、电极开槽填药或表面理化处理为三大研究方向[11],但往往技术难度大、转化成本高。本研究首次采用浸涂法在电极表面制备载药薄膜,技术简单且经济优势明显。同时载药种类、载药量可以根据实际需要进行调整,易于实现无菌化操作,在手术过程中即可完成定制化精准医疗。
药物载体的选择上,透明质酸水凝胶研究较多[12,13],但其成膜性、稳定性不可靠。另一明星材料聚乳酸在冠脉支架涂层领域炙手可热,但其降解时间过长、机械强度过高[14],不适用于人工耳蜗电极。本研究采用的PLGA是经中美FDA双认证的药用辅料,其合成单体为乳酸和羟基乙酸,不同单体配比可以调控其降解速率[15]。而本研究所用PLGA(50:50,Mw=1-3万),由专业高分子材料公司合成,设计降解周期为20-30天,覆盖术后炎症反应、水肿最活跃时期[16,17]。
在动物实验中,电极植入段大部分位于耳蜗底回,术后豚鼠ABR阈值以高频段影响为著。随着时间推移,实验组ABR阈值持续降低且显著小于对照组。Farhadi等的研究表明,DSP能够广泛抑制电极植入后炎症细胞的趋化,降低炎症反应强度[18]。Douchement团队在也发表了相似研究结果,证实DSP对术后听力的改善作用[19],且从长期效果来看,DSP浓度越高获益越大。
本研究中为了避免PLGA的绝缘性对电极导电性能的影响,擦除了金属触点表面薄膜,但也牺牲了一部分的有效药物载荷与面积。而Alshammary教授报道了一种导电高分子材料聚吡咯,可以在电刺激下调节细胞的粘附和迁移行为[20]。这尤其适用于人工耳蜗电极工作的微环境,但目前还没有相关研究发表。另外,水接触角是表征材料表面亲水性能的重要参数。本研究中载药电极表面水接触角明显减小,亲水性能的提升有利于抵抗蛋白质的粘附[21]。且Hadler等还证实,高分子材料涂层本身也具有抑制表面纤维组织形成的特点[22]。
药物缓控释制剂的释放曲线一般采用零级、一级或Higuchi方程进行拟合评价。其中,理想的控释行为应当符合零级动力学方程。国内刘娅等[23]采用定制含药硅胶和于坤宏等[21]采用化学药物耦联方法,基本实现了这一目标。但释放速度缓慢且定制化、工艺难度高。在本研究基础上,未来可以尝试引入控释剂如泊洛沙姆或者控释涂层来优化释药行为。总之,本研究描述了一种全新的浸涂法在人工耳蜗电极表面制备PLGA高分子载药薄膜的可行性和应用价值,证实了载DSP电极对植入后听力的保护作用。
