五氯苯酚对污泥急性毒性和菌群结构的影响
2021-02-01赵建国徐永贵李刚强李玉张珂孙言卓
赵建国,徐永贵,李刚强,李玉,张珂,孙言卓
1.郑州轻工业大学 环境污染治理与生态修复河南省协同创新中心,河南 郑州 450001;2.河南省对外科技交流中心,河南 郑州 450001;3.郑州航空港区明港水务有限公司,河南 郑州 450000
0 引言
不同种类和性质的氯酚类化合物被广泛应用于工业品的生产过程,如2,4-二氯苯酚(2,4-DCP)和2,4,5-三氯苯酚(2,4,5-TCP)大量用于农药2,4-D和2,4,5-T的生产,五氯苯酚(PCP)用于血吸虫病的防治等[1-2],这导致大量的氯酚类化合物进入水体,对自然环境造成了很大的危害.此外,部分工业生产过程排放的废水(如焦化废水和造纸废水)中也含有质量浓度较高的不同氯酚类化合物[3-4].由于氯酚类化合物会对生物的代谢造成不可逆的损害,甚至可能会引起致畸、致癌和致突变的“三致”效应,许多国家都将其列为重点管控的污染物[5-6].我国颁布的《生活饮用水卫生标准》(GB 5749—2006)也将2,4,6-三氯苯酚(2,4,6-TCP)、PCP等多种氯酚类化合物列为毒理检测指标,要求对排放废水中氯酚类化合物的质量浓度进行严格管控[7].
相关研究发现,采用物理和化学方法均可实现废水中氯酚类化合物的去除,但废水中的其他污染物(如悬浮物(SS)和氨氮)会影响其处理效果[8].此外,在污染物去除过程中,氯酚类化合物会产生多种中间产物,易对水体造成二次污染[9].因此,可考虑采用耐受污染物冲击的活性污泥工艺.经氯酚类化合物驯化的活性污泥在降解去除氯酚类化合物的同时可去除其他类型的污染物,其菌群结构与不同反应器的运行条件有关[10],如S.K.Karn等[11]研究发现,从造纸厂分离纯化的菌株PseudomonasstutzeriCL7可矿化质量浓度高达600 mg/L的PCP.
然而,在利用活性污泥工艺处理废水中氯酚类化合物的研究中,大部分研究者多关注水相和泥相中氯酚类化合物的去除效果、氯酚类化合物的降解动力学和降解路径、降解氯酚类化合物的优势菌群筛选等,而关于处理氯酚类化合物的污泥毒性相关问题的研究较少,也忽略了降解氯酚类化合物的优势菌群对污泥毒性的影响.鉴于发光菌急性毒性生物实验可有效评估废水和污泥的急性毒性问题[12-13],本研究在前期实验的基础上,拟利用耐受污染物冲击和易于控制的序批式反应器(SBR)处理以甲醇为共代谢碳源的PCP废水,控制其进水PCP质量浓度为10 mg/L,研究PCP对污泥急性毒性和菌群结构的影响,并分析优势菌群对污泥急性毒性的作用,以期为准确评估处理工业废水的污泥急性毒性和后续污泥资源化利用提供参考.
1 材料与方法
1.1 主要试剂及仪器
主要试剂:PCP(化学纯,纯度≥98.5%),上海飞祥化工厂产;无水甲醇(分析纯),国药集团化学试剂有限公司产;甲醇(色谱纯,纯度≥99.9%),北京百灵威科技有限公司产;超纯水,英国ELGA超纯水机(包含水柱)制取;明亮发光杆菌T3冻干粉,中科院南京土壤研究所产;AxyPrep DNA凝胶回收试剂盒,美国Axygen公司产;pED-T载体试剂盒、Amp抗性LB培养基,上海凌科生物科技有限公司产;TAE缓冲液(1×),上海生工生物工程股份有限公司产;其他化学试剂均为分析纯或优级纯.
主要仪器:LC-20ATVP型高效液相色谱仪,日本岛津公司产;DXY-2型生物毒性测定仪,中科院南京土壤研究所产;JJ-1型精密增力电动搅拌器,金坛市科技仪器有限公司产;GZX-9030 MBE型数显鼓风干燥箱,博旭实业有限公司医疗设备厂产;TGL-18 M型台式高速低温离心机,上海安亭科学仪器厂产;FiveEasyTM型 pH计,上海梅特勒-托利多仪器(上海)有限公司产;YSI型便携式DO计,上海维赛仪器贸易有限公司产.
1.2 实验方案
接种污泥取自上海长桥污水处理厂的曝气池,该污泥在投加到SBR前经3次清洗和24 h曝气处理.实验用SBR的有效容量为5 L,其高度和内径分别为25 cm和20 cm.投加的初始污泥质量浓度(MLSS)和体积指数(SVI)分别为2.5 g/L和90 mL/g.单个SBR运行周期的水力停留时间(HRT)控制为12 h,具体为进水0.25 h,运行11 h,沉降0.5 h和排水0.25 h.调整SBR运行工艺为曝气-静置的循环模式,曝气和静置的时间均设置为2 h.为使溶解氧(DO)与活性污泥充分接触,曝气过程中对污泥进行搅拌,并控制DO质量浓度为(1.5±0.5) mg/L,静置期间停止搅拌.SBR运行期间的温度控制为(25±1) ℃,通过NaHCO3溶液和稀HCl调整进水的pH值为7.2±0.4.通过排泥的方式,整个运行过程中污泥的质量浓度控制在2.5 g/L左右.
实验所用废水为模拟废水,由甲醇提供碳源,控制进水化学需氧量(COD)为(300±20) mg/L,N元素和P元素分别由尿素和KH2PO4提供,并补充微生物生长所需的大量元素和微量元素,具体成分及其质量浓度分别为:CO(NH2)232 mg/L、KH2PO413 mg/L、MgSO4·7H2O 23.9 mg/L、FeCl3·6H2O 7.0 mg/L、CaCl2·H2O 7.6 mg/L、CoSO4·7H2O 0.2 mg/L、ZnCl20.09 mg/L、MnSO4·H2O 0.06 mg/L、CuSO4·5H2O 0.047 mg/L和Na2MoO4·2H2O 0.05 mg/L.其中一个SBR进水中只补充甲醇,为对照组;另一个SBR进水中除补充一定量的甲醇外,再加入质量浓度为10 mg/L的 PCP,为实验组,研究受PCP胁迫的污泥急性毒性和菌群结构,并分析优势菌群对污泥急性毒性的作用.
1.3 指标测定及分析方法
利用pH计和DO计分别测定SBR运行过程中的pH值和DO值.按照文献[14]中的酸性重铬酸钾法测定出水COD的质量浓度:取SBR运行结束后的水相,将其在 4000 r/min 条件下离心5 min后进行测定.采用重量法测定SBR运行期间的MLSS变化:取100 mL充分混匀的泥水混合液,经滤纸(已知质量)过滤后,在105 ℃条件下烘干、称重.利用高效液相色谱仪测定污泥水相、泥相中残留的PCP质量浓度:流动相为超纯水(投加体积分数为1%的乙酸)和甲醇的混合液(二者体积比为28),柱温为40 ℃,进样体积为10 μL,流速为1 mL/min,测试波长为280 nm,固定相为反相C-18柱(250 nm×4.6 nm,5 μm);水相经0.45 μm滤膜过滤后,直接测定其PCP的质量浓度,而泥相需先经超声萃取后,再用滤膜过滤测定其PCP的质量浓度.
1.4 污泥急性毒性的测定方法
参考文献[13],采用发光菌急性毒性生物实验方法测定污泥的急性毒性:实验前用少量灭菌的质量分数为3%的NaCl溶液将明亮发光杆菌T3冻干粉复苏,将复苏的明亮发光杆菌接种到50 mL灭菌培养基(胰蛋白胨 5 g/L、酵母粉 5 g/L、丙三醇 3 g/L、NaCl 30 g/L、Na2HPO45 g/L和KH2PO41 g/L)中进行培养,当明亮发光杆菌处于指数生长期时进行污泥急性毒性的测定;为获得准确的测定结果,需通过超声方式对污泥絮体进行破碎处理;通过生物毒性仪测定明亮发光杆菌可见光强度的变化,利用相对抑光率表征污泥急性毒性的变化,每个样品重复测试3次,取平均值.
1.5 菌群结构分析方法
利用成熟的溶菌酶-SDS-氯仿异戊醇技术对污泥中的基因组DNA进行提取,采用琼脂糖凝胶电泳技术对提取的DNA进行检测.采用的细菌16 S上游扩增引物序列为357-F-GC:5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGG-CACGGGGGGGGCCTACGAGGCAGCAG-3′;下游扩增引物序列为518r:5′-ATTACCGCGGCTGCTGG-3′.依据BioLinker公司的说明书分别进行第一轮和第二轮PCR扩增反应,其扩增产物通过40%~60%的变性梯度凝胶电泳(DGGE)进行分离,电泳参数设置为:电泳缓冲液为TAE缓冲液,电压为80 V,水浴温度为60 ℃,电泳时间为16.5 h,电泳结束后对凝胶进行染色、拍照,并在暗室紫外光激发条件下,用灭菌刀小心切割标记的优势条带.
切割条带的第二次扩增所用引物与第一次相同,只是去掉GC发夹结构,采用AxyPrep DNA凝胶回收试剂盒回收PCR产物,利用 pED-T 载体试剂盒克隆PCR产物.挑选克隆PCR产物,用Amp抗性LB培养基培养,待菌液培养至OD600值为2~3时,对菌液进行PCR扩增,将扩增产物送至上海铂尚生物技术有限公司进行测序,做3次平行实验以保证测序结果的准确度.
通过生物信息学软件对有效的序列进行比对和筛选,去除T载体的引物;将全部序列结果整理为FASTA格式的序列文件,在NCBI中进行BLAST比对;将同一DGGE胶条中的3个克隆测序结果进行alignment分析,检测条带的一致性,并将比对结果中相似性最高的物种信息进行总结.
2 结果与讨论
2.1 进水COD和PCP的去除效果
实验期间,SBR出水COD、PCP质量浓度和MLSS的变化情况分别见图1—图3,其中10 mg/L、0 mg/L和2 mg/L指实验组SBR不同运行阶段的进水PCP质量浓度.实验初期(第1—9 d),由于天气变冷,SBR进水温度逐渐降低,在第6 d时低至14.6 ℃,导致对照组出水COD质量浓度多次超过100 mg/L(见图1).考虑到微生物活性和污染物去除速率受温度影响显著[1],故从第10 d开始,控制2个SBR运行温度为(25±1) ℃,对照组出水COD质量浓度逐渐降低并趋于稳定.从第22 d开始到SBR运行结束,对照组出水COD质量浓度在(85.7±14.0) mg/L的范围内波动,这是因为温度升高会引起污泥中微生物活性的增强,而补充的甲醇属于易降解碳源,导致SBR系统发生了内源呼吸,后续可考虑通过缩短HRT的方式改善进水COD的去除效果.
在第1—20 d期间,进水中的PCP质量浓度为10 mg/L,严重抑制了污泥活性,污泥絮体解体严重,导致上清液浑浊,出水COD质量浓度快速升高,第19 d时达到353.2 mg/L(见图1),MLSS在第20 d时更是降至1.4 g/L(见图3).此阶段的进水PCP基本无降解,水相和泥相中积累了大量的PCP(见图2),这是因为PCP苯环上的π电子与Cl原子的p电子形成了稳定的共轭体系,同时Cl原子的存在抑制了苯环裂解酶的活性,使苯环上的电子云密度较低,再加上PCP的空间位阻效应,导致PCP难以被好氧微生物降解,故PCP废水的处理多以厌氧工艺为主[15].
在第20—33 d期间,实验组SBR进水中停止投加PCP,出水COD质量浓度缓慢下降,由第19 d 的353.2 mg/L降低至第33 d的 198.4 mg/L (见图1),这是因为前期吸附至泥相中的PCP仍存在于SBR,并逐渐释放到水相(见图2)中,导致污泥活性恢复较慢.
在第33—75 d期间,调整实验组SBR进水PCP质量浓度为2 mg/L,其出水COD质量浓度维持在200 mg/L附近;运行周期末(第60—70 d),水相和泥相中均能检测到PCP,其残留量分别为0.38 mg/L和0.81 mg/L,此时活性污泥降解PCP的速率较慢.这可能是由于前期进水中投加的PCP严重抑制了污泥活性,导致后期进水中无论是否投加PCP,污泥活性都难以恢复.在不排泥的情况下,实验组SBR的MLSS一直低于2.0 g/L(见图3),这也再次证实了PCP的毒性作用是导致污泥活性恢复缓慢的主要因素.

图1 2个SBR出水COD质量浓度的变化Fig.1 Variation of effluent COD mass concentration in both SBRs
在下一步的研究中,可利用离子色谱技术分析SBR系统中氯离子质量浓度的变化,采用气质联用或液质联用技术定期分析PCP降解过程中产生的代谢中间产物,为准确推断以甲醇为共代谢碳源的PCP降解路径提供依据.另外,为避免氯酚类化合物对污泥活性的抑制作用,可考虑优先采用低质量浓度的氯酚进水驯化活性污泥,待污泥充分降解去除氯酚类化合物后再逐步提高进水氯酚的质量浓度.

图2 实验组SBR运行周期末水相、泥相中PCP质量浓度的变化Fig.2 Variation of PCP mass concentration in both aqueous and sludge phases at the end of SBR cycle
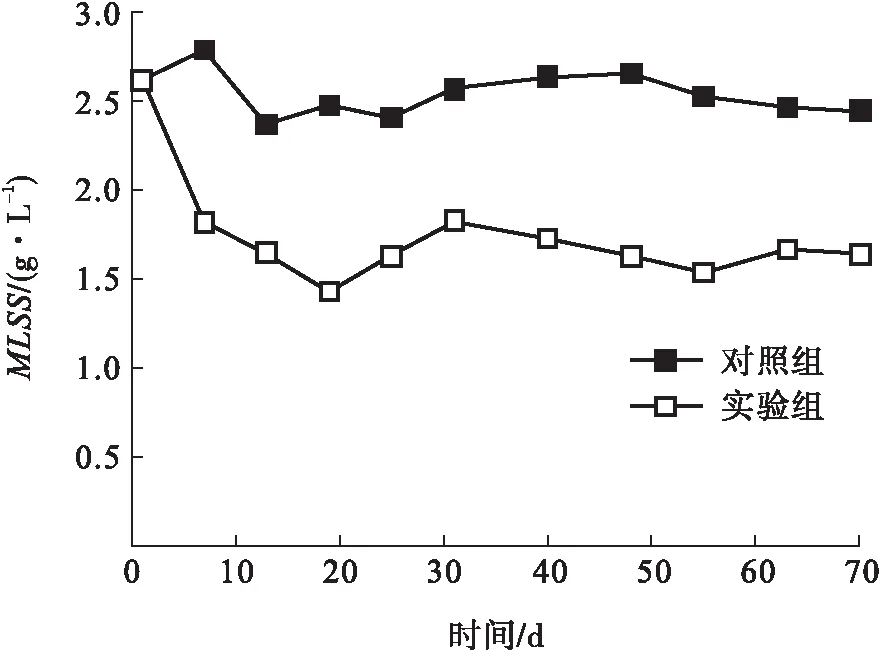
图3 2个SBR中MLSS的变化Fig.3 Variation of MLSS in both SBRs
2.2 PCP处理过程中污泥急性毒性的变化
对处理PCP的实验组污泥急性毒性进行测定,与对照组作对比分析,其动态变化如图4所示.对照组污泥的相对抑光率在25.8%附近波动,这可能是由污泥中微生物代谢过程产生的次级代谢产物和微生物的部分组成成分抑制了发光菌的活性而引起的.
然而,处理PCP的实验组污泥急性毒性显著高于对照组,且整体呈先升高后降低直至趋于稳定的变化规律,两者差值较大的时间范围为第6—41 d,其中最大的污泥急性毒性差值出现在第33 d,是对照组的1.84倍.然而,在此期间,污泥中吸附的PCP质量浓度变化很大(见图2),这表明吸附至泥相的PCP仅仅是引起污泥急性毒性显著的原因之一.在第49—70 d期间,实验组污泥的相对抑光率在35.1%附近波动,是对照组的1.36倍.因此,实验组污泥急性毒性的形成还应包括以下3个方面:一是活性污泥受PCP诱导产生大量的次级代谢产物,其中部分代谢产物会导致污泥急性毒性的增加[16];二是PCP降解过程中产生的不同类型代谢中间产物,会导致污泥急性毒性的增加,如G.Ruckdeschel等[17]研究发现,PCP及其中间产物对多种微生物均有毒性作用,且某些中间产物的毒性比母体要高出许多;三是许多微生物内源呼吸和解体产生的部分残留物被吸附到泥相中,同样具有一定的微生物毒性[18].因此,PCP处理过程中污泥急性毒性的变化是多种因素综合作用的结果.

图4 2个SBR中污泥急性毒性的动态变化Fig.4 Dynamic changes of sludge acute toxicity in both SBRs
2.3 菌群结构对污泥急性毒性的影响
当处理PCP废水的SBR运行70 d后,通过PCR-DGGE技术分析污泥中的菌群结构,并对优势条带进行鉴定,结果见图5(图中不同数字代表鉴定出的不同优势菌群)和表1.部分优势条带的3个平行样并不代表单一菌种(条带1和3),这可能是由于鉴定的目的条带附近含有相邻的低亮度条带或者不同菌属的DNA条带出现了共迁移现象[19].活性污泥中耐受PCP毒性的优势菌属大都出自变形菌门(Proteobacteria)(条带1、2、4、5和6),主要菌属为Methylobacillus、Pseudomonas、Porphyrobacter、Achromobacter、Stenotrophomonas和Comamonas,其次为绿弯菌门(Chloroflexi)(条带3)和厚壁菌门(Firmicutes)(条带7),其菌属分别为Levilinea和Salimesophilobacter.然而,对照组鉴定的优势菌属主要为Chryseobacterium、Leadbetterella、Erysipelothrix、Pontibacillus、Bosea和Salimesophilobacter[20],这表明污泥的菌群结构受进水PCP的影响较大.相关研究已证实由实验组污泥鉴定的大多优势菌属均具有降解去除氯酚类化合物和多环芳烃的功能,如Pseudomonasentomophila、Achromobactermarplatensis、Stenotrophomonasmaltophilia和Comamonastestosterone[21].

图5 实验组SBR污泥的PCR-DGGE图Fig.5 The gel image of PCR-DGGE from the acclimated SBR

表1 鉴定的优势条带所属菌属和门类Table 1 The genus and phylum from the identified dominant bands
受污染物胁迫,Methylobacillusarboreus、Pseudomonasentomophila、Comamonastestosteroni和Stenotrophomonasmaltophilia可分泌多种次级代谢产物,其中抗生素和不同种类的生物活性因子可能会起到增加污泥急性毒性的作用,而其他次级代谢产物,如表面活性剂和谷胱甘肽转移酶,可降低氯酚类化合物对微生物的毒害作用[22-25];Achromobactermarplatensis能够降解高质量浓度的PCP,并具有抗生素活性[26];Porphyrobactercolymbi和Levilineasaccharolytica是否具有降解氯酚类化合物的功能,以及是否对污泥急性毒性有影响需进一步确定.相关分析表明,降解PCP的优势菌群在代谢过程产生的次级代谢产物是引起污泥急性毒性不可忽视的重要因素[20].
3 结论
本研究利用间歇曝气的SBR处理PCP废水,设置仅以甲醇为碳源的对照组,研究PCP对污泥急性毒性和菌群结构的影响,并深入分析了优势菌群对污泥急性毒性的作用.得到以下主要结论:1)进水中的PCP(质量浓度为10 mg/L)严重抑制了污泥活性,污泥絮体解体现象严重,进水COD和PCP难以被降解去除,即使后期进水PCP质量浓度降低或不再投加,污泥活性仍旧难以恢复;2)进水中的PCP导致污泥急性毒性显著增加,而污泥急性毒性的升高不仅是由吸附至污泥的PCP引起,PCP降解过程产生的代谢中间产物及诱导微生物分泌的次级代谢产物也是引起污泥急性毒性的重要因素;3)经PCP驯化的活性污泥中富集的优势菌属具有降解去除氯酚污染物的能力,优势菌种代谢过程分泌的次级代谢产物可影响污泥的急性毒性.依据本文研究结果,在利用活性污泥工艺处理工业废水时,剩余污泥的急性毒性是不可忽略的问题.后续可通过选取合适的废水处理工艺或调整其运行参数等措施削减污泥的急性毒性作用.
