酶法催化紫苏油和MCT合成中长链甘油三酯研究
2021-02-01黄昭先王满意孙承国王风艳王翔宇江连洲
黄昭先 王满意 孙承国 王风艳 王翔宇 江连洲
(1.中粮营养健康研究院, 北京 102209; 2.营养健康与食品安全北京市重点实验室, 北京 102209;3.中粮油脂专业化公司研发中心, 天津 300452; 4.东北农业大学食品学院, 哈尔滨 150030;5.临邑禹王植物蛋白有限公司, 德州 253000)
0 引言
紫苏油是从紫苏中提取的一种植物油,富含α-亚麻酸(ALA,C18:3)[1]。紫苏油中ALA含量最高,约占其总脂肪酸的60%[2]。ALA是ω-3多不饱和脂肪酸,是某些必需脂肪酸如二十二碳六烯酸(DHA)、二十碳五烯酸(EPA)的代谢前体[3]。已证明,这些ω-3系列脂肪酸对人体健康具有生理益处,并且在预防和治疗心血管疾病和炎症性疾病中起到重要作用[4]。但是,紫苏油是一种长链脂肪酸(LCFA,碳原子数超过14的脂肪酸),其对应的甘油三酯在血清中水解和清除速率相对较慢,不利于人体健康[5]。
中长链甘油三酯(MLCT)是一种功能性结构脂质,在营养代谢方面优于传统的长链甘油三酯(LCT)和中链甘油三酯(MCT)。MLCT可以降低人体的血清甘油三酯和胆固醇含量,并抑制体内脂肪的积累[6]。此外,MLCT还可以克服MCT的缺点,既可为人体提供必需的脂肪酸和能量供应[7],也可避免因体内酮体过多而导致的中毒。MLCT可以通过酸解、酯化和酯交换等酶促方法进行制备[8-10]。酶促酯交换是生产结构化脂质(SLs)的一种优选方法,酯交换产物中副产物含量低,且合成的产物得率较高。因此,结合脂肪酶催化的优点和ALA的营养优势对MLCT进行合成具有重要意义。
近年来,均衡摄入脂肪酸受到广泛关注,专业人士建议,每日需摄入一定量的ω-6和ω-3脂肪酸[11-12]。针对MLCT的研究主要使用富含ω-6或ω-9脂肪酸的植物油作为长链甘油三酯的来源[13-15]。ω-3脂肪酸的食物来源有限,某些海洋鱼油富含ω-3脂肪酸,但其氧化稳定性较差,并且从长远来看,海洋资源的使用不可持续[16]。紫苏油是ω-3脂肪酸含量最高的植物油,成为合成MLCT的优质来源。
本文通过Lipozyme RM IM催化紫苏油与MCT进行酯交换合成富含α-亚麻酸的中长链甘油三酯(MLCT),研究酶添加量、底物中MCT浓度、反应温度和反应时间对MLCT得率的影响,采用两步法除臭去除游离脂肪酸(FFA)、甘油二酯(DAG)和甘油一酯(MAG)等副产物,以避免反式脂肪酸的大量形成,为多不饱和油的物理脱酸提供借鉴。
1 材料与方法
1.1 材料与试剂
紫苏油、活性白土,中粮东海粮油工业(张家港)有限公司;MCT,印度尼西亚Musim Mas公司;Lipozyme RM IM(来自Rhizomucormiehei的脂肪酶,275 IUN/g),诺维信(中国)生物技术有限公司;甘油一酯、甘油二酯和甘油三酯的标准混合物、猪胰脂酶(100~400 U/mg)、脂肪酸甲酯,西格玛奥德里奇(上海)贸易有限公司;乙酸、正己烷和异丙醇均为色谱级,上海阿拉丁有限公司;硅胶GF预涂板(10 cm×20 cm),上海国药控股化学试剂有限公司;其他试剂和溶剂均为分析纯。
1.2 仪器与设备
GC-2014C型气相色谱仪,日本岛津有限公司;7890A型气相色谱仪,美国安捷伦科技有限公司;1260 Infinity型高效液相色谱仪,美国安捷伦科技有限公司;Ace-2L型(定制)精炼小试装置,美国ACE公司;PL2002型电子天平、AL204-IC型分析天平,梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1酯交换反应
紫苏油和MCT的酯交换反应在无溶剂体系中进行。将150 g紫苏油和MCT置于250 mL烧瓶中,使用机械搅拌器以200 r/min搅拌混合。在一定温度下添加脂肪酶并开始计时,反应一段时间。反应结束后过滤除去酶,所有产物均存储在-20℃等待分析。
1.3.2薄层色谱(TLC)分离甘油三酯
将10 μL油样品溶于10 μL正己烷中,在距TLC板底部2 cm水平线上点样,将TLC板底部浸入由正己烷/叔丁基甲基甲醚/乙酸(体积比40∶10∶1)组成的溶剂体系120 min。随后取出TLC板并干燥,将2,7-二氯荧光素乙醇溶液(2 g/L)喷雾到TLC板上,在紫外灯下观察分离情况。刮下对应的甘油三酯(TAG)区域,然后用正己烷萃取得到甘油三酯。
1.3.3甘油三酯中MLCT的得率
通过气相色谱法测定甘油三酯中MLCT的得率。气相色谱条件如下:DB-1型毛细管柱(15.0 m×0.53 mm×0.15 μm,美国安捷伦公司),FID(氢离子火焰化)检测器,进样量5 μL,高纯氢气作为载气,入口温度350℃,检测器温度380℃,非分流模式,氢气流速40 mL/min,空气流速400 mL/min,补充气流速25 mL/min。柱温箱程序如下:初始温度200℃,以10℃/min的速度升至300℃,保持2 min;以3℃/min的速度升至330℃。酯交换后的甘油三酯包含以下构型:MMM、MLM、LMM、LLM、LML和LLL。其中,MLM、LMM、LLM和LML称为MLCT。甘油三酯上脂肪酸的总碳数(TCN)由气相色谱确定,MMM的TCN为24~30,MLM和LMM(称为2M1L)为32~38,LLM和LML(称为1M2L)为40~46,LLL为48~54。MLCT得率计算公式为
式中AMMM——MMM质量分数,%
AMLM——MLM质量分数,%
AMML——MML质量分数,%
ALLM——LLM质量分数,%
ALML——LML质量分数,%
ALLL——LLL质量分数,%
1.3.4精炼
脱色:取一定量的酯交换油进行脱色处理,真空条件下(真空度小于0.533 kPa),将酯交换油加热至90℃,加入一定量的活性白土,加热至100℃,200 r/min搅拌30 min,抽滤除去活性白土,得到脱色油。
脱臭:将一定量脱色油加入到定制脱臭装置中,抽真空,保持整套设备内部真空度小于0.4 kPa,除臭温度和时间参数有3种:两步法,首先在200℃下保持40 min,然后加热到240℃并保持20 min;低温法:在200℃保持60 min; 高温法,在240℃保持60 min。脱臭后,除臭系统迅速冷却至100℃以下。脱臭过程中的水蒸气由储水管中的水在设备的真空条件气化形成,通入油样中翻滚沸腾,并在真空的条件下被带出,在-40℃冷肼中迅速冷冻。
1.3.5脂肪酸组成和sn-2脂肪酸分析
油样首先作甲酯化处理,将1.5 mL氢氧化钾甲醇溶液(0.5 mol/L)加到样品中,在70℃下混合5 min,加入2 mL三氟化硼甲醇溶液(体积分数14%)并振摇3 min,然后加入1 mL正己烷和1 mL饱和氯化钠溶液,以提取脂肪酸甲酯,取上层清液进样。气相色谱条件:Agilent HP-88型毛细管柱(100 m×250 μm×0.25 μm),进样口温度250℃;检测器温度280℃;载气:高纯度氢气;分流比50∶1;进样2.0 μL。柱温箱程序:初始温度45℃,保持4 min,以13℃/min升至175℃,保持27 min,以4℃/min升至215℃,保持35 min。
利用猪胰脂酶将酰基甘油催化生成sn-2甘油一酯。主要步骤如下:将10 mg样品、7 mL的Tris-HCl缓冲液(1 mol/L,pH值8.0)、2 mL胆酸钠溶液(0.5 g/L)、1 mL的CaCl2(22 g/L)和50 mg胰脂酶在40℃下涡旋混合3 min,加入1 mL的HCl溶液(6 mol/L)和2 mL乙醚,涡旋混合1 min,在4 000 r/min下离心10 min。收集上层液并将其均匀涂于TLC板底部上方2 cm的水平线上。分离sn-2甘油一酯的TLC方法与上述方法相同。刮下sn-2甘油一酯条带,用正己烷萃取后进行脂肪酸组成分析。
1.3.6甘油酯成分分析
通过HPLC-ELSD(高效液相色谱-蒸发光检测器)对甘油酯成分进行定量分析。将样品溶解于正己烷中稀释至10 mg/mL,进样。色谱条件:Zorbax RX-Sil型色谱柱(5 μm×4.6 mm×250 mm);柱温35℃;ELSD漂移管温度70℃;雾化气体:高纯氮气;载气压力0.21 MPa;增益1倍;进样量1.5 μL;流动相:A为正己烷/异丙醇(体积比99∶1),B为正己烷/异丙醇/乙酸(体积比100∶100∶1);流动相洗脱梯度:100%A(0 min)-80%A(10 min)-70%A(14 min)-100%A(20 min)-100%A(25 min)。甘油三酯、游离脂肪酸、1,3-甘油二酯、1,2-甘油二酯、甘油一酯的保留时间分别为3.9、5.3、6.2、7.6、14.9 min。根据浓度和峰面积制定标准曲线以供使用。
1.4 数据处理和分析
每个实验均进行3次重复平行实验,结果表示为平均值±标准差。使用SPSS 19.0对数据进行ANOVA差异显著性分析,以p<0.05为显著性差异。采用Origin 8.0软件制图。
2 结果与讨论
2.1 酯交换条件对反应产物的影响
2.1.1酶添加量
将不同添加量的脂肪酶(2%、4%、6%、8%、10%、12%)加入到MCT质量分数40%的反应底物中,在50℃下反应4 h。如图1a所示,MLCT得率随着酶添加量的增加而逐渐增加,反应得率在61%~76%之间,当酶添加量超过6%时,MLCT得率的增加变慢,这可能是由于过量的酶导致酶聚集和底物的扩散,从而抑制了酶的活性[17]。MLCT所含的1M2L(1中链,2长链甘油三酯)和2M1L(2中链,1长链甘油三酯)的趋势与MLCT相似。尽管较高的酶添加量有助于提高反应速率,但也使反应的成本增加[18-19]。由图1b可知,随着酶添加量的增加,甘油一酯(MAG)、甘油二酯(DAG)和游离脂肪酸(FFA)等反应副产物也有所增加,它将影响产品的最终得率和后续加工。ALA总含量随着脂肪酶含量的增加而降低,而sn-2中的ALA含量则升高。酶添加量增加会促进酯交换反应,将更多的中链脂肪酸(MCFA)引入TAG[20],导致ALA含量降低。这可能与在脂肪酶催化的酯化过程中发生的酰基迁移有关[21]。ALA酰基从sn-1或sn-3迁移至sn-2,导致反应朝着MLM型或MLL型MLCT进行。有研究表明长链脂肪酸位于sn-2时MLCT被人体吸收的效率更高[22]。
2.1.2底物中MCT质量分数
以6%脂肪酶催化底物在50℃下反应4 h,MCT在底物中的质量分数分别为20%、25%、30%、35%、40%、45%、50%、55%、60%、65%和70%。结果如图2a所示,MCT在底物中的质量分数小于40%,MLCT得率随MCT浓度的增加而增加,当MCT质量分数超过40%时MLCT得率下降,1M2L和2M1L的产量也具有先升后降的趋势,类似于MLCT,但是1M2L得率在MCT质量分数25%时达到最大,2M1L得率在MCT质量分数60%时达到最大。因此,MCT的浓度不仅影响MLCT的得率,而且还影响MLCT中1M2L和2M1L的不同比例,过量的MCT更有可能形成2M1L,而过量的LCT更可能形成1M2L。MCT的浓度对副产物没有明显的影响,随着MCT浓度的增加,紫苏油在底物中的相对含量降低,ALA含量降低(图2b)。
2.1.3反应温度
以6%脂肪酶催化MCT质量分数为40%的底物,在不同温度(30、40、50、60、70、80、90℃)下反应4 h。结果如图3a所示,MLCT的得率随着温度升高而提高,在60℃以后得率提升不明显,但是由图3b可知,TAG得率增加,副产物减少。一般认为,随着温度升高到一定程度,脂肪酶的活性受到抑制[23],但是本实验中Lipozyme RM IM可以耐受高温,并在一个较广的温度范围内保持活性。随着温度的升高,ALA的总含量先升高后降低,而sn-2上的ALA含量升高(图3b)。
2.1.4反应时间
以6%脂肪酶催化MCT质量分数为40%的底物,在50℃下反应不同时间(0.5、1、2、4、6、8、10、12、14 h)。由图4a可知,随着反应的进行,MLCT的得率提高,并在4 h达到平衡,1M2L和2M1L得率的变化与MLCT的变化相似。如图4b所示,副产物随着反应时间的增加而增加,这将导致产物质量下降和精炼成本增加。延长反应时间有助于酯交换反应达到平衡,将中链脂肪酸引入TAG,但也可能会因为酰基迁移而降低了ALA总含量并增加了sn-2 ALA含量。
2.2 酯交换油脂精炼
2.2.1甘油酯和脂肪酸含量的变化
在酶促酯交换过程中会产生许多副产物,例如FFA、DAG和MAG[20]。因此,本研究中减小副产物尤其是游离脂肪酸也是一项重要的目标。酯交换条件如下:酶添加量6%,底物中MCT质量分数40%,反应温度60℃,反应时间4 h。酯交换油脂后的结果如图5(图中同种物质不同字母表示差异显著)所示,其中TAG显著降低至92.00%,DAG、MAG和FFA含量显著增加,其中FFA质量分数为6.29%;酯交换油脂经过精炼、两步法除臭、低温脱臭和高温脱臭后TAG含量显著增加,其质量分数分别为98.31%、96.94%和98.47%;MAG和FFA含量显著下降,低温除臭后的FFA质量分数为1.44%,远高于两步法脱臭和高温除臭,这表明低温不能有效去除游离脂肪酸。此外,精炼油中还含有大量的多不饱和脂肪酸,如亚油酸和亚麻酸,它们不稳定并可能会在高温下转化为反式脂肪酸(TFA)[24]。由图5可知,高温脱臭促进了TFA的形成,质量分数为10.27%,显著高于两步法脱臭(0.93%)和低温除臭(0.56%)。在两步法除臭过程中,第1步(200℃,40 min)除去沸点较低的FFA,例如MCFA,第2步(240℃,20 min)除去沸点较高的长链脂肪酸,如亚油酸和亚麻酸。由于在高温下该过程的持续时间短,TFA的形成有限。两步法脱臭结合了高温除臭和低温除臭的优点,它不仅可以去除FFA,而且可以限制TFA的产生。另外,与化学法脱酸相比,两步法物理脱臭可以纯化酯交换产物并减少中性油的损失[25],并且比使用85%乙醇作为萃取溶剂的阴离子交换树脂纯化方法更加高效[26]。
2.2.2精炼产品中的脂肪酸组成
在脂肪酶的催化下,MCT中的辛酸和癸酸,紫苏油中的油酸、亚油酸、亚麻酸和其他长链脂肪酸参与酯交换反应,这些脂肪酸在甘油酯中的位置将会重新排列。精炼可以部分除去反应过程中形成的FFA、MAG和DAG,因此精炼产品中的脂肪酸组成会发生变化。与物理混合物相比,酯交换油脂精炼产品的LCFA和亚麻酸含量显著增加,α-亚麻酸质量分数高达44.88%,MCFA含量显著降低(表1)。同时,在sn-2位置,LCFA和亚麻酸含量明显增加,其质量分数分别为88.8%和59.72%,MCFA含量明显减少。精炼产品中MLCT大部分为LLM、MLL和MLM,而少数为LML、LMM和MML。据报道,MCFA在sn-1,3位置、LCFA在sn-2位置的甘油三酯可以提高LCFA的吸收率,改善吸收不良的情况[27]。
2.2.3甘油三酯组成的变化
酯交换作用发生的变化主要体现在甘油三酯组成上的变化。如图6和表2所示,反应后MCT和LCT显著减少,形成MLCT(包括2M1L和1M2L)。在60℃下,MCT质量分数40%的底物在6%的酶催化下反应4 h,达到反应平衡后,甘油三酯中MLCT的质量分数为74.95%。
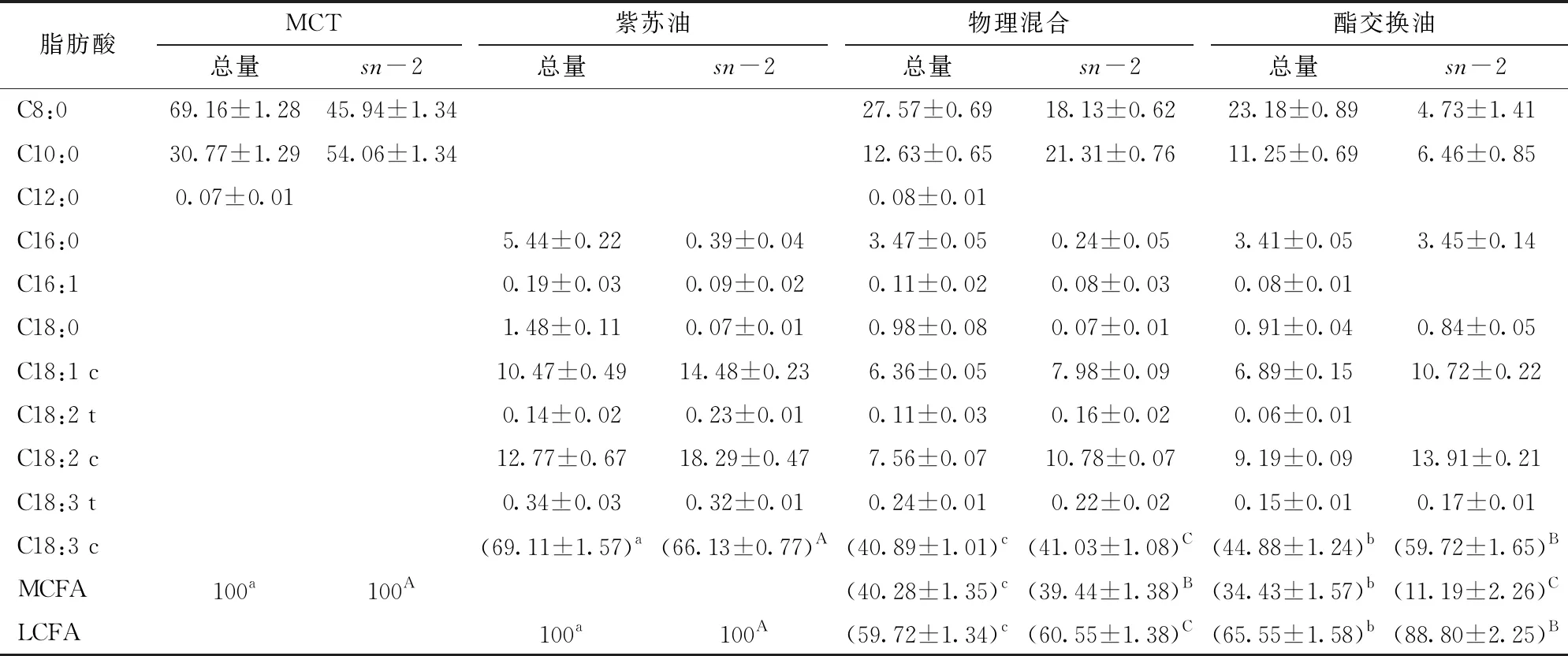
表1 紫苏油、MCT、物理混合油和酯交换油的脂肪酸质量分数Tab.1 Fatty acids composition of perilla oil, MCT, physical blend and purified products %
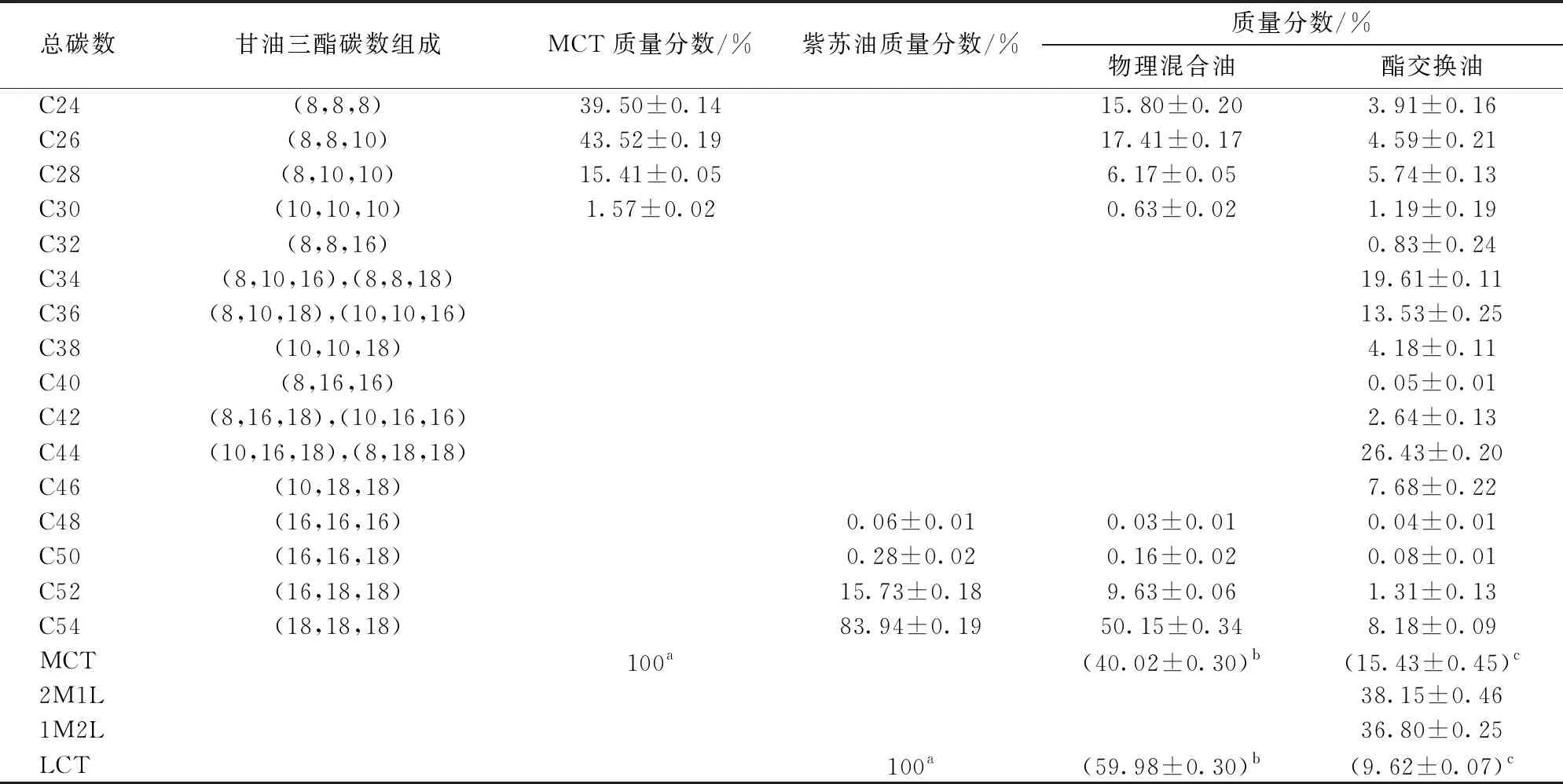
表2 紫苏油、MCT、物理混合油和酯交换油的质量分数和甘油三酯碳数组成Tab.2 Triacylglycerols composition of perilla oil, MCT, physical blend and purified products
3 结束语
40%MCT和60%紫苏油在6%的Lipozyme RM IM催化作用下,于60℃进行了4 h的酯交换反应,结果显示甘油三酯中MLCT的得率高于70%。采用两步法脱臭纯化酯交换反应产物,结果表明,去除游离脂肪酸的效果明显,在纯化产物中甘油三酯可以达到97%,并且反式脂肪酸质量分数控制在1%以内,α-亚麻酸质量分数大于40%,sn-2位置上85%为长链脂肪酸。
