接种松材线虫对樟子松生理指标的影响
2021-01-30尹大川邓玉侠祁金玉陈凤毛郝德君谈家金孙守慧
尹大川,邓玉侠,祁金玉,陈凤毛,郝德君,谈家金,孙守慧
(1.沈阳农业大学 林学院,沈阳110161;2.辽宁生态工程职业学院实验林场,辽宁 抚顺113300;3.南京林业大学 林学院,南京210018)
松材线虫病(Pine wilt disease)又称松树萎蔫病,是由松材线虫(Bursaphelenchus xylophilus)侵染松科植物所引发的一种以整株枯死为典型症状的毁灭性森林病害[1]。自1982 年我国在南京中山陵首次发现以来,该病不断扩展蔓延,造成松树(Pinus spp.)的大量死亡,成为近几十年来我国发生最严重、危害面积最广的重大林业病害[2]。该病蔓延速度极快,染病后松树的死亡率极高,因此被称为“松树的癌症”[3]。 现已成为我国林业生产的巨大威胁,严重危害着森林生态安全,是我国当前林业生产的头号大敌[4-6]。
到目前为止,松材线虫病在我国自然感染的松树种类有16 种。 其中,辽宁地区的寄主以油松(P.tabuliformis)、红松(P.koraiensis)、落叶松(Larix spp.)和樟子松(P.sylvestris var.mongolica)为主[7]。 樟子松作为我国北方的主要造林树种,其在我国北方地区,尤其在辽宁西北地区的防风固沙中发挥着重要作用[8-9]。 有研究表明,3 年生樟子松苗木在人工接种松材线虫后可在25d 死亡[10]。 但其在感染松材线虫之后的相关指标变化规律,相关研究尚未报道。 因此,对于辽西北地区樟子松在接种松材线虫后,相关抗病性指标的变化规律研究十分必要。
活性氧(ROS)是一种重要的信号分子,具有细胞毒性。 当植物体遭遇外来生物和非生物胁迫时,会产生大量的ROS 分子[11]。 不同的环境胁迫同时也会影响植物的生长过程,进而使植物产生一定的应激响应[12]。 在众多响应机制中,抗氧化酶系统(包括过氧化氢酶CAT、过氧化物酶POD 和超氧化物歧化酶SOD),抗病相关代谢产物(如黄酮类化合物),光合色素等物质的变化既能表明植物对病原物的抵抗能力,也能评价该植物的抗病性强弱[13]。
本研究以辽宁西部地区4 年生樟子松为研究对象,通过对其进行松材线虫接种,并观测其光合色素含量、抗氧化酶活性、抗逆性相关代谢产物的变化规律,解析各指标在防御反应中的动态变化特征,以期为阐明辽西地区樟子松对松材线虫的抗性机制提供理论依据。
1 材料与方法
1.1 供试植株和接种
松材线虫分离自辽宁省沈阳市沈河区东陵公园感病油松,现保存于沈阳农业大学森林病理实验室。 4 年生樟子松实生苗购自辽宁省沙地治理与利用研究所。在天气晴好、气温维持在30℃时接种,接种时间为2019 年6月15 日。接种时采用斜切接种法:在当年生枝条结节5cm 处,沿枝干斜切入木质部,切口深2mm、长3cm。迅速将线虫悬浮液200μL(含10000 头线虫)均匀注入切口处。对照组注入等量蒸馏水,每种处理10 株。接种后进行正常管理。
1.2 取样及检测方法
为检测不同时间松材线虫侵染后樟子松的生理响应,在接种后第0,10,20,30 天时,取距离接种口位置相同位置的当年生嫩枝针叶,每个时间点取同一植株的3 处作为重复。 采集的嫩叶立即投入液氮中置于-80℃冰箱中保存。第30 天时,在接种口上、下方各2~5cm 的茎段,剪碎后利用贝尔曼漏斗法分离松材线虫[14],统计该时间点的松材线虫数量。
1.3 相关指标测定
光合色素采用丙酮-乙醇研磨法[15]。 抗氧化酶活性采用南京建成公司的酶活检测试剂盒,按照说明书进行操作。黄酮类化合物采用紫外分光光度计法[15]。可溶性蛋白采用考马斯亮蓝G-250 法[16]。丙二醛(MDA)含量采用硫代巴比妥酸法[17]。
1.4 数据处理
利用Excel 2010 进行数据处理,并用Graphpad Prism 7.0 进行双因素方差分析与绘图。
2 结果与分析
2.1 樟子松梁病症状观察
对接种后苗木进行正常管理。在第10 天时接种苗木开始出现针叶枯黄、干枯等症状,少数苗木出现梢部倒头(图1A)。 针叶围绕接种部位开始逐渐变黄、干枯(图1B)。 随着时间的推移,针叶枯萎面积逐渐扩大,并逐步向全株扩展,试验结束时,树木尚未完全死亡。
接种松材线虫第30 天,围绕在接种部位的上部和下部均分离检测到松材线虫。 不同部位的松材线虫数量存在一定的差异, 其中,接种口下方茎段中松材线虫多于上部,但无显著差异(图2)。

图1 樟子松苗木发病症状(第10 天)Figure 1 Symptom of seedling of P.sylvestris var.mongolica seedlings (Day 10)
2.2 接种松材线虫后樟子松针叶内光合色素的动态变化
由图3A 可知,接种后,叶绿素a 含量开始下降,对同一时间点不同处理间樟子松针叶内叶绿素a 含量进行方差分析,发现第30 天,叶绿素a 的含量与对照组达到极显著差异水平(p<0.01),接种处理比对照低38.6%。双因素方差分析结果表明,时间[F(1,16)=11.21]和接种[F(3,16)=5.854]对试验结果均有显著影响,但二者无交互影响[F(3,16)=3.002](表1)。 由图3B 可知,接种后,叶绿素b 含量开始下降,在第10 天,叶绿素b 的含量与对照组达到极显著差异(p<0.01);到第30 天,接种处理与对照组达到极显著差异水平(p<0.01),接种处理比对照降低50.9%。 双因素方差分析结果表明,时间[F(1,16)=70.69]和接种[F(3,16)=46.72]对试验结果均有显著影响,而且二者交互影响显著[F(3,16)=9.307](表1)。 该结果表明接种松材线虫对樟子松的生长产生了严重的影响。

图2 樟子松苗木线虫数量(第30 天)Figure 2 The number of nematodes in P.sylvestris var.mongolica seedlings (Day 30)
2.3 接种松材线虫后樟子松针叶内抗氧化酶的动态变化

图3 樟子松苗木光合色素含量变化Figure 3 Content of photosynthetic pigment in P.sylvestris var.mongolica seedlings

表1 樟子松苗木光合色素含量方差分析Table 1 Variance analysis of photosynthetic pigment content in P.sylvestris var.mongolica seedlings
由图4 可知,接种线虫后,苗木CAT 活性即开始上升,对同一时间点不同处理间樟子松针叶内CAT 活性进行方差分析,结果表明,第10 天即与对照组相比达到显著差异水平(p<0.01),随着时间的推移,继续上升,第20 天时达到最大,与对照组相比达到极显著差异水平(p<0.01),此时接种处理比对照组CAT 活性提高890%。第30 天时,酶活性下降,但仍然达到极显著差异水平(p<0.01)。对照组CAT 活性无显著变化(图4A)。双因素方差分析结果表明,时间[F(1,16)=1074]和接种[F(3,16)=554.6]对试验结果均有极显著影响,二者交互影响也极显著[F(3,16)=597.5](表2)。与CAT 变化规律类似,接种线虫后,苗木POD 活性即开始上升,对同一时间点不同处理间樟子松针叶内POD 活性进行方差分析,结果表明,在第10 天即上升至最高点,酶活性比对照组高373%,且与对照组相比达到极显著差异水平(p<0.01)。 随着时间的推移,POD 活性开始下降,在第30 天下降至最低,但与对照组仍然存在显著差异(p<0.01)。对照组POD 活性无明显的变化(图4B)。双因素方差分析表明,时间[F(1,16)=527.9]和接种[F(3,16)=160.6]对试验结果均有极显著影响,二者交互影响也极其显著[F(3,16)=193.7](表2)。 SOD 变化规律与的变化规律略有不同,接种线虫之后,SOD 活性开始上升,随后下降,但下降幅度不明显,且在整个试验过程中,接种处理与对照相比SOD 活性均达到极显著差异水平(p<0.01)(图4C)。 双因素方差分析结果表明,时间[F(1,16)=780.7]和接种[F(3,16)=125.4]对试验结果均有极显著影响,二者交互影响也极显著[F(3,16)=110.6](表2)。

图4 樟子松苗木抗氧化酶活性变化Figure 4 Activities of antioxidant enzyme in P.sylvestris var.mongolica seedlings

表2 樟子松苗木抗氧化酶活性方差分析Table 2 Variance analysis of antioxidant enzymeactivities in P.sylvestris var.mongolica seedlings
2.4 接种松材线虫后樟子松针叶内渗透调节物质及黄酮含量的动态变化
接种线虫后,苗木可溶性蛋白含量开始上升,方差分析表明, 第10 天即与对照组相比达到极显著差异水平(p<0.01),随着时间的推移,开始下降,第30 天时下降到最低,但与对照组相比未达到显著差异(p>0.05)(图5)。双因素方差分析结果表明,时间[F(1,16)=0.1687]对试验结果无显著影响,但接种线虫[F(3,16)=10.4]对试验结果均有显著影响, 二者交互影响显著[F (3,16)=10.36](表3)。
接种线虫后,苗木MDA 含量开始上升,表明松材线虫胁迫对樟子松细胞造成了较大的破坏(图6)。 对同一时间点不同处理间樟子松针叶内MDA 含量进行方差分析,结果表明,在第10 天即与对照组相比达到极显著差异水平(p<0.01),随着时间的推移,在第20 天达到最高,此时比对照组高449%,达到极显著差异水平(p<0.01)。 随后开始下降,在第30 天时下降到最低,但与对照组相比依然存在极显著差异(p<0.01)(图6)。 双因素方差分析结果表明,时间[F(1,16)=663.6]和接种[F(3,16)=124]均对试验结果有显著影响,二者交互影响显著[F(3,16)=122.9](表3)。

图5 樟子松苗木可溶性蛋白含量变化Figure 5 Content of soluble proteinin P.sylvestris var.mongolica seedlings

表3 樟子松苗木渗透调节物质和黄酮方差分析Table 3 Variance analysis of osmotic adjustment substances and flavone in P.sylvestris var.mongolica seedlings
接种线虫后,苗木黄酮含量开始上升,表明松材线虫胁迫后樟子松苗木出现较大的应激反应,产生大量的黄酮类化合物来抵御病原入侵, 先上升后下降的变化趋势可能的原因为苗木在试验后期生命活动降低所造成黄酮含量下降(图7)。 对同一时间点不同处理间樟子松针叶内黄酮含量进行方差分析,结果表明,在第10,20和30 天与对照组相比均达到极显著差异水平(p<0.01),随着时间的推移,在第20 天达到最高,此时比对照组升高450%。 随后开始下降,在第30 天时仍与对照组相比依然存在极显著差异(p<0.01)(图7)。 双因素方差分析结果表明,时间[F(1,16)=3657]和接种[F(3,16)=1176]均对试验结果有显著影响,且二者交互影响显著[F(3,16)=904.8](表3)。
3 讨论与结论
松材线虫病是目前林业发展所面临的头等大敌。松材线虫入侵后,一般会对松树的生长产生极其不良的影响,导致松树萎蔫甚至死亡[18-19]。樟子松作为东北地区的主要防风固沙树种,在东北地区尤其是辽宁西部地区的生态安全和环境保护中发挥着重要作用,其安全性直接关乎辽宁西部的国土安全。 目前,已有报道樟子松发生自然感病[7],但对于其在人工接种条件的发病症状及生理响应的研究仍然具有十分重要的意义。有研究表明,病原体胁迫会对植物的叶绿素含量产生消极地影响。 本研究中,接种松材线虫可以抑制叶片中叶绿素合成。 樟子松接种后,叶绿素a 和叶绿素b 的含量随着时间的推移均呈下降趋势,这个结果与整个发病过程中针叶逐步出现枯黄的叶色变化一致。 这一现象与何龙喜等[20]不同松树感染松材线虫研究的结果一致。
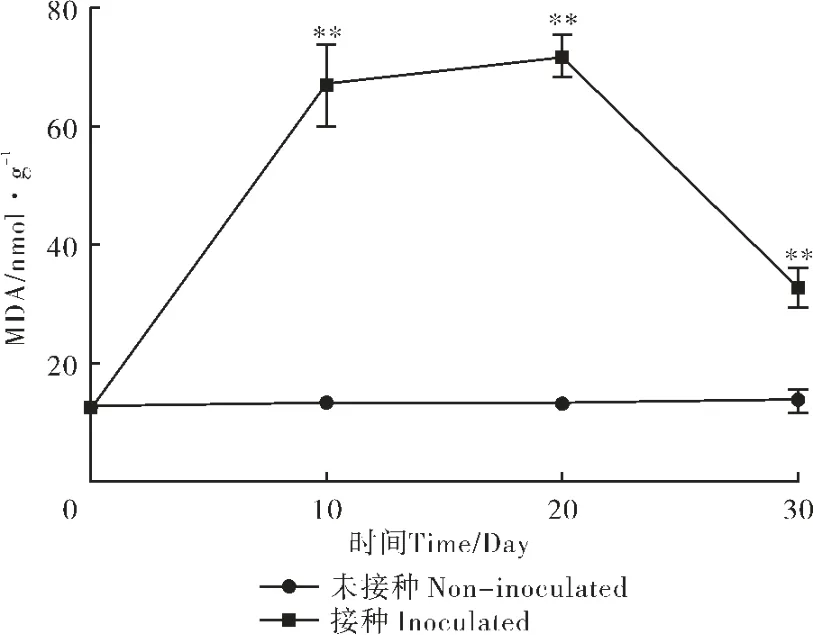
图6 樟子松苗木MDA 含量变化Figure 6 Content of MDAin P.sylvestris var.mongolica seedlings

图7 樟子松苗木黄酮含量变化Figure 7 Content of flavonein P.sylvestris var.mongolica seedlings
植物在受到病原物胁迫时会产生大量的活性氧(ROS),ROS 积累造成细胞内部产生大量H2O2,进而毒害细胞。 俞禄珍等[21]研究表明,黑松受到松材线虫侵染后,体内产生大量的H2O2,破坏细胞结构。 何龙喜等[22]对不同抗性树种感染松材线虫后针叶内H2O2含量进行分析, 发现感病树种后针叶内H2O2含量显著高于高度抗病树种,说明松树抗线虫能力越强,其ROS 的去除能力也越强,也就是说其抗氧化酶活性越强。 CAT、POD 和SOD是植物体内主要的抗氧化环境胁迫的酶系,通过它们的变化程度可以反映植物的抗逆性强弱[23]。MDA 是细胞膜质过氧化的主要产物,具有细胞毒性,该物质的含量变化情况可以衡量细胞膜系统被破坏的程度[24-25]。很多研究发现,在生物胁迫条件下,植物细胞内的抗氧化酶活性有所升高,MDA 含量上升[26]。 本研究中,3 种抗氧化酶活性均出现先升高后下降的变化趋势,MDA 含量呈现上升-平稳-下降的趋势。此结果表明,松材线虫对樟子松苗木造成了胁迫,产生大量的ROS,致使苗木抗氧化酶活性升高用以去除多余的ROS。 但随着时间的推移,苗木受松材线虫胁迫致使生长势逐渐下降,致使酶活性和MDA 含量降低。 保护酶活性和MDA 的变化,表明樟子松受松材线虫胁迫后,显著加剧了樟子松针叶细胞膜过氧化程度,导致细胞膜被破坏,针叶内细胞内容物外露、崩解,使植株趋于死亡。
可溶性蛋白是植物细胞内主要的渗透调节物质,它的变化可以反映细胞内蛋白质的合成、变性及降解等多方面信息[27-28]。 有研究表明,在外界环境胁迫条件下,植物体可以降低可溶性蛋白含量以应对环境胁迫[24]。 本研究中,随着处理时间的延长,樟子松针叶内的可溶性蛋白含量呈现出先升高再降低的趋势,可能是由于松材线虫胁迫致使樟子松出现应激反应,可溶性蛋白含量陡然升高,用以增加细胞的渗透势来抵御不良环境。然而,随着樟子松被胁迫程度的加深,细胞活性降低,蛋白质的结构被破坏,致使细胞内可溶性蛋白被沉淀、降解或者变性,呈现出先升高后下降的趋势。黄酮类化合物是植物抗逆性的重要代谢物,与植物抗病性有直接的关系。本研究中,松材线虫接种则直接诱导了樟子松黄酮化合物的合成,促使黄酮化合物含量显著升高。 苗木在受到松材线虫胁迫时出现应激反应,随着生长势的降低,黄酮含量下降。
综上,松材线虫侵染使樟子松体内各项抗性生理指标产生应激反应,但随着病情的加重,樟子松生长势衰弱,枯黄萎蔫,光合色素含量下降。 接种松材线虫后,樟子松抗氧化酶系统变化较为明显,均呈先升高后降低的变化趋势,其中SOD 表现较为平稳。 樟子松受松材线虫胁迫细胞受损程度较大,MDA 含量在接种后即上升至较高的水平。 可溶性蛋白和黄酮化合物含量均表现出与抗氧化酶相似的趋势,即先升高后降低,表明樟子松对松材线虫胁迫具有一定的应激反应。
