栀子叶乙醇提取物对B16黑色素瘤细胞黑色素生成及酪氨酸酶活性的影响
2021-01-30黄硕刘风
黄 硕 刘 风
厦门市第五医院麻醉科,福建厦门 361101
近年来,由各种原因引起的色斑、皮肤衰老等问题受到人们越来越多的关注,而黑色素过度沉着是导致皮肤出现色斑的主要原因[1]。黑素细胞中的酪氨酸酶调控黑色素的生成[2],同时也是生物体合成黑色素起始反应过程中最重要的限速酶[3],因此,许多皮肤美白剂通过抑制酪氨酸酶活性抑制黑色素的生成来达到美白的功能[4]。由于天然产物具有安全、温和、环保等优点[5],因而从天然植物中提取功效成分以改善皮肤色素沉积,已成为目前护肤产品开发的主要趋势[6]。
栀子叶来源于茜草科植物栀子(Fructus Gardeniae)的干燥叶[7]。栀子分布于我国海拔10~1500 m 处的旷野、丘陵、山谷、山坡、溪边的灌丛或林中[8],其果实已收入《中国药典》并广泛应用于临床[9]。而其叶在我国广西、四川等地民间广泛应用于治疗烫伤、跌打损伤、血瘀等[10]。有报道称,栀子叶含去羟栀子苷、栀子苷[11-12]。但到目前为止,国内外对该属植物的药理研究还不够系统和深入,栀子叶中有效成分的药理学作用尚未充分揭示。本实验通过检测栀子叶70%乙醇提取物对α-促黑色素细胞激素(α-MSH)诱导的B16黑色素瘤细胞增殖活性、细胞内酪氨酸酶活性及黑色素生成的作用,期望为栀子叶美白护肤功效产品的开发提供理论依据,现报道如下。
1 材料与方法
1.1 材料及仪器
1.1.1 材料 栀子叶由厦门鹭燕大药房有限公司提供,经厦门市第五医院药剂科鉴定为茜草科植物栀子(Fructus Gardeniae) 的干燥叶,自然阴干后粉碎,过20 目筛,4℃储藏备用。曲酸、二甲基亚砜、左旋多巴(L-DOPA)、α-MSH 均购自美国Sigma 公司。胎牛血清(fetal bovine serum,FBS)、DMEM 培养基、青链霉素、胰蛋白酶(含0.02% EDTA)(购于Gibco 公司)。1.1.2 仪器 3111型CO2培养箱(美国Thermo 公司);Spectra Max M5型多功能酶标仪(美国Molecular Devices 公司);FD-1A-50型冷冻干燥机(上海继谱电子科技有限公司);旋转蒸发仪(德国Heidolph 公司)
1.2 细胞培养
B16黑色素瘤细胞购自于中科院上海细胞所。常规培养于含10% FBS、100 μg/mL 链霉素和100 U/mL青霉素的DMEM 培养基,在5% CO2及37℃培养箱中培养。细胞接种在96 孔及6 孔板的细胞密度分别为1×104cells/孔、2.5×105cells/孔,细胞均处于对数生长期时用于进一步实验。
1.3 栀子叶有效成分的提取方法
取栀子叶粉末10 g,晾干后,加入200 mL 70%乙醇,室温浸泡40 min,采用水浴(85℃)回流提取1 h,过滤,将滤液置于旋转蒸发仪,回收乙醇,得到粗浸膏,将粗浸膏用冷冻干燥机干燥至冻干粉末状,备用。
1.4 实验分组
酶动力学实验分组:设置实验组(样本为栀子叶70%乙醇提物)和阳性对照组(样本为曲酸)。
细胞实验分组:设置空白组、模型组、阳性对照组和栀子叶70%乙醇提取物组[低浓度组(100 mg/L)、中浓度组(200 mg/L)、高浓度组(400 mg/L)]。栀子叶70%乙醇提取物组各组的药物配置方法如下,取“1.3”项下的0.1 mg 提取物粉末溶于1 mL PBS 中,进行溶液配制,得低浓度组;取“1.3”项下的0.2 mg 提取粉末溶于1 mL PBS 中,进行溶液配制,得中浓度组;取“1.3”项下的0.3 mg 提取粉末溶于1 mL PBS 中,进行溶液配制,得高浓度组。
1.5 采用左旋多巴氧化法检测酪氨酸酶活性
如“1.4”项中所述,设置酶动力学实验分组,采用200 μL 反应体系,将30 μL 蘑菇酪氨酸酶溶液(酶活力100 U/mL)和30 μL“1.3”项中所述的栀子叶70%乙醇提取物、曲酸和PBS分别加入96 孔板中,混合均匀,37℃孵育10 min 后,迅速加入左旋多巴溶液60 μL,混合均匀,连续30 min 检测溶液在475 nm 处的吸光度值。
酪氨酸酶活性抑制率=[1-(T1-T2)/(C1-C2)]×100%。
式中:C1:未加样品加酪氨酸酶的反应液的吸光度;C2:未加样品且未加酪氨酸酶的反应液的吸光度;T1:加样品和加酪氨酸酶的吸光度;T2:加样品而未加酪氨酸酶的吸光度。
1.6 MTS 测定细胞活力
处于对数生长期的B16黑色素瘤细胞融合度达到70%时,每孔加入200 μL 含2% FBS DMEM 培养基稀释过的不同浓度(100、200、300、400、500、600、700、800、900、1000 mg/L)的栀子叶70%乙醇提取物,孵育24 h,加入MTS 试剂,在37℃水浴反应10 min,于5%CO2及37℃培养箱中反应60 min,在490 nm 波长处测定吸光值,计算细胞存活率。细胞存活率(%)=测定孔吸光值/对照吸光值×100%。
1.7 B16黑色素瘤细胞黑色素含量的测定
如“1.4”项中所述,设置细胞实验分组,将B16黑色素瘤细胞接种于6 孔板(密度为1×105/孔,每孔1.5 mL),于5% CO2,37℃培养箱中培养24 h,弃培养液,分别取 栀 子 叶70%乙 醇 提 取 物100、200、300、400、500、600、700、800、900、1000 mg/L 浓度然后用低、中、高三个浓度的栀子叶70%乙醇提取物(如“1.4”项实验分组所述)孵育B16黑色素瘤细胞72 h。B16黑色素瘤细胞黑色素含量的测定方法,按照文献报道[13]进行。
1.8 B16黑色素瘤细胞酪氨酸酶活性
如“1.4”项中所述,设置细胞实验分组,将B16黑色素瘤细胞接种于6 孔板(密度为1×105/孔,每孔1.5 mL),于5% CO2,37℃培养箱中培养24 h,弃培养液,然后用低、中、高三个浓度的栀子叶70%乙醇提取物(如“1.4”项实验分组所述)孵育B16黑色素瘤细胞72 h。B16黑色素瘤细胞酪氨酸活性的测定方法,按照文献报道[13]进行。
1.9 统计学方法
采用Graphpad Prism 7 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,多组间比较采用One way-ANOVA检验,两组间比较采用两独立样本t 检验(LSD-t 检验);计数资料采用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 栀子叶70%乙醇提取物和曲酸对蘑菇酪氨酸酶活性的抑制作用
采用左旋多巴氧化法检测蘑菇酪氨酸酶活性,结果显示,实验组的栀子叶70%乙醇提取物对蘑菇酪氨酸酶活性具有更强的抑制作用,其对蘑菇酪氨酸酶抑制作用的IC50为(0.157±0.044)mg/mL,阳性对照组的曲酸对蘑菇酪氨酸酶抑制作用的IC50为(0.054±0.018)mg/mL。
2.2 栀子叶70%乙醇提取物对B16黑色素瘤细胞活力的影响
分别取栀子叶70%乙醇提取物100、200、300、400、500、600、700、800、900、1000 mg/L 浓度,孵育B16黑色素瘤细胞72 h 后测定细胞存活率。结果显示,随栀子叶70%乙醇提取物浓度增高,细胞存活率逐渐降低,100~600 mg/L 浓度下,细胞存活率≥80%,视为无细胞毒性,即对体外培养的小鼠B16黑色素瘤细胞无明显毒性;100~400 mg/L 浓度时,B16黑色素瘤细胞的存活率>90%,提示100~400 mg/L 浓度的栀子叶70%乙醇提取物对B16黑色素瘤细胞的增殖没有影响(图1)。因此,在后续实验中采用低浓度(100 mg/L)、中浓度(200 mg/L)和高浓度(400 mg/L)栀子叶70%乙醇提取物来进行各项细胞学研究。

表1 栀子叶70%乙醇提取物和曲酸对蘑菇酪氨酸酶活性的抑制作用
2.3 不同组别对B16黑色素瘤细胞黑色素含量的抑制作用
分别选取模型组、栀子叶70%乙醇提取物中浓度组以及曲酸阳性对照组,每组两份平行组进行试验,所得作用图见图2。
模型组的B16黑色素瘤细胞黑色素含量明显高于空白组,差异有统计学意义(P<0.001);栀子叶70%乙醇提物浓度依赖高度性地抑制B16黑色素瘤细胞黑色素的生成,栀子叶70%乙醇提取物中浓度组和高浓度组的B16黑色素瘤细胞内黑色素含量低于模型组,差异有统计学意义(P<0.05);曲酸显著抑制B16黑色素瘤细胞黑素的生成,阳性对照组的B16黑色素瘤细胞内黑色素含量显著低于模型组,差异有高度统计学意义(P<0.001)(图3)。
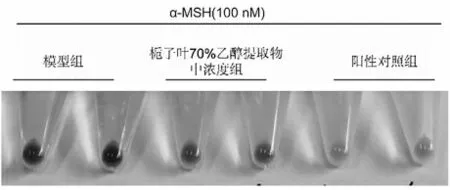
图2 模型组、栀子叶70%乙醇提取物中浓度组、阳性对照组对B16黑色素瘤细胞黑素含量的作用

图3 不同组别B16黑色素瘤细胞黑色素含量的比较
2.4 栀子叶70%乙醇提取物对B16黑色素瘤细胞酪氨酸酶活性的抑制作用
模型组B16黑色素瘤细胞酪氨酸活性高于空白组,差异有统计学意义(P<0.001);栀子叶70%乙醇提物浓度依赖性地抑制B16黑色素瘤细胞酪氨酸酶活性,栀子叶70%乙醇提取物中浓度组和高浓度组的B16黑色素瘤细胞酪氨酸酶活性低于模型组,差异有统计学意义(P<0.05);曲酸显著抑制酪氨酸酶的活性,阳性对照组的B16黑色素瘤细胞内酪氨酸酶活性显著低于模型组,差异有高度统计学意义(P<0.001)(图4)。
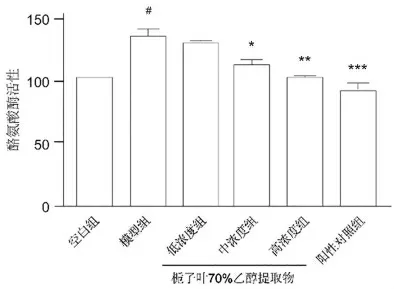
图4 不同组别B16黑色素瘤细胞酪氨酸活性的比较
3 讨论
酪氨酸酶活性的过度增强,是导致黑色素异常积累的主要原因。因而,酪氨酸酶抑制剂的在护肤产品方面的的研究和开发受到了人们的广泛关注。本研究通过检测栀子叶70%乙醇提取物对底物左旋多巴的催化效果,间接反映酪氨酸酶的活性,结果显示,栀子叶醇提物可抑制蘑菇酪氨酸酶活性,IC50为(0.157±0.044)mg/mL。采用MTS 检测B16黑色素瘤细胞活力,结果显示,栀子叶70%乙醇提取物浓度在100~600 mg/L 时,对体外培养的小鼠B16黑色素瘤细胞均无明显毒性,100~400 mg/L 浓度时,B16黑色素瘤细胞的存活率>90%,因此,在后续实验中采用低浓度(100 mg/L)、中浓度(200 mg/L)和高浓度(400 mg/L)栀子叶70%乙醇提取物来进行各项细胞学研究。
α-MSH是一种内源性的神经激素,由其前体激素阿片-黑皮素原(POMC)裂解而成[13],这种由13个氨基酸组成的神经内分泌激素能够促进黑素细胞的分裂且增强黑素细胞内酪氨酸酶表达及活性,促进黑素生成[14],已有研究发现,角质化细胞产生的α-MSH在体内可能是黑素细胞的自然生长因子。在皮肤黑素细胞和毛囊存在多种生长因子和细胞因子以及它们的受体[15]。在本课题研究中,笔者探究栀子叶70%乙醇提取物对α-MSH 诱导的B16黑色素瘤细胞内黑色素生成和酪氨酸酶活性的作用,结果显示,栀子叶乙醇提物浓度依赖性地抑制B16黑色素瘤细胞黑素的生成,栀子叶70%乙醇提取物中浓度组和高浓度组的B16黑色素瘤细胞内黑色素含量低于模型组,差异有统计学意义(P<0.05),提示栀子叶乙醇提物对B16黑色素瘤细胞的黑素生成具有抑制活性。同时,本研究结果还显示,栀子叶乙醇提物浓度依赖性地抑制α-MSH 诱导后B16黑色素瘤细胞酪氨酸酶的活性,栀子叶70%乙醇提取物中浓度组和高浓度组的B16黑色素瘤细胞酪氨酸酶活性低于模型组,差异有统计学意义(P<0.05),由此可推断栀子叶70%乙醇提取物通过直接抑制酪氨酸酶的活性降低B16黑色素瘤细胞中黑色素的生成。
综上所述,栀子叶70%乙醇提取物是一种天然、安全和高效的黑色素合成抑制剂,为将其进一步开发为皮肤美白剂或美白添加剂提供了理论依据。但仍有诸多疑虑,如栀子叶乙醇提取物的关键活性成分、对酪氨酸酶的具体抑制类型和结合方式等,有待进一步探究。
