NiZnCe复合氧化物的制备及其催化氧化正丁烷脱氢性能
2021-01-30王炼万超程党国陈丰秋詹晓力
王炼,万超,程党国,陈丰秋,詹晓力
(1 浙江大学化学工程与生物工程学院,浙江省化工高效制造技术重点实验室,浙江杭州310029; 2 浙江大学衢州研究院,浙江衢州324000; 3 安徽工业大学化学与化工学院,安徽马鞍山243000; 4 安徽海德化工科技有限公司,安徽马鞍山243000)
引 言
随着煤化工技术的快速发展[1-3],其副产物丁烷产量逐年增加;此外,随着我国西气东输工程的顺利实施,天然气已取代丁烷成为民用燃气的主要成分[4],因此,开发丁烷高效利用技术对于缓解丁烷过剩和实现C4资源化利用具有重要意义[4-5]。目前,丁烷脱氢制烯烃技术被认为是实现丁烷高值化利用理想技术之一[6]。开发丁烷高效脱氢制取烯烃技术,不仅可以缓解C4烯烃资源供应短缺,还可以有效解决丁烷过剩,实现丁烷的高附加值利用[4-6]。丁烷脱氢技术主要分为直接热脱氢和氧化脱氢两种方式,相对于直接脱氢,丁烷氧化脱氢具有显著优势:没有热力学限制;反应条件更温和;反应介质含氧气,可有效抑制积炭产生。然而,正丁烷与氧气极易发生燃烧等副反应[7]。设计高效丁烷氧化脱氢催化剂成为丁烷资源化利用的难点所在。
目前,研究者多选用V、Ni等作为丁烷氧化脱氢反应的主活性组分。V、Ni 催化剂的研究主要集中在负载型催化剂,探究载体对活性组分的调控。负载型V基催化剂能够在温和的条件下实现丁烷的活化[8],但目标产物烯烃的选择性较低[9-12]。Wang 等[13]使用含钒的钛硅酸盐和含V 的SBA-15 催化剂,对比研究了在较低温度和较低钒含量下的正丁烷的氧化还原脱氢(ODH)反应。研究表明,含V 的钛硅酸盐催化剂对正丁烷的ODH 表现出更高的催化活性,能在氧烷比2∶1、反应温度460℃下达到23.6%的丁烷转化率和7.6%的丁二烯选择性。此外,钒作为活性组分,易造成环境的污染[14]。因此,V 基催化剂在丁烷脱氢反应中逐渐被限制使用。Ni 基催化剂逐渐成为丁烷氧化脱氢反应研究的热点方向[15-16]。NiO 负载于高表面积的载体上可以显著地改善目标产物烯烃的选择性,但反应温度与氧气进料量却不理想[17]。Tanimu等[18]使用NiO/Al2O3负载型催化剂在氧烷比2∶1、反应温度500℃下才能达到25.1%的丁烷转化率和21.9%的丁二烯选择性。近年来,Ni基催化剂在低碳烃(C2,C3)氧化脱氢反应中得到广泛应用[19-21]。特别是通过其他元素改性Ni形成复合金属氧化物,如Ni-Zr-O[22]、Ni-Ce-O[23]等。在Ni氧化还原循环期间,有效的掺杂剂使得活泼的Ni 物质中产生许多缺陷(主要为氧空位)。来自富氧区域的受控O2-供应到Ni 缺陷上使得Ni2+至Ni+的氧化还原系统更有效[24-29]。提高Ni催化剂上的氧移动性,会极大增加催化剂的活性,研究结果表明,氧容量和氧流动性是影响催化剂脱氢活性的两个关键因素。
Zn 由于其优异的氧容量被广泛应用于低碳烃氧化过程中,低碳烃吸附性能提高有利于反应的发生[30]。同时,Ce 作为过渡金属元素之一,是调节催化剂的氧流动性的良好助剂,可以显著提升催化性能[31]。基于此,本文提出溶胶凝胶法制备Zn、Ce 双金属掺杂的NiZnCe 复合氧化物催化剂,采用XRD、H2-TPR、TPRO 等对催化剂进行表征,重点探究Zn、Ce 双金属掺杂对镍基催化剂的氧容量和氧流动性影响规律,建立氧容量和氧流动性对催化剂催化性能的调控机制,并提出在NiZnCe复合氧化物催化剂作用下丁烷氧化脱氢反应机理。
1 实验材料和方法
1.1 催化剂的制备
采用溶胶-凝胶法制备Ni-Zn-O 双金属氧化物催化剂。将已知量的六水合硝酸镍[Ni(NO3)2·6H2O]和六水合硝酸锌[Zn(NO3)2·6H2O]溶解在蒸馏水中,将已知量的一水合柠檬酸(C6H8O7·H2O)溶解在蒸馏水中。随后柠檬酸溶液加入含有镍和锌前体的溶液中,在70℃下搅拌混合溶液,得到溶胶,后将其过夜放置,由于溶剂蒸发,溶胶通过陈化得到湿凝胶,然后在120℃烘箱内过夜干燥,得到海绵状绿色粉末。干燥后的样品置于流动空气气氛下的管式炉中800℃下焙烧3 h,焙烧后的样品即为NiZnx双金属氧化物催化剂,其中x 为锌元素相对于镍元素的摩尔比,其值为0、0.5、1、3、5。
在上述基础上,在已知量的六水合硝酸镍[Ni(NO3)2·6H2O]和六水合硝酸锌[Zn(NO3)2·6H2O]溶液中添加六水合硝酸铈[Ce(NO3)3·6H2O]。采用同样的制备方法。焙烧后的样品即为NiZn0.5Cey三金属氧化物催化剂,其中y 为铈元素相对于镍元素的摩尔比,其值为0.2、0.3、0.5、1。
1.2 催化剂性能评价
催化剂的性能评价在内径为8 mm 不锈钢管微反固定床反应器中进行。催化剂预处理温度为550℃,气体为空气与氮气的混合气体,时间为0.5 h。催化反应时,用质量流量计控制原料气正丁烷、空气以及氮气的流量,其组成设定为正丁烷∶空气∶氮气的摩尔比为1∶5∶6,总空速为14400 ml·(g cat)-1·h-1。反应温度为440℃。当温度到达设定值并稳定一段时间后开始取样检测。使用奇阳GC-9860 气相色谱进行在线色谱检测分析,采用柱炉程序升温法对产物进行检测。其中,碳氢化合物使用FID 检测器在HT-PLOT Al2O3/S 气相色谱柱上进行检测,二氧化碳使用TCD 检测器在TDX-01气相色谱柱上进行检测。以碳平衡为基础对反应进行计算,正丁烷的转化率用式(1)计算,丁二烯的选择性用式(2)计算:

1.3 催化剂表征
氮气吸脱附曲线可以获得样品比表面积及孔径孔容等信息。该表征在美国Micromeritics ASAP2020 型物理吸附仪上进行。样品的比表面积(SBET)数据通过Brunauer Emmett and Teller(BET)方程计算。元素含量通过电感耦合等离子体原子发射光谱法(ICP-OES)测得。仪器型号为Agilent 720ES。粉末X 射线衍射(XRD)在X′Pert PW3050/60 型X 射线衍射仪上进行,其扫描范围5°~80°,扫描 步 长 0.02° 。 TPRO 测 试 在 Micromeritics AutoChem II 2920 型化学吸附仪上进行,同时使用TCD 和外接质谱仪(Hiden QIC-20)进行检测。具体测试过程:将0.1 g样品用正丁烷在无氧条件下预处理后,通入30 ml·min-1含氧气10%的O2-He 混合气进行程序升温氧化,升温速率10℃·min-1,温度范围为100~600℃。X 射线光电子能谱测试仪器型号为Thermo Scientific K-Alpha+。H2-TPR 表征测试在Micromeritics AutoChem II 2920 型化学吸附仪上进行,使用TCD 进行检测,样品质量为0.05 g。通入30 ml·min-1含氢气10%的H2-Ar 混合气进行程序升温还原,升温速率10℃·min-1,温度范围为100~900℃。
2 实验结果与讨论
2.1 催化剂性能评价结果
表1 显示了不同锌含量的NiZnx(x=0、0.5、1、3、5)与不同铈含量的NiZn0.5Cey(y=0.2、0.3、0.5、1)氧化物的催化性能。由于纯NiO催化剂在正丁烷氧化脱氢反应时,不到0.5 h便结焦严重,导致反应管堵塞,反应停止,因此,该催化剂的催化性能基本为零。从表1 可看到,随着Zn 含量的增加,在不同锌含量的NiZnx(x=0、0.5、1、3、5)氧化物催化剂作用下,正丁烷转化率呈现火山形变化,NiZn0.5表现出较好的正丁烷转化率及脱氢产物(1-丁烯、2-丁烯和1,3-丁二烯)的选择性,分别为11.8%与26.4%。在性能较佳的NiZn0.5催化剂上添加不同含量的Ce,不同铈含量的NiZn0.5Cey(y=0.2、0.3、0.5、1)氧化物催化剂的正丁烷转化率和丁二烯选择性均呈现出火山形变化,其中,NiZn0.5Ce0.3具有最优的正丁烷转化率及丁二烯的选择性,分别为23.9%与16.6%。

表1 NiZnx及NiZn0.5Cey氧化物催化剂上正丁烷转化率以及产物选择性Table 1 n-Butane conversion and products selectivity over NiZnx and NiZn0.5Cey oxide catalyst
2.2 XRD表征与氮气吸脱附测试结果
图1 为不同锌含量的NiZnx氧化物催化剂以及不同铈含量的NiZn0.5Cey氧化物催化剂的XRD谱图。Zn 的添加导致Ni0.9Zn0.1O 晶相的衍射峰的出现。在NiZnx(x=0、0.5、1、3、5)氧化物催化剂中,NiZn0.5氧化物催化剂含有最多的Ni0.9Zn0.1O 晶相含量,此外,Ni0.9Zn0.1O 晶相的衍射峰相对强度随着Zn 含量增加逐渐下降,表明该相含量变少,而ZnO 晶相含量一直增大。在NiZn0.5氧化物催化剂中添加Ce,CeO2晶相与Ni0.9Zn0.1O 晶相含量随Ce 含量先增大后减小,NiZn0.5Ce0.3的NiO、Ni0.9Zn0.1O 以及CeO2晶相衍射峰强度最强,说明三相含量最大,晶格结构最完整。改变Ce 的含量,二氧化铈峰的宽度和位置均有所变化,Ni2+被掺入二氧化铈晶格中形成固溶体。据文献[32]介绍,相比于Ce4+进入到镍氧化物晶格,Ni2+更易进入到二氧化铈中,这是由于Ni2+(0.72 Å,1 Å=0.1 nm)的直径比Ce4+(1.01 Å)低。因此,NiZn0.5Cex催化剂中至少存在三种Ni 相,NiO、Ni0.9Zn0.1O、含Ni 的CeO2(如Ce1-xNixO)共固溶体相。这与文献[31]报道的NiO-CeO2氧化物催化剂的晶体组成一致。
结合考评结果可知,催化剂性能与Ni0.9Zn0.1O 晶相含量呈正相关关系,因此,形成固溶体Ni-Zn-O有利于正丁烷氧化脱氢反应的发生,然而,ZnO晶相的生成不利于烷烃反应的发生。当Ce 添加到NiZn0.5氧化物催化剂上时,正丁烷转化率与1,3-丁二烯选择性均有明显变化。添加少量的Ce 就能显著改善Ni-Zn-O 催化剂的催化性能。当Ce 含量增加(y 从0.2 增加到1)时,催化剂性能与Ni0.9Zn0.1O 晶相含量仍呈正相关,进一步证实固溶体Ni-Zn-O 有利于反应的发生。同时通过无铈和有铈催化剂对比可发现,在有铈的催化剂中,Ni0.9Zn0.1O、NiO 晶相含量均降低,但催化剂的活性以及选择性氧化能力却显著增加,这可能与Ni2+掺入二氧化铈晶格中形成固溶体有关,这种相的生成有利于提高催化剂的氧化还原能力。
表2 为不同锌含量的NiZnx(x=0、0.5、1、3、5)氧化物催化剂与不同铈含量的NiZn0.5Cey(y=0.2、0.3、0.5、1)氧化物催化剂的原子比、比表面积和孔容。从表中可以看到,ICP-OES 测得的两种类型催化剂的原子比与理论值基本一致,表明不同锌含量的NiZnx(x=0、0.5、1、3、5)及不同铈含量的NiZn0.5Cey(y=0.2、0.3、0.5、1)氧化物催化剂被成功合成。
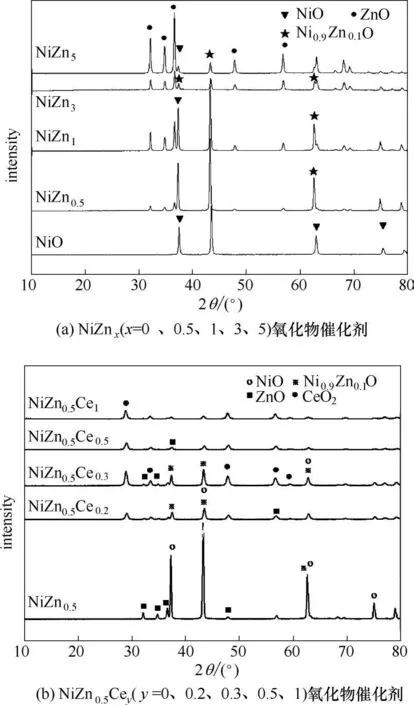
图1 NiZnx(a)和NiZn0.5Cey(b)催化剂的XRD谱图Fig.1 XRD patterns of NiZnx(a),and NiZn0.5Cey(b)catalysts
2.3 催化剂性能影响因素
2.3.1 H2-TPR 表征结果 图2 为不同铈含量的NiZn0.5Cey(y=0、0.2、0.3、0.5、1)催化剂的H2-TPR 图。催化活性不仅取决于活性金属还原性(吸附的正丁烷分子中H 抽离速率),还依赖于活性位点的再氧化速率(体相晶格氧移动性)。文献[33-34]报道体相CeO2的还原发生在700℃以上。从图中看出,NiZn0.5Cey催化剂只有一个氢消耗峰,此还原峰应归因于Ni 相[22]的还原。催化剂还原温度越低,催化剂中活性金属还原性越强,氧化时也越容易,其氧移动性能越好,此时催化剂活性较强。Ce 的添加,显著降低了NiZn0.5氧化物催化剂的还原温度,其中NiZn0.5Ce0.3氧化物催化剂的还原温度最低,为412.5℃。已知Ni2+进入二氧化铈晶格会产生氧空位,从而形成了非常活泼的氧,在低温下很容易被H2还原[31]。H2-TPR 表征结果表明,添加Ce到NiZn0.5氧化物上,有效形成Ce-Ni-O 固溶体,产生氧空位,从而容易吸收氧,利于烷烃活化和反应发生。这与XRD 结果中含Ni 的CeO2(如Ce1-xNixO)的生成结果一致。
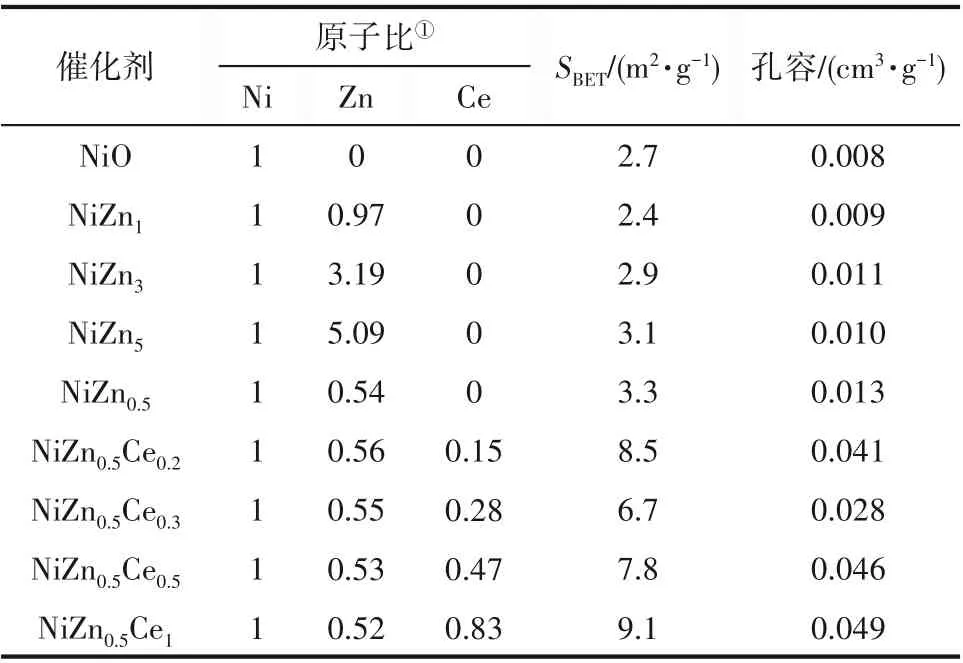
表2 NiZnx及NiZn0.5Cey氧化物催化剂的元素组成、比表面积和孔容Table 2 Atomic ratio,BET surface area,total pore volume of NiZnx and NiZn0.5Cey oxide catalysts
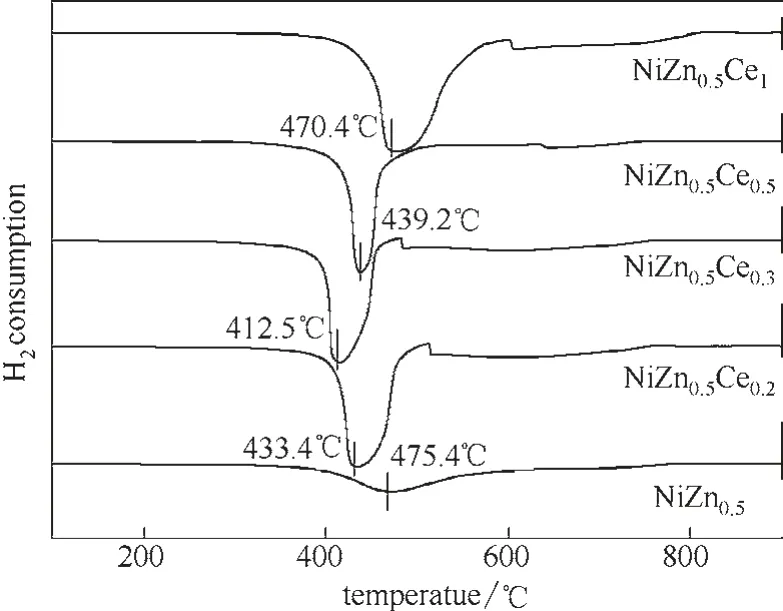
图2 不同铈含量的NiZn0.5Cey氧化物催化剂的H2-TPR图Fig.2 H2-TPR profiles of NiZn0.5Cey with different cerium contents
2.3.2 TPRO 表征结果 图3 为不同铈含量的NiZn0.5Cey(y=0、0.2、0.3、0.5、1)催化剂的TPRO 图。催化剂TPRO 中低温段氧消耗峰的峰温决定了催化剂中氧物种的再生能力,其中,低温段峰温度越低,表明氧移动性越好,气氛中的氧气越易补充到催化剂的表相与体相氧空穴中,即催化剂中氧物种的再生能力越强。较大的TPRO 峰面积对应于较高的氧迁移率和较大的氧容量[35-36]。氧容量是指参与反应的催化剂中的氧量。不同铈含量的NiZn0.5Cey(y=0、0.2、0.3、0.5、1)催化剂中,NiZn0.5Ce0.3具有较低的低峰温度和较大的氧容量。表明,NiZn0.5Ce0.3中氧物种的再生能力较强以及参与反应的氧量最多,这与考评结果中NiZn0.5Ce0.3的催化性能较好一致。

图3 NiZn0.5Cey氧化物催化剂的TPRO 图Fig.3 TPRO profiles of NiZn0.5Cey oxide catalysts
为了进一步探究正丁烷氧化脱氢反应中氧消耗的去向,图4 是NiZn0.5Ce0.3催化剂的TPRO-MS 信号图。从图4 可知,200~300℃以及300~400℃均有氧气的消耗和二氧化碳的生成,表明氧气的消耗和二氧化碳的生成几乎同时进行,并且催化剂表面发生了少量的积炭。其中,200~300℃的氧消耗量大概是300~400℃氧消耗量的4.3 倍,200~300℃的二氧化碳的生成量大概是300~400℃二氧化碳生成量的2.3 倍。若是消耗氧气仅仅是用来进行催化剂表面除炭,那么该氧消耗峰不会明显大于二氧化碳的生成峰。因此,可以证明,氧气消耗主要用来补充正丁烷预处理时所消耗的晶格氧。催化剂体相的晶格氧迁移到催化剂表相,从而参与活化烷烃。TPRO-MS 信号图揭示了在无氧条件下,采用正丁烷预处理催化剂,活化烷烃的催化剂中氧物种包含表面氧物种以及体相晶格氧。Ni-Zn-Ce 氧化物催化剂在整个反应时间内均表现出稳定的催化性能,表明在当前反应条件下,催化剂中晶格氧的再生速率大于晶格氧的消耗速率,即使降低原料中的氧气/正丁烷进料比例(1∶1),该催化剂体相与表相上的快速氧迁移速率,足以防止焦炭沉积导致的失活。
2.3.3 XPS 表征结果 图5 是不同铈含量的NiZn0.5Cey(y=0、0.2、0.3、0.5、1)催化剂的O1s 谱图。结合文献[5,22,37-38],对图5 中的不同Ce 含量的NiZn0.5Cey氧化物催化剂的O1s谱图分别进行分峰处理,其中,531.5 eV 左右处结合能归因于催化剂表面的弱结合氧物种,主要来自表面低配位的氧离子,也就是非化学计量氧物种;530.7 eV 左右的结合能的分峰主要归因于金属-氧键等的活性氧物种;529.0 eV 左右的结合能归因于催化剂表面上的强结合氧物种。文献研究[5,22,37-38]表明,金属-氧键等的活性氧物种的分峰的结合能越强,催化剂的氧移动性就越强。NiZn0.5Ce0.3氧化物催化剂的O1s 谱图分峰中,金属-氧键等的活性氧物种分峰的结合能达到530.7 eV,故此催化剂的氧移动性较强,催化剂性能较好,与实验考评结果一致。
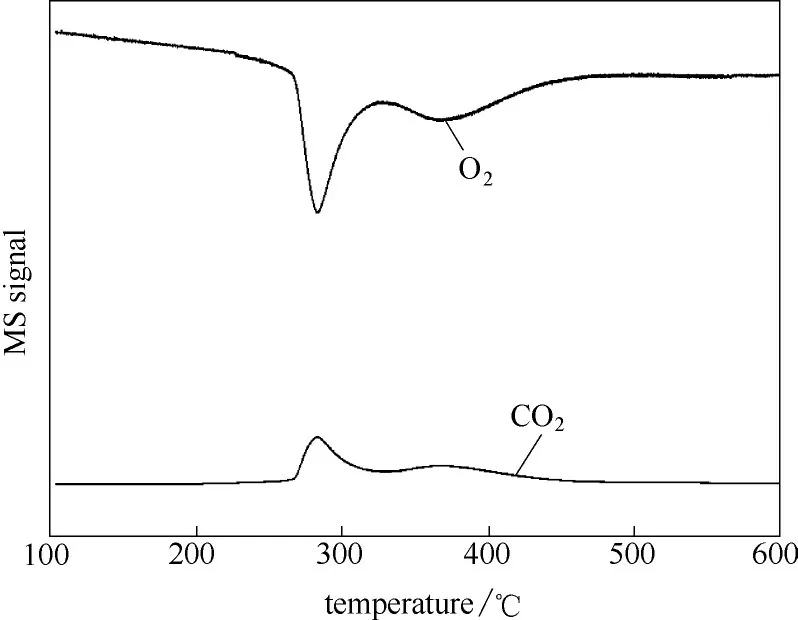
图4 NiZn0.5Ce0.3氧化物催化剂的TPRO-MS 信号图Fig.4 MS signals of TPRO of NiZn0.5Ce0.3 oxide catalyst[m/z=32(•O2),44(•CO2)were recorded during TPRO analysis]

图5 NiZn0.5Cey氧化物催化剂的O1s谱Fig.5 The O1s spectrum of NiZn0.5Cey oxide catalysts
图6 显示了NiZn0.5Cey(y=0、0.2、0.3、0.5、1)催化剂的Ni2p3/2XPS 光谱,对该谱线进行分峰。结合文献,其中855.8 eV 左右处结合能可归因于Ni3+[39-40]、Ni2+-OH 物 种[41]或Ni2+空 位 引 起 的 晶 格 畸 变[42]。853.8 eV 左右处结合能归因于Ni2+主峰。两处结合能越大,Ni 物种性质越活泼,催化剂性能越好。很明显,NiZn0.5Ce0.3样品中Ni2+缺陷的比例高,这与之前Ce-Ni-O 固溶体的形成会产生氧空位的判断一致。通过Ce-O-Ni桥连键,从低价Ni2+到高价Ce3+更容易发生电子转移,此时Ni物种性质最活泼。
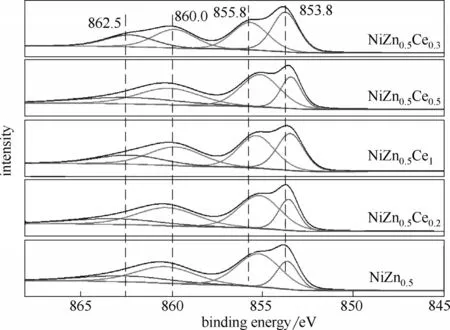
图6 NiZn0.5Cey氧化物催化剂的Ni2p3/2谱Fig.6 The Ni2p3/2 spectra of NiZn0.5Cey oxide catalysts
2.4 反应机理
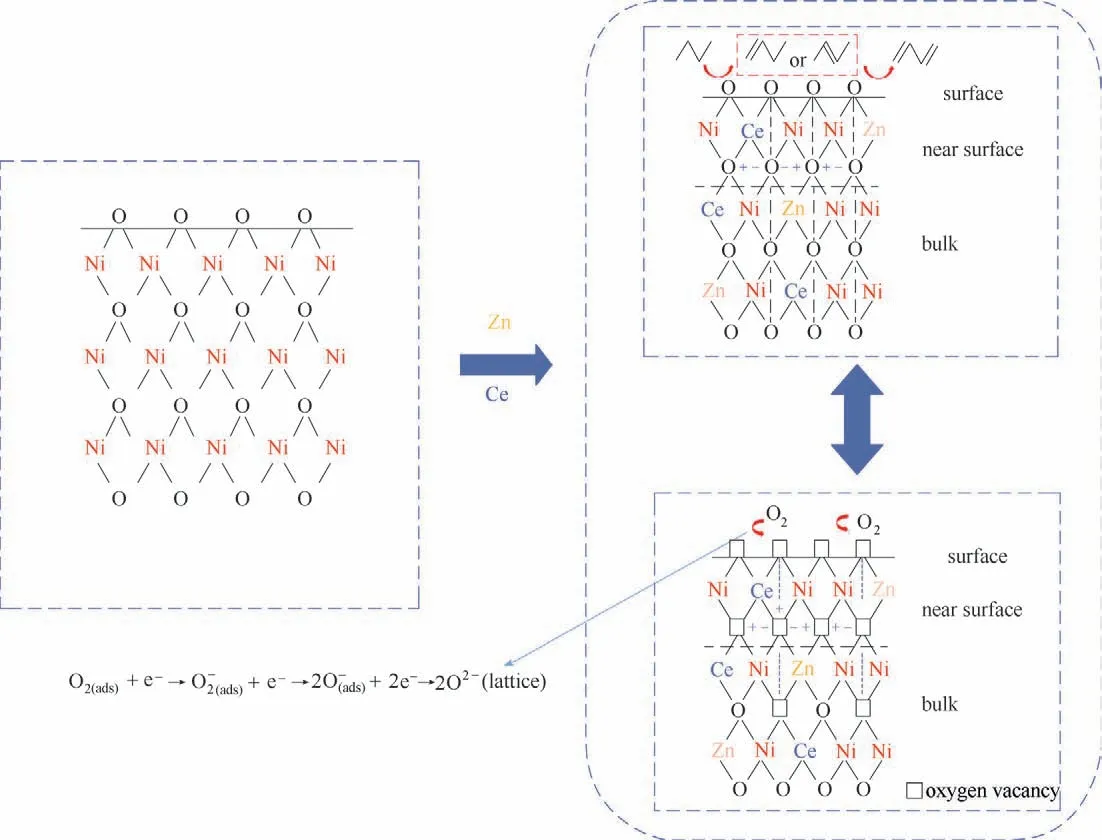
图7 NiZn0.5Ce0.3氧化物催化剂的反应机理和氧迁移机理Fig.7 Reaction mechanism and oxygen migration mechanism of NiZn0.5Ce0.3 oxide catalysts
3 结 论
本文利用溶胶凝胶法制备一系列Zn、Ce掺杂的NiZnCe 复合氧化物催化剂,研究了Zn、Ce 加入对NiO 催化剂上正丁烷氧化脱氢的影响。测试结果表明Zn 单独加入显著减少NiO 催化剂上裂解中心位点,抑制结焦反应,并增强进行选择性氧化的活性中心位点(提高氧容量),而当Zn、Ce共掺时,由于氧容量和氧流动性都增强,催化剂性能出现了较大的提升,其中NiZn0.5Ce0.3具有较大的正丁烷转化率及丁二烯产物的选择性,分别为23.9%与16.6%,且表现出良好的反应稳定性。XRD、H2-TPR、TPRO等结果表明,Zn、Ce 掺杂使催化剂出现了Ni-Zn-O、Ce-Ni-O 固溶体,这些相的生成有利于提高催化剂的氧化还原能力,利于反应的发生,其中NiZn0.5Ce0.3具有较低的低峰温度和较大的氧容量,表明NiZn0.5Ce0.3中氧物种的再生能力较强以及参与反应的催化剂中氧量最多。催化剂中氧物种的活跃性在正丁烷进行氧化脱氢反应中起着重要作用。XPS结果表明NiZn0.5Ce0.3样品中Ni2+缺陷的比例高,Ni与Ce的相互作用导致了Ni 阳离子化合价和可接受电子能力的提高,活性Ni 变得更容易吸附活性氧物种,此时金属与氧气的循环往复反应最活泼。正丁烷氧化脱氢反应遵循Mar-var-Krevelen 机理。CeO2/ZnO 充当氧供体,实现氧气与活性氧物种之间的转换,活性Ni 物种充当氧受体,其经历氧化还原循环并最终导致水的生成。
符 号 说 明
Abutadiene——丁二烯色谱峰面积
An-butane——正丁烷色谱峰面积
Conv.(n-butane)——正丁烷转化率,%
fbutadiene——丁二烯校正因子
fn-butane——正丁烷校正因子
Sel.(butadiene)——丁二烯选择性,%
T——各物质色谱峰面积与其校正因子的和
