基于金刚烷-二氧杂环丁烷化学发光探针的研究进展
2021-01-30江龙王开杰孔晴陆晟陈小强
江龙,王开杰,孔晴,陆晟,陈小强
(南京工业大学化工学院,材料化学工程国家重点实验室,江苏南京211816)
引 言
化学发光不需要外部光源的激发,是由分子间特定的化学反应产生的光发射现象,特定的化学反应一般是指经过氧化还原反应使分子处于高能态,随后跃迁至基态而产生的化学发光,这种发光现象避免了外部光源激发所引起的光散射和自体荧光的干扰,具有高灵敏度、高精确度等优点。常见的化学发光主要分为四大类:一是鲁米诺及其衍生物类,该类化学发光在碱性环境中发射蓝色光[1],主要被应用于胺、多肽、硫醇的标记中[2-6];二是光泽精及吖啶酯类,同样此类化学发光也需要在碱性溶液中进行,由于该类化学发光体系有量子产率高等优点,主要用于抗坏血酸、多巴胺、免疫球蛋白、酶、光遗传学等试剂的检测[7-11];三是过氧化草酸酯类,该类化学发光探针最大的亮点是发光最适宜的pH 为7.5,接近人体生理条件[12-14],主要应用于活性氧过氧化氢、免疫学分析[15-21];最后一类是1,2-二氧杂环丁烷类。相较于前三类而言,1,2-二氧杂环丁烷类不需要额外的氧化剂(双氧水、氧气、高锰酸钾等)参与,简化了分析过程,提高了检测灵敏度,扩大了化学发光的应用领域。
20 世纪80 年代,自Schaap 课题组报道第一例1,2-二氧杂环类化学发光探针以来,众多科研工作者对该类探针进行了广泛探索[22-27]。基于上述1,2-二氧杂环丁烷类化学发光的诸多优点,该类探针被广泛应用在离子、活性氧硫、生物标志酶的识别以及发光材料等四大方面。其发光机理如图1所示。
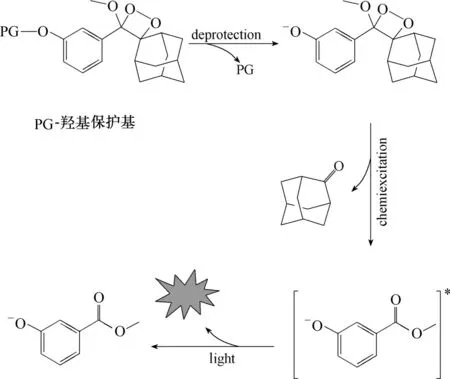
图1 金刚烷-二氧杂环丁烷的发光机理Fig.1 Luminescence mechanism of adamantane-dioxane
保护基(PG)在特定的反应条件下脱去形成酚氧负离子,经过化学反应引发电子交换发光机制(CIEEL)分解产生激发态的苯甲酸酯,随后跃迁回基态而产生化学发光[27-28]。本综述着重介绍近几年来金刚烷-二氧杂环丁烷类化学发光探针在离子检测、活性物种、酶识别以及化学发光材料方面的进展。
1 氟离子检测
阴离子在生物组织生长中起着重要的作用,因此近年来开发阴离子检测和识别的方法备受关注。氟是人体重要的微量元素之一,氟化物主要以氟离子的形式存在,其主要分布在人体的骨骼和牙齿中,适量的氟含量能预防骨骼疏松和龋齿等疾病[29-31],过量的氟摄入可能会导致结石或者癌症的发生[32-33]。
2014 年Akkaya 课题组[34]报道了检测F-的化学发光探针1(图2)。该探针结构高度对称,且分子结构中存在两个自脱除的基团,探针选择性识别F-后,分子内发生电子转移,脱去两个CO2分子,相对于只含一个发光团的探针结构,增加了发光团的数量,从而增强了化学发光强度。2017 年,该课题组在探针1的基础上开发了另外一种用于选择性检测F-的化学发光探针2[35](图3)。与探针1 不同的是该分子是一种自反馈型探针,该探针在选择性识别F-后,本身又会自发地释放F-,进一步增加了裂解后的探针数量,增强了化学发光强度。该探针水溶性较差、量子产率低的缺点,限制了其使用范围。因此,此类氟离子探针的水溶性和量子产率有待进一步提高。
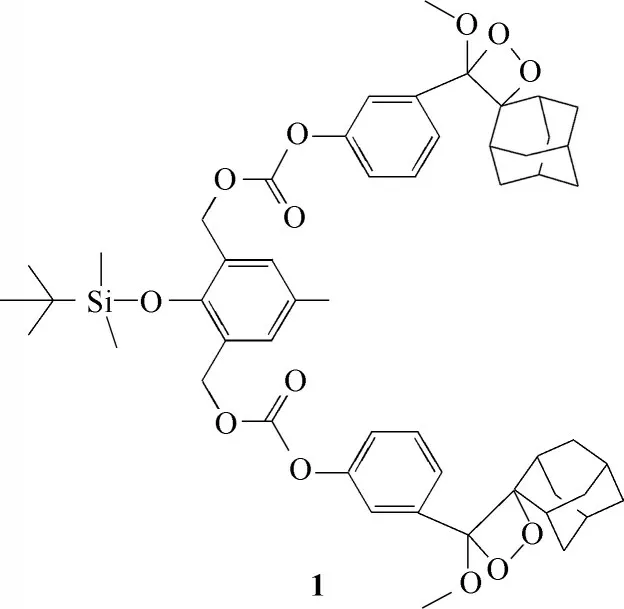
图2 探针1的分子结构Fig.2 Structure of probe 1
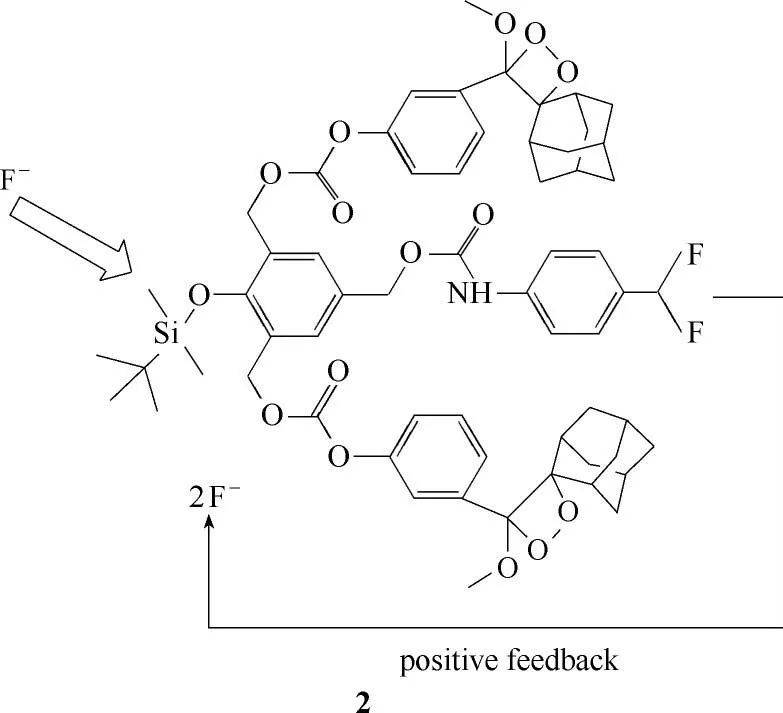
图3 探针2的分子结构Fig.3 Structure of probe 2
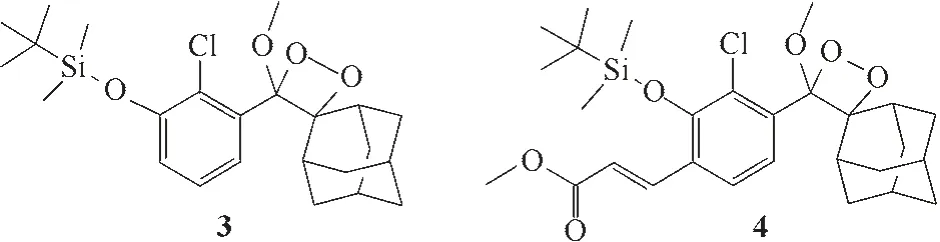
图4 探针3和4的分子结构Fig.4 Structures of probes 3,4
2019年本课题组Gu等[36]报道了基于金刚烷-二氧杂环丁烷的化学发光探针3(图4),并在3 的识别基团邻位引入吸电子基团丙烯酸甲酯得到探针4(图4),其化学发光寿命和波长得到很大的改善。在此基础上分别构建了与表面活性剂Emerald-Ⅱ联用的复合体系,实现了水溶液和生物体内氟离子的检测,且具有很好的选择性和较低的生物毒性。
2 活性物种的检测
生物活性物种,主要包括活性氧、活性氮、活性硫等,是细胞内重要的一类分子,参与细胞内信号的传导、免疫与代谢等生物学事件。在生物体内,这些活性物种的水平异常与心血管疾病、癌症等重大疾病[37-39]的发生有很高相关性。检测活性物种的方法一般有电子顺磁共振法[40]、荧光分析法[41]、高效液相色谱法[42]、化学发光法等。化学发光法因其具有高信噪比、操作简单等优点,已成为目前最主要检测活性物种的分析方法之一。
Cao 等[43]在2015 年报道了3 例基于1,2-二氧杂环的化学发光探针5、6、7(图5),并比较了这三种探针对H2S的检测性能。在加检测物后,5、6、7三种探针发光强度分别增加了5 倍、4 倍、12 倍。由此可见苯环上X 位置被Cl 取代后的探针7 发光效果最好,其检测限为5.4 μmol/L。影响化学发光的因素是苯酚-酚氧负离子之间的平衡和苯酚氧原子上的电荷密度。在pH 为7.4 的条件下,这三例探针的发光强度是由前者决定的,而探针7是最容易电离的,因此发射出最强的化学发光。这为进一步开发适用于生理环境的化学发光探针提供了研究基础。
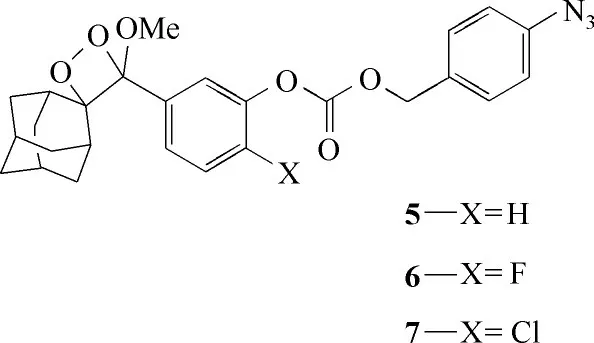
图5 探针5~7的分子结构Fig.5 Structures of probes 5—7
2017 年Hananya 等[44]报道了一种用于检测1O2的化学发光探针8、9(图6)。探针8可以和1O2反应形成二氧杂环丁烷,随后二氧杂环丁烷经化学激发分解,从而释放出非常强的绿光。为了能够实现在细胞中对1O2的检测,将细胞穿透肽(CPP)连接到探针8的丙烯酸基团上得到探针9。在荧光共聚焦显微镜下可以观察到探针9 可以很好地渗透入HeLa 细胞中成像[图6(b)]。最后,探针9可以在光动力疗法作用模式下对HeLa细胞内的1O2实现了有效的检测和成像[图6(b)]。这为化学发光探针进入细胞实现自发光成像提供了新的策略。
Turan 课题组[45]报道了2 个基于二氧杂环丁烷的化学发光探针10、11(图7),用于实现对H2O2的检测。在向探针10 和11 的溶液中加入H2O2后,都可以观察到亮蓝色的光,两例探针的检测限分别为240 μmol/L 和75 μmol/L,探针11 具有更低的检测限,并且在加入同等量的H2O2后,探针11 的发光强度更强。作者对检测机理进行了探究,认为探针11的发光强度更强是因为该探针含有两个自脱除的基团,增加了激发的化学发光基团数量,从而增强了化学发光强度。这种增强化学发光强度的方式为其他发光探针的设计提供了有益的探索。
由于荧光探针需要外部激发光的激发,由外部激发光所带来的光散射常常对检测造成干扰,而自发光不需要外部激光的导入,因此规避了以上缺陷。2018年,Yang课题组[46]根据Payne/Dakin反应机理,设计并合成了基于荧光发射用于检测H2O2的荧光探针12 和13(图8)。2020 年,同样基于该检测机理,Ye 等[47]合作报道了一例可用于细胞和动物活体中过氧化氢实时监测的化学发光探针14(图8)。在没有任何激发光的存在下,探针14 溶液中加入10个当量的H2O2后,该溶液的发光强度在3 min 内提高了430 倍。其机理在于探针14 与H2O2反应后,水杨醛被氧化为邻苯二酚,随后进行醚裂解,最后进行化学激发从而释放化学发光。
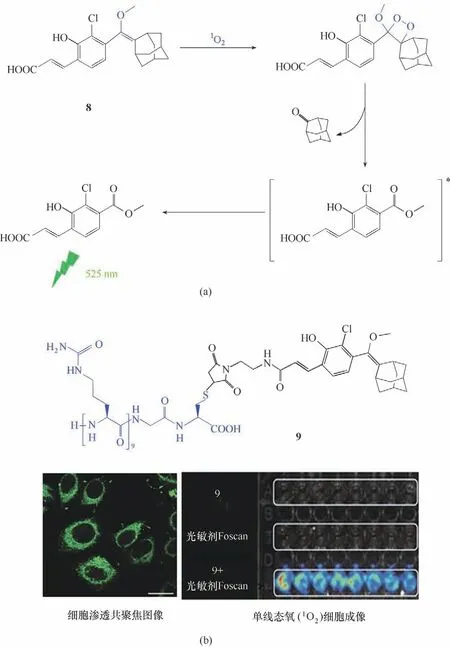
图6 探针8化学发光机理(a)及探针9细胞渗透共聚焦荧光成像与检测1O2的细胞成像图(b)[44]Fig.6 Chemiluminescence mechanism of probe 8(a)and cell permeability confocal fluorescence imaging and cell imaging for detection of 1O2 of probe 9(b)
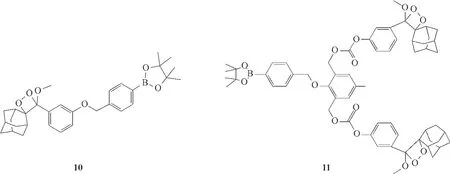
图7 探针10、11的分子结构Fig.7 Structures of probes 10,11
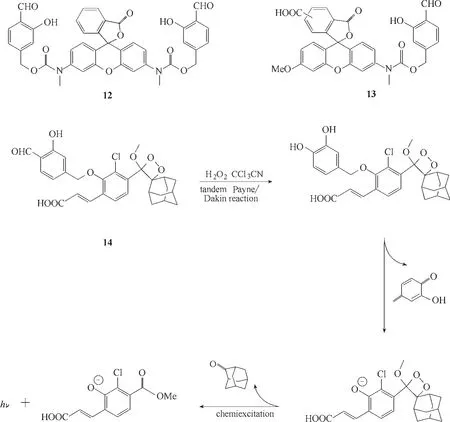
图8 探针12~14的分子结构及发光机理Fig.8 Structures and luminescence mechanism of probes 12—14
3 酶的检测
酶是生物体内一种重要的生物大分子,生物体内各种生物事件的运转都离不开酶的参与,另外酶的活性还与肿瘤疾病的发生有关[48]。目前判断肿瘤的恶化程度常通过核磁共振、正电子发射断层扫描等技术,这类方法比较烦琐且分辨率较低。随着人们对酶的认识越来越深入,发现多种酶在肿瘤中的表达异于正常组织,因此,酶的过量表达常作为肿瘤标志物来判断疾病的发生,例如β-半乳糖苷酶[49]、硝基还原酶[50-52]、组织蛋白酶B[53]等常常作为肿瘤的标志酶。
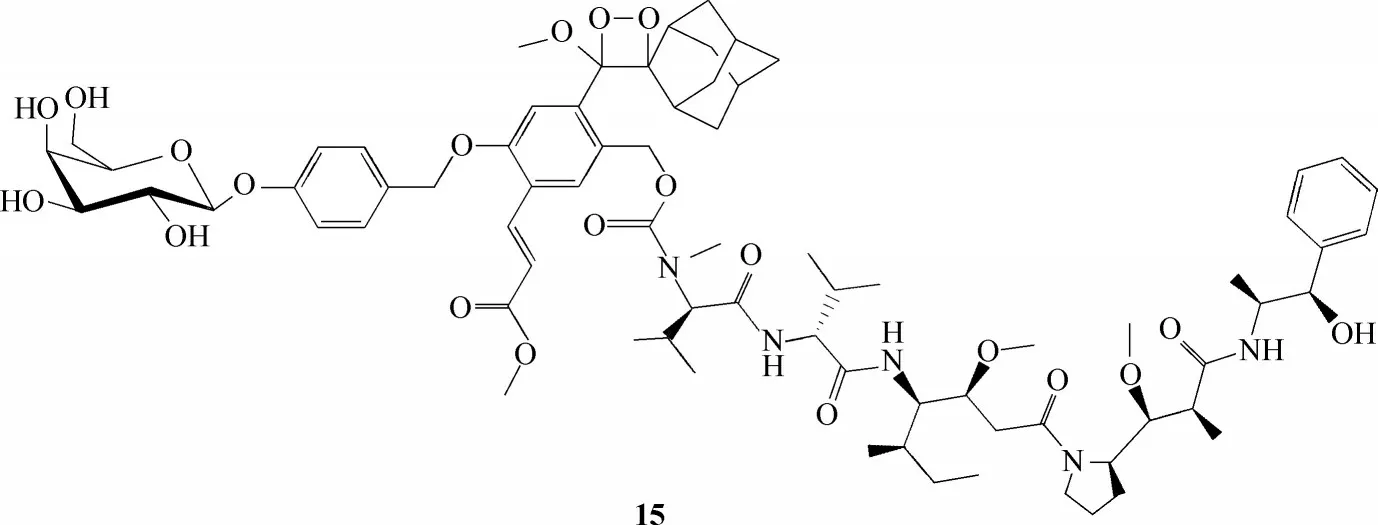
图9 探针15的分子结构Fig.9 Structure of probe 15
Gnaim 等[54]报道了通过化学发光模式实时监测药物前体探针15 在细胞内被活化的过程(图9)。他们选择了单甲基澳瑞他汀E并将其修饰制备了药物前体,该药物前体可被β-半乳糖苷酶激活。在β-半乳糖苷酶的存在下,药物前体被活化伴随着绿光的发射,发光强度随着药物前体浓度的增加而增加。这种以化学发光监控药物的释放具有低背景干扰等优点,因此具有很大的应用空间。
Eilon-Shaffer 等[55]报道了两种基于二氧杂环丁烷的化学发光探针16和17用于识别β-半乳糖苷酶(图10)。两个探针的区别是探针17在酚羟基的邻位引入了吸电子基——氯。酚环上的氯取代基是为了在切割β-半乳糖苷酶底物后降低所释放发射物的pKa值,这样的pKa可以使二氧杂环丁烷的化学激发在生理条件下发生。在pH 等于5.5时,探针17具有更高的发光信号,约是探针16 的20 倍,另外,探针17 的光稳定性比16 的更好。在细胞成像中,两个探针和CT26-LacZ 在相同条件下共孵育后,观察到探针17 的发光强度更高,约是探针16 的10 倍。为了更好地使探针在细胞内成像,他们在探针16和17 的结构中引入了具有高溶解度和肿瘤定位作用的多肽-CGKRK,得到探针18、19。探针19 实现了患有CT26-Lac Z肿瘤小鼠体内的化学发光成像。
一直以来,在水环境下金刚烷-二氧杂环丁烷类化学发光探针的化学发光效率较低,为了解决这一难题,可将探针与环糊精结合形成超分子化合物,该超分子化合物的水溶性和发射波长得到了很大改善。基于此,Gnaim 等[56]报道了二氧杂环丁烷化学发光探针20、23 和环糊精(TMCD)形成1∶1 主客体复合物探针21、22、24(图11)。在水溶液中,探针20几乎不发光,而形成的主客体复合物21则会发出亮光,强度约为探针20 的60 倍。随后,将荧光素染料共价连接到TMCD 上,得到化合物TMCD-FITC,再将探针20 包进TMCD-FITC 得到新的超分子复合物22。在水溶液中,复合物22的发光强度约是探针20 的1500 倍。为了实现这种主客体复合物在体内外成像的应用,他们将化学发光探针23 和TMCDFITC 结合得到复合物24,复合物24 在HEK-293-LacZ 细胞中进行孵育,随后观察到了很强的化学发光信号。
Cheng 等[57]报道了一例用于肝中毒过程检测的化学发光探针25(图12)。该研究的亮点在于包含两个成像通道——近红外和化学发光通道,即探针既可以通过化学发光通道检测超氧负离子(O2•-,CF3SO3—为其识别基团),也可以通过近红外通道检测Caspase-3(-DVED-AC 为其识别基团),且两通道之间相互独立,互不影响。在肝中毒小鼠模型中也成功验证了探针25的双功能成像能力。另外,用探针25 检测到肝中毒的时间比组织学分析提前了17.5 h,这充分体现了化学发光法在生物检测和成像应用中的优势。
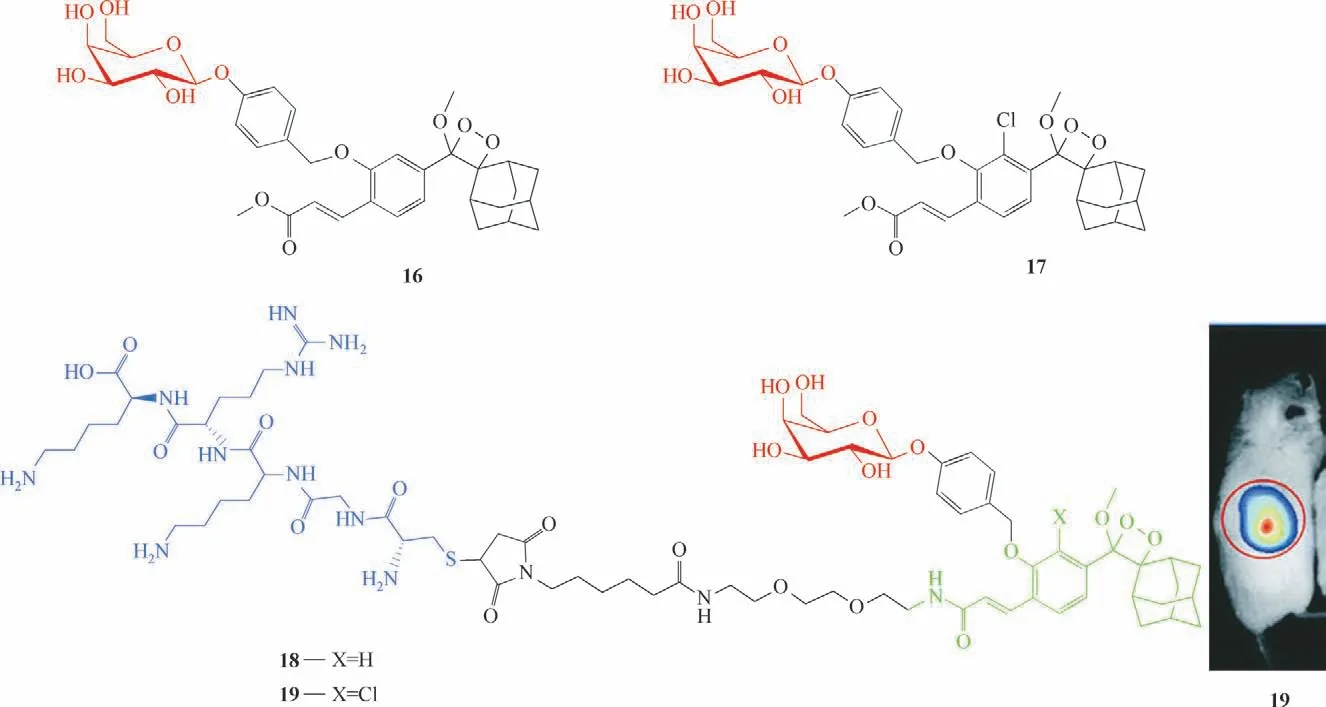
图10 探针16~19的分子结构及探针19的肿瘤活体成像图[55]Fig.10 Structures of probes 16—19 and in vivo tumor imaging of probe 19[55]
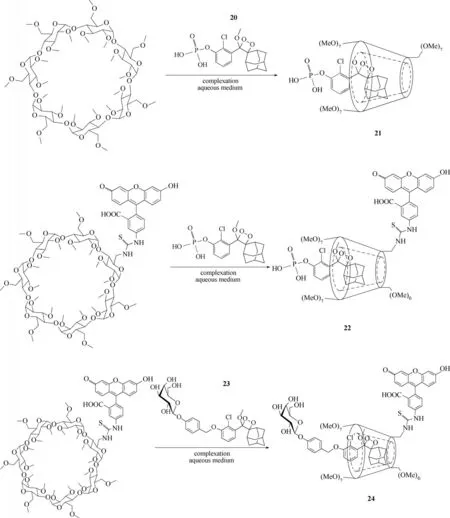
图11 探针20~24的分子结构Fig.11 Structures of probes 20—24
Das 等[58]合作报道了一种基于碳青霉烯功能化的化学发光探针26,该探针可以成功检测活细菌中碳青霉烯酶的活性(图13)。探针26 作为碳青霉烯酶的底物可被该酶选择性水解,然后进行1,6-消除反应,并通过快速化学激发发射出绿光。探针对碳青霉烯酶的检测限低至0.06 mU/ml。
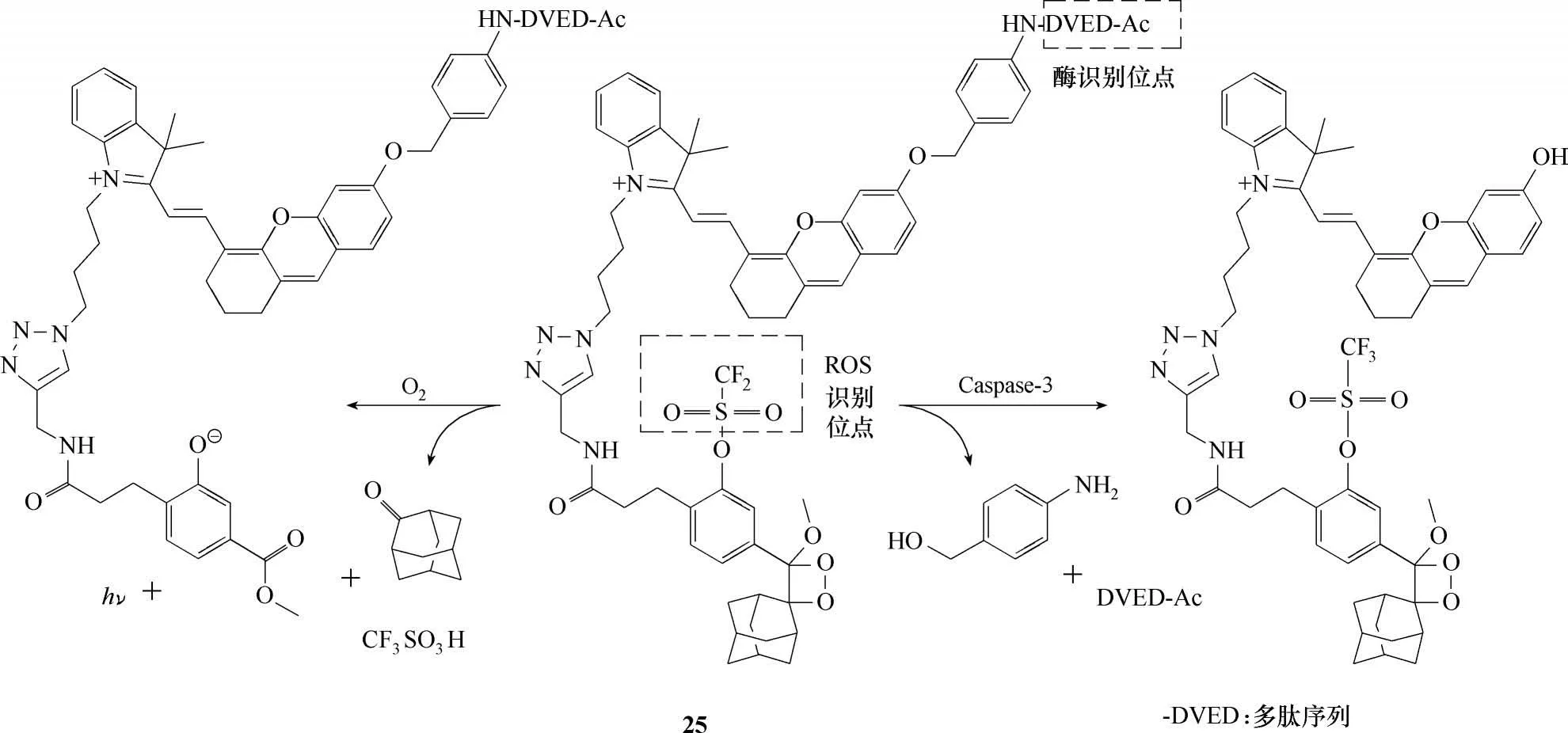
图12 探针25的分子结构及发光机理Fig.12 Structure and luminescence mechanism of probe 25
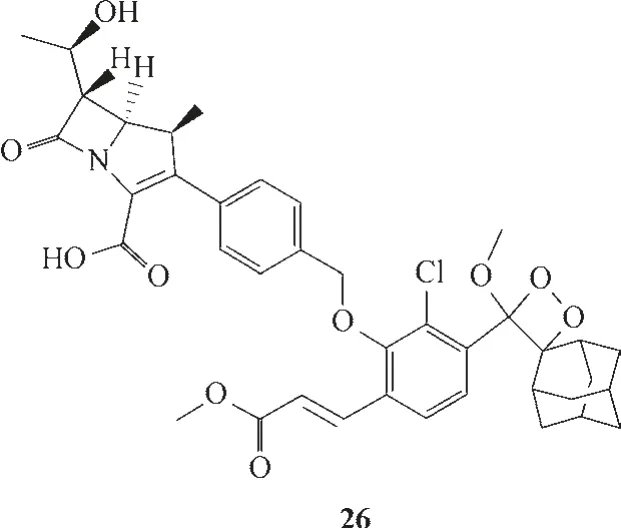
图13 探针26的分子结构Fig.13 Structure of probe 26
乏氧是实体肿瘤的常见特征,这是由氧气供需不平衡引起的。随着肿瘤细胞中乏氧的产生,硝基还原酶(NTR)表达水平会提高。因此NTR 可作为生物乏氧的常见标志,广泛用于评估肿瘤的乏氧程度。Sun 等[59]报道了一种高水溶性化学发光探针27,该探针可用于动物体内硝基还原酶(NTR)的高灵敏度检测和成像(图14)。探针本身不发光,而接触NTR 后,探针分子对硝基苄基部分转化为4-羟胺苄基,然后进行1,6-重排消除并引发电子转移,导致二氧杂环丁烷分解,随后产生强化学发光输出信号。经硝基还原酶处理后,探针27发光强度增加了6000倍,化学发光强度与NTR 浓度在3~55 ng/ml 范围内呈正比,检测限低至0.947 ng/ml。此外,探针27 成功监测了肿瘤小鼠在不同氧含量(100%、21%、7%~10%)条件下的内源性NTR成像。
同样,Cao 等[60]设计报道了两种基于金刚烷-1,2-二氧杂环丁烷化学发光反应的成像探针28和29,它们在生理pH 下与硝基还原酶反应后均可立即发光(图15)。但探针28 与硝基还原酶反应后发光强度只增加了约5 倍,而探针29 增加了约170 倍。另外,探针29 的选择性也明显优于探针28,这是由于探针29分子中的醚键更稳定,导致发光背景大大降低。此外,探针29还成功应用于乏氧条件下硝基还原酶的体内成像。
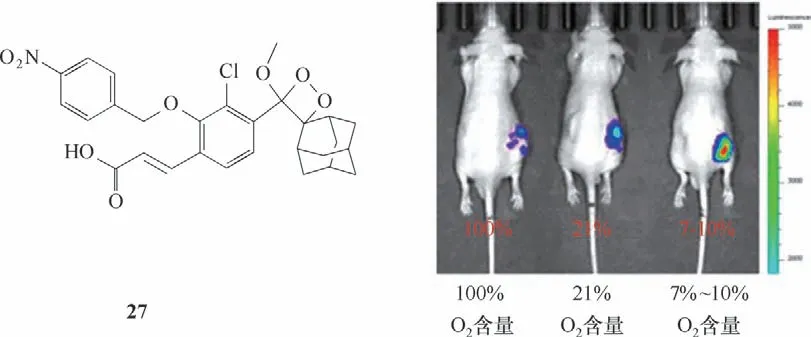
图14 探针27的分子结构及在不同氧气含量下的活体成像图[59]Fig.14 Structure of probe 27 and in vivo imaging under different oxygen conditions[59]
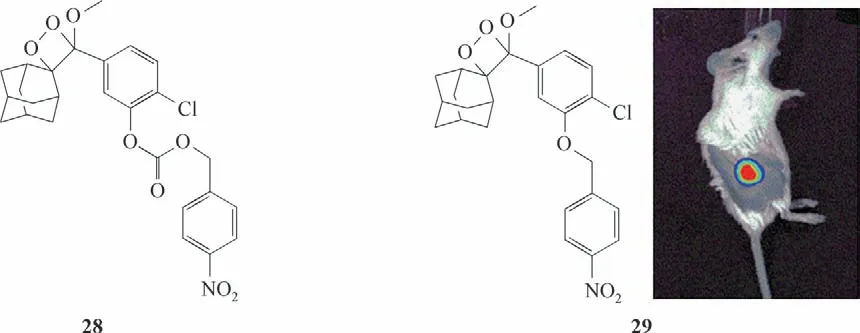
图15 探针28、29的分子结构及探针29的活体成像图[60]Fig.15 Structures of probes 28,29 and in vivo imaging of probe 29[60]
Shabat 课题组[61]首次报道了用于组织蛋白酶B检测和成像的化学发光探针30、31、32、33(图16)。在向上述4 例探针溶液中加入组织蛋白酶B 后均观察到化学发光,其中,探针33 的检测限为76.29 μU/ml。更重要的是探针33 的发光强度远高于其他三个探针,这可能是因为该探针在探针32的结构上引入了水溶性强且具有定位作用的多肽KAPGC。随后,对探针33 进行了细胞成像研究,在该探针和Raw 264.7、CT26 分别进行孵育后化学发光产生,实现了对细胞中组织蛋白酶B的检测。
Zhang 等[62]在2020 年报道了基于次序激活的双重锁定化学发光染料探针34、35(图17)。设计新策略是将识别过程和光子释放过程次序触发,成功实现了检测物的特异性识别与光控的次序性响应。底物分子首先与分析物通过识别作用生成具有稳定的化学发光中间体,该中间体是导致化学发光的关键,并随着识别过程逐渐累积;随后,在光控作用下生成1,2-二氧杂环丁烷的高能结构,最后释放出明亮的化学发光。利用该策略设计合成了检测β-半乳糖苷酶的探针34 以及活性氧过氧化氢的探针35。这种双锁-次序性响应的设计新策略,有效地解决了传统辉光型发光检测过程的光子不可控、发光信号弱的难题。
金刚烷-二氧杂环丁烷类化学发光探针因其本身发光效率低,发射波长短,使其在细胞及活体应用中受到了一定的限制。但经过相应结构的修饰,比如引入环糊精、强吸电子基团、细胞穿透肽等,其发光强度及水溶性得到很大的改善。基于此,该类探针已被广泛应用于细胞及活体中的酶活性检测。
4 化学发光材料
单分子化学发光探针存在两个不足:(1)发射波长较短;(2)水溶性、稳定性较差。这些不足之处限制了其在生物学上的应用。在此基础上,很多研究着重于解决上述问题。解决方法主要是把该类化学发光探针与环糊精复合构成超分子体系或者与半导体结合构建纳米粒子。
Ni 等[63]在2019 年报道了具有聚集诱导发射(AIE)特性的近红外余辉发光纳米粒子探针36(图18)。该纳米粒子合成方法是用脂质体-PEG2000通过纳米共沉淀法包裹36a 和化合物36b。发光机理是近红外荧光分子36a在白光照射下产生1O2,1O2随后氧化化合物36b 形成二氧杂环丁烷36c,36c 随后发生自分解形成激发态的36d,其跃迁回基态伴随着自发光的产生,随后将能量转移回近红外荧光分子36a,最终释放近红外余辉发光,并持续10 d 以上。在体内的NIR 余辉信号可以在正常组织(例如肝脏)中快速淬灭,而在肿瘤中可以长时间发光,从而导致超高的肿瘤-肝脏信号比(比荧光成像的要高近100 倍)。因此,纳米颗粒36 在癌症手术中可提供精确的图像引导。
Roda 等[64]在2012 年报道了一种掺杂二氧杂环丁烷的二氧化硅纳米颗粒探针37(图19),这种纳米颗粒可以作为生物分析中超灵敏的热化学发光标记。纳米颗粒探针37 的热化学发光发射可以在低温(低于100°C)下触发,由于基于吖啶基类1,2-二氧杂环丁烷分子在每个纳米粒子中负载量大(约104个),发光信号被大大放大,并且由于能量转移到荧光受体双嘧达莫上,而提高了发射效率。
Andronico 等[65]报道了基于热化学发光的半导体聚合物点探针38(图20)。他们通过纳米共沉淀法,将荧光分子38a、聚合物38b、二氧杂环丁烷衍生物38c合成单分散的热致发光半导体聚合物点探针38。半导体聚合物点探针38 表现出很好的时间稳定性。每个半导体聚合物点探针38 里大约掺杂了20 个二氧杂环,它的发光强度大大增强;另外,该聚合物点在加热至110℃时,1, 2-二氧杂环丁烷分解生成电子激发态的38d,该产物与掺杂的荧光分子38a 产生FRET 效应,从而产生强烈的红光。随后,他们将链霉亲和素共价结合到该聚合物表面上,以应用到生物检测中。在免疫测定中,半导体聚合物点探针38 检测免疫球蛋白G(lgG)的检测限低至13 nmol/L,动态范围扩展至230 nmol/L。
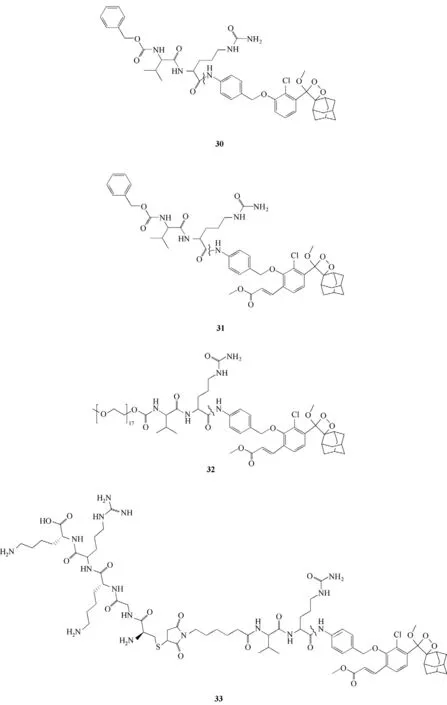
图16 探针30~33的分子结构Fig.16 Structures of probes 30—33
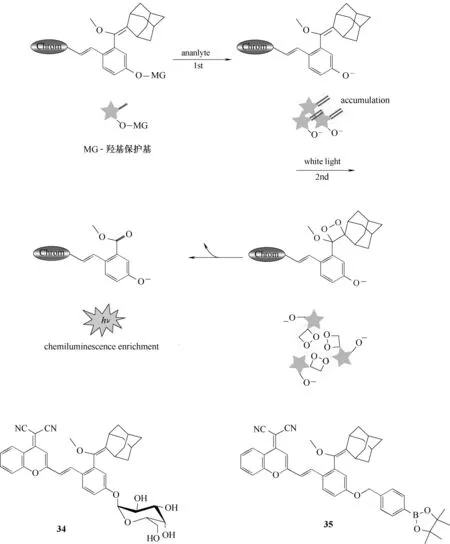
图17 发光机理及探针34、35的分子结构Fig.17 Luminescence mechanism and structures of probes 34,35
Sijbesma 课题组[66]报道了关于二氧杂环丁烷掺入热塑性弹性体中得到化学发光材料探针39、40、41的工作(图21)。其过程是二氧杂环丁烷单元被嵌入到聚四甲氧基聚合物主链中,施加应变后,四元环断裂导致聚合物测试样品发光。他们以上述三种不同结构为基础,从聚合物总分子量、二氧杂环单元含量、氢键以及所受应力强弱四个维度探讨了对发光强度的影响,证明了该聚合物发光强度与上述四个维度呈正相关性。
马林斯效应是指橡胶类材料在应力超过最大承受值时发生应力软化的现象[67-72]。Clough 等[73]研究了共价键断裂在机械记忆各向异性中的作用。在填有二氧化硅的聚二甲基硅氧烷中的机械发光交联剂受到应力会诱导发光,这是由于该交联剂中所包含的二氧杂环丁烷可在强制诱导键断裂时发光,基于该机理,设计并合成了填充弹性体发光材料探针42(图22)。在该材料中,二(金刚烷基)-1,2-二氧杂环丁烷作为发光基团是通过共价结合的,该材料在受到一定外部应力的作用下,基团中心四元环共价键优先断裂,随后发出化学发光,以达到实时可视化监测机械应力变化的作用。
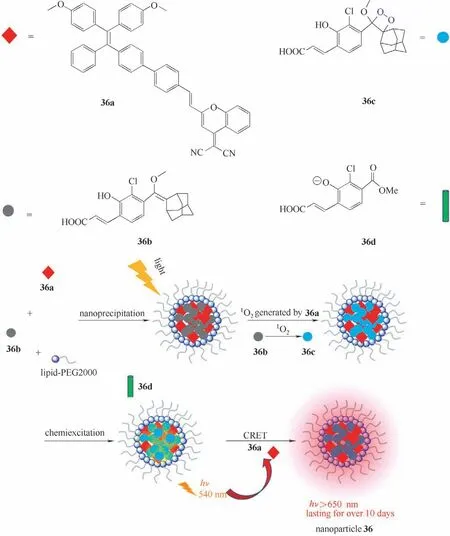
图18 纳米粒子36的合成过程及发光机理Fig.18 Synthesis and luminescence mechanism of nanoparticle 36
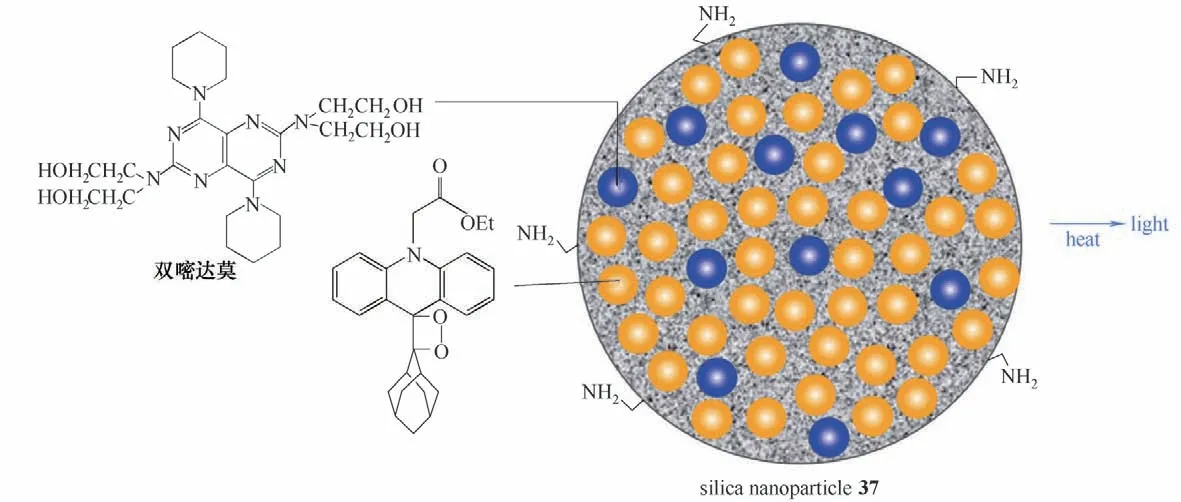
图19 二氧化硅纳米颗粒37的结构和发光机理Fig.19 Structure and luminescence mechanism of silica nanoparticles 37
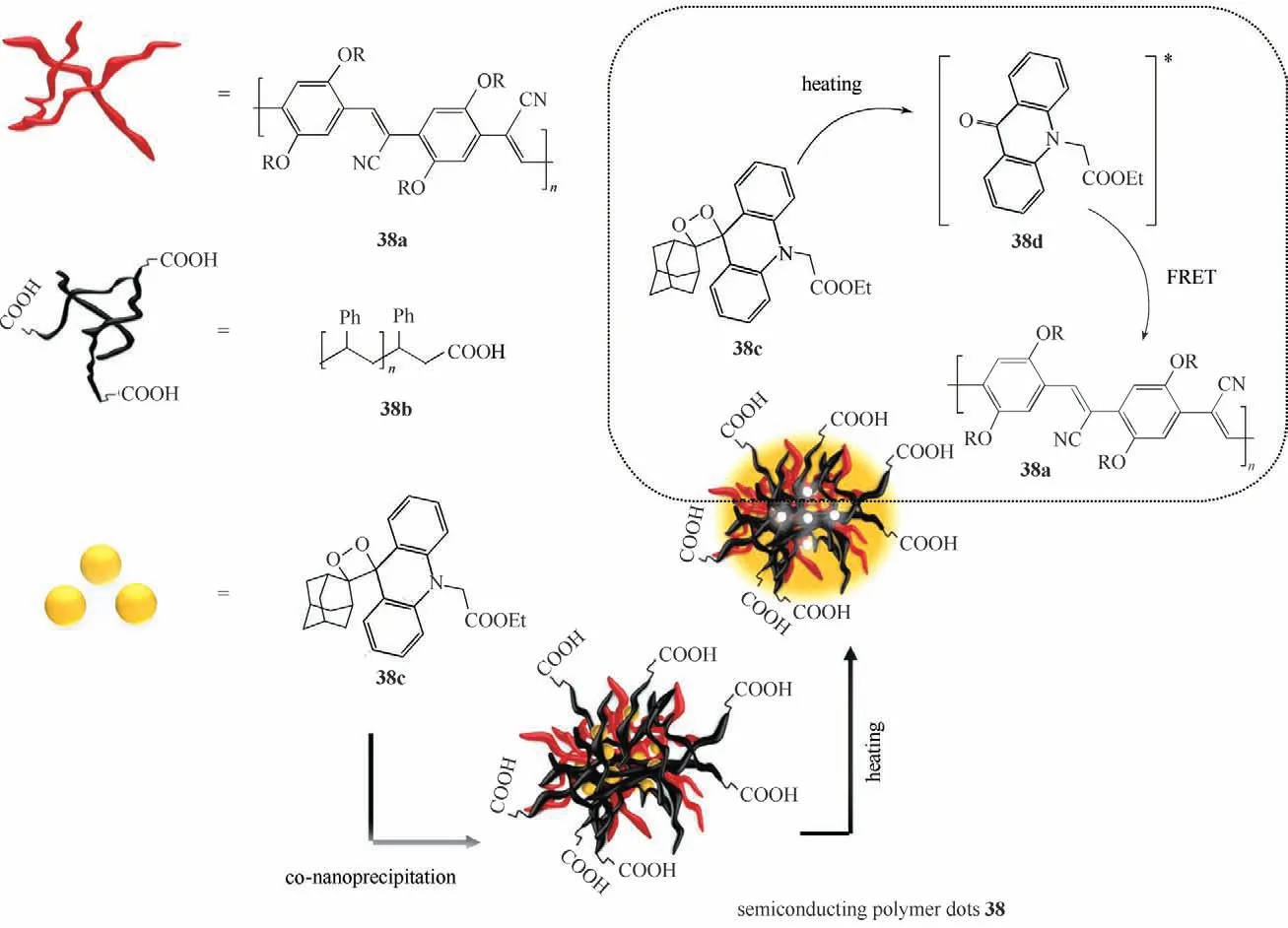
图20 半导体聚合物点38的结构和发光机理Fig.20 Structure and luminescence mechanism of semiconducting polymer dots 38
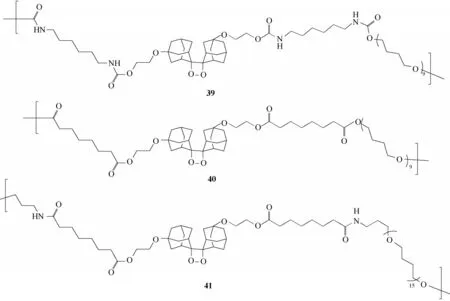
图21 化学发光材料39~41的结构Fig.21 Structures of chemiluminescence materials 39—41
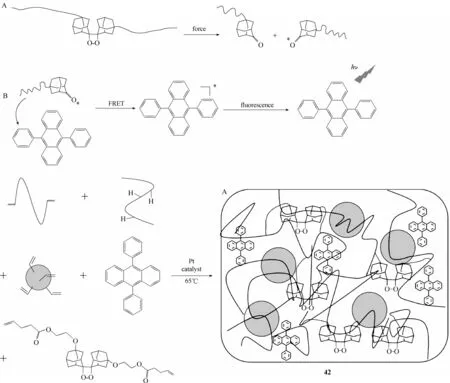
图22 化学发光材料42的发光机理及结构Fig.22 Luminescence mechanism and structure of chemiluminescence material 42
Cui等[74]报道了一类半导体纳米颗粒,可用于药物诱导的癌症免疫激活的体内化学发光成像。该类半导体纳米颗粒分别由三种不同的半导体聚合物SP1、SP2、SP3 与金刚烷-二氧杂环底物组成,其中半导体和金刚烷-二氧杂环底物分别作为化学发光的受体和供体,其结构分别为探针43、44、45(图23),半导体聚合物本质上是有荧光的,但只有在O2•-的激活下才会变成化学发光。当纳米颗粒探针43、44 被O2•-激活后发黄绿色光(540 nm),而纳米颗粒探针45被O2•-激活后发近红外光(700 nm),可灵敏地检测出毒性T细胞中较高的O2•-水平,因此将其与其他细胞(包括癌症和正常细胞)区分开。
金刚烷-二氧杂环丁烷类化学发光探针因结构中过氧桥键的不稳定性,易受力或者热等外部因素的干扰而断裂,致使化学发光的产生。利用这种特性,热致发光材料、弹性材料等被开发出来。同样,纳米粒子因其有良好的生物相容性、结构易修饰等优点,众多纳米粒子包裹该类化学发光探针生物材料也被开发出来。
5 总结与展望
本文基于金刚烷-二氧杂环丁烷类化学发光机理、结构特点、识别机理等,介绍了此类化学发光探针在离子检测、活性物种和生物标志酶的识别以及发光材料等方面应用的特点和优势。虽然这类化学发光探针有诸多优点,也取得了一定的进展,但仍然还有一些亟待解决的问题。
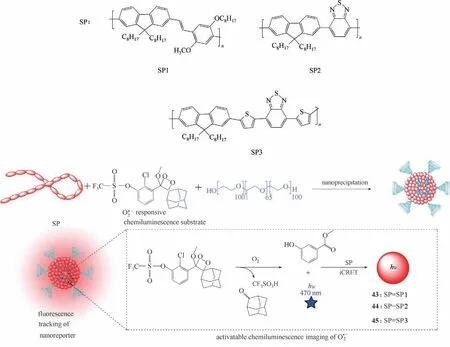
图23 半导体纳米粒子43~45的结构及检测机理Fig.23 Structures and detection mechanism of semiconductor nanoparticles 43—45
(1)该类化学发光探针合成路线较长,需要继续开发出更加优良的合成方法学。
(2)这类化学发光探针显著的缺点是水溶性较差,一定程度上限制了生物学应用,目前改良水溶性问题的方法还是比较单一且合成复杂。
(3)为了使金刚烷-二氧杂环丁烷类化学发光探针有更好的生物学应用,在探针结构中引入强吸电子基团更好地改善了探针发光效率,但解决方式单一,需要探索更广泛的方法。
发射波长处于近红外窗口更有利于生物学应用,但该类探针单分子发射波长并不能达到近红外窗口。目前大量研究是聚焦于延长发射波长,解决方式主要有:与环糊精构建超分子体系或者与具有聚集诱导发光性能的荧光探针构建纳米粒子。但是目前这些方法实施后,发射波长最多能达到近红外窗口Ⅰ(NIR-Ⅰ,700~900 nm),仍需要开发处于近红外窗口Ⅱ(NIR-Ⅱ,1000~1700 nm)的化学发光探针。
