miR-17-5p对小梁网细胞外基质蛋白表达的调控作用及其机制△
2021-01-29夏侯梨胡军华吴碧廖莹琳
夏侯梨 胡军华 吴碧 廖莹琳
原发性开角型青光眼(POAG)是一种由多种因素诱发的、伴随进行性视力丢失和视野缺损的致盲眼病。眼内房水排出受阻引发的眼压升高是POAG发病的主要原因[1]。人眼中70%以上的房水引流是通过小梁网进行的,小梁网眼间隙自内层葡萄膜小梁向外层临管区逐渐变小,小梁网细胞(HTMCs)通过收缩改变网状结构大小,进而调整房水排出速率[2-3]。细胞外基质(ECM)是存在于细胞之间的动态网状结构,主要包括胶原、糖蛋白、蛋白聚糖、葡萄糖糖苷等成分,组成细胞骨架结构,参与细胞的迁移、增生、纤维化等生理过程[4-5]。正常生理条件下,小梁网中的ECM被不断的分泌、降解,这一过程的动态平衡是维持房水引流途径稳态的重要条件。研究表明,小梁网组织间隙内ECM的代谢异常,导致ECM异常聚集,是导致小梁网途径房水排出受阻的主要原因[5-6]。miRNA是一类内源性表达的非编码RNA,在基因转录后的调控过程中发挥重要作用,能通过与靶基因相互作用调节基因表达[7]。miR-17-5p是近年来研究较多的miRNA,有报道证实,miR-17-5p在氧化应激条件下的人HTMCs中呈低表达[8],同时,miR-17-5p在多种细胞纤维化过程中发挥调控作用[9-10]。然而其对HTMCs ECM蛋白表达的调控作用尚鲜有报道。本研究探讨了miR-17-5p在POAG患者小梁网组织中的表达,同时探讨了其对HTMCs的ECM蛋白表达的调控作用及其机制。
1 材料与方法
1.1 材料
1.1.1 临床标本选择2017年10月至2019年4月于新余市人民医院眼科确诊为POAG并行小梁切除术的患者15例15眼,其中男11例11眼、女4例4眼,年龄为24~63(32.31±8.24)岁,符合中华医学会《我国原发性青光眼诊断和治疗专家共识》中POAG诊断标准,所纳入病例均签署知情同意书。排除标准:(1)急、慢性闭角型青光眼患者;(2)虹膜睫状体炎等其他眼部疾病所引起的眼压升高者。所纳入研究的患者行小梁切除术后将小梁网组织投入液氮中保存。正常小梁网组织供体选自江西省眼库,共15例15眼,其中男10例10眼、女5例5眼,年龄23~59(31.05±10.54)岁,所纳入供体者无眼部疾病史。本研究经我院医学伦理委员会审核批准。
1.1.2 细胞来源及主要试剂HTMCs购自中科院细胞库。含胎牛血清(FBS)DMEM培养基(上海碧云天生物技术有限公司);miR-17-5p mimics类似物(miR-17-5p mimics)和miR-17-5p阴性对照(miR-17-5p NC)序列由上海吉玛基因公司合成;Lipofectamine 2000、实时荧光定量PCR试剂盒、抗Smad3抗体(ab2413)、抗纤连蛋白(FN)抗体(ab2413)、抗胶原蛋白I(CoL-I)抗体(ab34710)、抗α-平滑肌肌动蛋白(α-SMA)抗体(ab11575)、山羊抗兔IgG H&L(HRP)(ab6721)(美国Abcam公司);Transwell小室试剂盒(上海碧云天生物技术有限公司);Smad3过表达载体(pcDNA3.1-Smad3)、对照载体pcDNA(上海和元生物技术股份有限公司)。
1.2 方法
1.2.1 RT-PCR检测正常小梁网和POAG患者小梁网组织中miR-17-5p表达分别取冻存的两种小梁网组织,液氮中充分研磨,加入Trizol,振荡混匀,提取总RNA,检测RNA纯度,构建20 μL反应体系,其中miR-17-5p上游引物序列:5’-CGGCTTAGCTTCGATGGCTA-3’,下游引物序列:5’-CGGCTTAGCTTAGCTTCGAC-3’;GAPDH上游引物序列:5’-ATTTCGATTCGGCTAGGCTA-3’,下游引物序列:5’-TGCTAGGCATTAGCTTAGCC-3’。反应条件:50 ℃反应2 min,94 ℃预变性2 min,1个循环;94 ℃变性10 s,共40个循环。使用Quantity One程序得到miR-17-5p表达的荧光强度(Ct值),采用2-△△Ct法计算相对表达量。
1.2.2 细胞复苏与培养将冻存的HTMCs复苏重悬于含体积分数10%FBS的DMEM培养基中,置于37 ℃、含体积分数5%CO2细胞培养箱中传代培养。待细胞融合至80%左右时,2.5 g·L-1胰蛋白酶消化,4 ℃下以3000 r·min-1离心5 min,弃上层培养基,PBS洗涤2次,接种于新的培养瓶继续培养。
1.2.3 细胞分组与转染转染前24 h将待转染HTMCs转移至6孔板中,调整细胞密度为500×103个·mL-1,待细胞融合至80%以上时,按照Lipofectamine 2000说明书中所示步骤,将miR-17-5p mimics、miR-17-5p-NC和Lipofectamine 2000分别用DMEM培养液稀释,室温孵育5 min,将miR-17-5p mimics、miR-17-5p-NC稀释液分别与Lipofectamine 2000混合室温下放置15 min,将上述混合液分别加入miR-17-5p mimics组和miR-17-5p-NC组细胞培养液内继续培养,以供后续实验使用。
1.2.4 Western blot检测小梁网组织中Smad3蛋白及各转染组HTMC中ECM相关蛋白的表达将转染后HTMCs继续培养24 h后,RIPA裂解液提取总蛋白,BCA试剂盒检测总蛋白浓度,经SDS-PAGE分离蛋白,用半干转膜仪转移蛋白至PVDF膜,脱脂牛奶室温封闭蛋白2 h,加入相应一抗Smad3(11000)、FN(11000)、CoL-I(11000)、α-SMA(1500)、GAPDH(12000),4 ℃封闭过夜,加入二抗(12000),室温封闭1 h,加入ECL曝光,以GAPDH为内参,使用Quantity One软件分析各种蛋白条带灰度值。
取冻存的小梁网组织,RIPA裂解液提取总蛋白,以上述方法检测Smad3(11000)蛋白表达。
1.2.5 miR-17-5p靶基因预测及双荧光素酶报告基因分析采用靶基因数据库TargetScan、miRanda预测miR-17-5p下游靶基因为Smad3,将Smad3与miR-17-5p结合互补区突变并构建荧光素酶报告载体,将野生型Smad3(Smad3-3’-UTR-WT)和突变型Smad3(Smad3-3’-UTR-MT)分别与miR-17-5p mimics/NC共转染至HTMCs,培养24 h后依据荧光素酶检测试剂盒检测Smad3荧光素酶活性变化。每组实验独立重复3次,取平均值。
1.2.6 Smad3转染与否对HTMCs中FN、CoL-I、α-SMA和Smad3蛋白表达的影响将对数期HTMCs接种至6孔板,调整细胞密度为500×103个·mL-1,将miR-17-5p mimics+pcDNA3.1-Smad3、miR-17-5p mimics+pcDNA,分别用Lipofectamine 2000转染至HTMCs作为miR-17-5p +Smad3组和miR-17-5p +vector组,转染24 h后Western blot检测各转染组细胞中FN(11000)、CoL-I(11000)、α-SMA(1500)和Smad3(11000)蛋白表达。
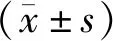
2 结果
2.1 正常和POAG患者小梁网组织中miR-17-5p表达比较正常小梁网组织中miR-17-5p相对表达量为1.16±0.11,POAG患者小梁网组织中miR-17-5p相对表达量为0.19±0.05,显著低于正常小梁网组织,差异有显著统计学意义(t=10.641,P<0.001);正常小梁网组织中Smad3蛋白相对表达量为0.34±0.08,POAG患者小梁网组织中Smad3蛋白相对表达量为0.87±0.10,显著低于正常小梁网组织,差异有显著统计学意义(t=8.105,P<0.001;见图1)。
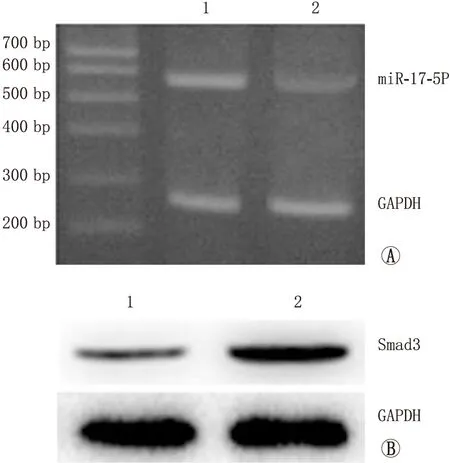
图1 正常和POAG患者的小梁网组织中miR-17-5p和Smad 3表达 A:RT-PCR检测的小梁网组织中miR-17-5p表达;B:Western blot检测的小梁网组织中Smad 3蛋白表达。1:正常小梁网组织;2:POAG患者小梁网组织。
2.2 miR-17-5p NC组和miR-17-5p mimics组HTMCs 中FN、CoL-I和α-SMA蛋白表达miR-17-5p mimics组HTMCs中FN、CoL-I和α-SMA蛋白表达均低于miR-17-5p NC组,差异均有统计学意义(tFN=10.244、tCoL-I=6.546、tα-SMA=5.228,均为P<0.001;见图2、表1)。
表1 miR-17-5p NC组和miR-17-5p mimics组HTMCs中FN、CoL-I和α-SMA的蛋白相对表达量

图2 Western blot检测两组HTMCs中FN、CoL-I和α-SMA蛋白表达 1:miR-17-5p mimics组;2:miR-17-5p NC组
2.3 miR-17-5p靶基因预测及双荧光素酶报告基因分析miR-17-5p通过靶向识别3’-UTR抑制Smad3的表达双荧光素酶报告系统结果显示,转染野生载体后,miR-17-5p NC组荧光素酶活性为1.77±0.10,miR-17-5p mimics组荧光素酶活性为0.87±0.08,显著低于miR-17-5p NC组(t=8.024,P<0.001);转染突变载体的miR-17-5p NC组荧光素酶活性为1.38±0.06,miR-17-5p mimics组荧光素酶活性为1.41±0.05,两组间差异无统计学意义(t=0.514,P=0.597)(图3A);miR-17-5p mimics组HTMCs中Smad3蛋白表达为0.10±0.03,miR-17-5p NC组Smad3蛋白表达为0.85±0.06,显著高于miR-17-5p mimics组(t=13.260,P<0.001;见图3B)。
图3 miR-17-5p靶基因预测及两组中Smad 3蛋白表达 A:生物信息软件检测miR-17-5p和Smad3潜在结合位点,双荧光素酶报告基因实验检测miR-17-5p和Smad3的靶向关系;B:两组中Smad 3表达比较。1:miR-17-5p mimics组;2:miR-17-5p NC组。
2.4 Smad3转染与否对HTMCs中Smad3、FN、CoL-I和α-SMA蛋白表达的影响miR-17-5p+Smad3转染组HTMCs中Smad3、FN、CoL-I和α-SMA蛋白表达均高于miR-17-5p+vector转染组,差异均有统计学意义(tSmad3=6.200,P<0.001;tFN=6.347,P<0.001;tCoL-I=5.201,P<0.001;tα-SMA=7.355,P<0.001;见表2,图4)。
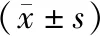
表2 Smad3转染与否对HTMCs中FN、CoL-I、α-SMA和Smad3蛋白表达的影响
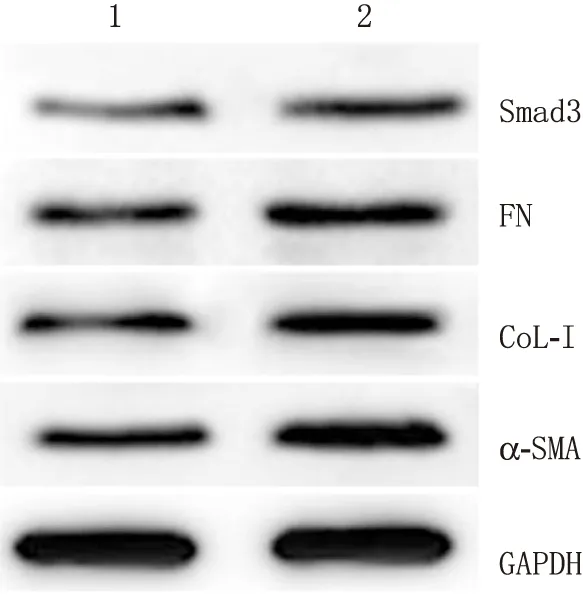
图4 Western blot检测Smad3转染与否对两转染组HTMCs中FN、CoL-I、α-SMA和Smad3蛋白表达的影响 1:miR-17-5p+vector转染组;2:miR-17-5p+Smad3转染组。
3 讨论
眼压升高被认为是POAG的主要致病因素,这主要取决于房水排出与流入之间的平衡。小梁网是位于眼前节的一个组织结构,在平衡房水流入排出过程中发挥重要作用[2-3]。研究表明,ECM蛋白的数量、结构和代谢平衡是保证房水自小梁网流入排出平衡的重要因素,ECM在小梁网部位的过分沉积会造成房水流出阻力增加[11]。正常生理条件下,HTMCs会分泌多种ECM蛋白,包括I~VI型胶原蛋白(Collagen I~VI),非胶原蛋白成分如FN、α-SMA等。研究发现,POAG患眼中小梁网的ECM蛋白如FN、CoL-I、CoL-IV、α-SMA等表达增加[12]。POAG患眼中,ECM在小梁网处的积聚沉淀能造成组织纤维化,这样的纤维化过程在POAG的病程进展中发挥重要作用[13]。
研究发现,多种miRNA在HTMCs的ECM调控中发挥作用:Shen等[14]报道,Ln-RP11-820通过miR-3178调控HTMCs的ECM产生;党晓洁等[15]证实氧化应激条件下miR-21可增加HTMCs胞外基质产物。miR-17-5p属于miR-17-92基因簇,有研究证实,在体外青光眼HTMCs模型中,miR-17-5p呈低表达,靶向PTEN调控HTMCs的增殖和凋亡[8]。同时有研究显示,miR-17-5p对细胞的纤维化或间质化有调控作用:Wang等[16]报道miR-17-5p在乳腺癌细胞中能靶向netrin4促进细胞的间质化,增加细胞的迁移和侵袭活性;Yu等[17]研究证实,miR-17-5p通过靶向WIF1而激活Wnt/β-Catenin信号通路,上调α-SMA、CoL-I蛋白表达,促进肝纤维化。基于以上理论,本研究探讨了miR-17-5p在HTMCs的ECM蛋白表达中能否发挥调控作用。实验结果显示,miR-17-5p在POAG小梁网组织中的表达低于正常小梁网组织,这一结果与Wang等[8]的结果一致,在转染了miR-17-5p mimics的HTMCs中,ECM相关蛋白如FN、CoL-I、α-SMA等的表达低于转染miR-17-5p NC的细胞,提示miR-17-5p能抑制HTMCs中ECM相关蛋白表达。
TGF-β/Smad信号通路在多种细胞的ECM产生及纤维化过程中发挥重要作用,在小梁网的ECM产生过程中也有重要作用。在POGA患者房水和小梁中发现TGF-β2异常高表达,使房水外流受阻,并促进ECM产生[18]。TGF-β在细胞内转导信号主要依赖Smad系统,Smad蛋白是TGF-β下游信号转导分子,根据功能不同分为受体调节型(R-Smad:Smad1、2、3、5、8)、共同型(Co-Smad:Smad3)和抑制型(I-Smad:Smad6、7),在整个通路中,配体与受体结合,诱导TGF-β受体激活,并使R-Smad磷酸化,继而与Co-Smad形成异构复合物,激活ECM蛋白,诱导细胞纤维化[19-20]。Smad3作为核心组分,其磷酸化水平直接反映了TGF-β通路的活性。Lu等[21]报道在肝癌细胞中miR-17能靶向抑制Smad3的表达。本研究结果发现,Smad3在POAG小梁网组织中的表达高于正常小梁网组织,miR-17-5p mimics组HTMCs中Smad3蛋白相对表达量低于miR-17-5 PNC组,这一结果与Lu等[21]结果一致。在HTMCs中,Smad3是miR-17-5p的下游靶基因,能负向调控Smad3的表达,抑制ECM蛋白表达。同时,当Smad3过表达可以减轻miR-17-5p对ECM蛋白的抑制作用。
综上所述,miR-17-5p 能抑制HTMCs的ECM蛋白表达,这一过程可能是通过靶向抑制Smad3表达而实现的。
