表面增强拉曼光谱对抗肿瘤药物5-氟尿嘧啶的检测研究
2021-01-29周国良黄光耀李盼王宏志杨良保
周国良,黄光耀,李盼,王宏志,3*,杨良保*
(1 中国科学院合肥物质科学研究院医学物理与技术中心,安徽合肥 230031;2 中国科学技术大学,安徽合肥 230026 3 中国科学院合肥肿瘤医院,安徽合肥 230031)
1 引言
肿瘤一直是威胁人类生命健康的重大疾病之一,全世界每年有1400多万新病例和800多万癌症患者死亡。随着医疗行业的不断发展,抗肿瘤药物方面的研究也有着巨大的进步。但是一般的抗肿瘤药物本身就带有毒性,不仅仅对肿瘤细胞产生效果也会对自身的其他良好细胞造成一定的伤害,因此出现很多不良症状。5-FU是一种临床应用于结肠癌、直肠癌、胃癌、乳腺癌、卵巢癌、绒毛膜上皮癌、恶性葡萄胎、头颈部鳞癌、皮肤癌、肝癌、膀胱癌等的治疗药物[1]。它通过抑制DNA来控制肿瘤细胞的增殖,但是其治疗剂量与中毒剂量[2]是相近的,因此建立一种快速有效的检测5-FU药物浓度的方法,确定5-FU安全有效的剂量,在临床用药方面具有重要意义。
目前,高效液相色谱(HPLC)[3],已被广泛应用于全血5-FU的测定。虽然HPLC在灵敏度、准确性以及精密度上有很大的优势,但是对5-FU样品的前处理过程复杂,回收率低,检测时间长,同时也不利样本的快速检测。其次应用较多的是液质联用技术(LC-MS/MS)[4]。虽然上述常用方法在检测5-FU中有很好
的应用,但是存在不同程度的操作复杂、费时费力、成本高和试剂保存时间短等诸多缺点,且操作人员需要较高的专业技术,有碍于该技术的推广。因此,建立一种快速有效的方法来检测5-FU,具有重要的意义。
表面增强拉曼光谱(Surface-enhanced Raman spectroscopy,SERS)[5]是指当分子吸附于某些粗糙的金属(Ag、Au、Cu 等)表面或金属纳米颗粒表面时,吸附分子的散射截面会被金属表面的局域电磁场剧烈放大,其拉曼散射强度会增加 104-108倍。SERS技术因快速灵敏、无损,具备分子指纹、专一性和单分子灵敏性的特点,能在分子水平上提供物质、结构的丰富信息,已逐渐成为化学、生物、环境、食品、药物等领域一种强有力的检测手段[6-11]。本文将利用种子生长法合成的均一分散的银纳米颗粒[12]作为SERS基底,结合便携式拉曼光谱仪器,开展 5-FU的检测研究。
2 实验部分
2.1 仪器设备
数显智能控温磁力搅拌器(型号SZCL-2,巩义市予华仪器责任有限公司),超声波清洗器(型号KQ5200E,昆山市超声仪器有限公司),低温高速离心机(型号Sigmal1-16K,德国Sigma公司),十万分之一电子天平(型号EX125DZH,奥豪斯仪器有限公司),场发射扫描电子显微镜(型号FEI Sirion-200,日本岛津公司),紫外-可见分光光度计(型号UV-2550,日本岛津公司),便携式拉曼光谱仪(型号Spk-2-0588,上海如海光电科技有限公司)。
2.2 实验材料与试剂
氟尿嘧啶注射液(旭东海普药业有限公司),柠檬酸钠(AR,上海国药试剂公司),结晶紫(AR,上海阿拉丁试剂有限公司),氢氧化钠(AR,上海国药试剂公司),双氧水(AR,上海国药试剂公司),盐酸(AR,上海国药试剂公司),硝酸(AR,上海国药试剂公司),硫酸(AR,上海国药试剂公司)。
2.3 银溶胶制备
通过种子生长法合成均一分散的Ag NPs。首先合成种子溶液:将1 mL柠檬酸钠溶液(1 wt %),0.25 mL AgNO3水溶液(1 wt%)和0.2 mL NaCl水溶液(20 mM)依次加入1.05 mL水中,在室温下搅拌预混合5分钟后,将上述预混合物快速加入47.5 mL沸水中。加热搅拌1 h后,将所得溶液冷却至室温,最终得到亮黄色的Ag NPs种子溶液。第二步:使用不同体积的种子溶液合成不同粒径的Ag NPs。将2 mL AgNO3水溶液(1 wt %)与800 μL NH3·H2O混合(25~28%)制备银氨溶液,用于Ag NPs的合成。将200 μL Ag NPs种子溶液添加到4.73 mL水中在室温下搅拌。随后,将70 μL银氨溶液和AA水溶液(2 mL,2.5 mM)加入上述种子溶液中用与纳米颗粒的生长。搅拌1小时后,获得粒径约85 nm的Ag NPs。将上述溶液离心浓缩后,再分散于柠檬酸钠水溶液(0.02 wt%)中保存备用。可以通过调节种子溶液的量合成不同粒径的Ag NPs。根据所得到的Ag NPs粒径大小与粒子数浓度的关系,通过改变Ag NPs种子的数量,可以精确地调控Ag NPs的粒径大小。此方法可以通过一锅种子介导生长法在水中合成大尺寸跨度(从40到300 nm)的准球形银纳米粒,不需要再使用额外的强稳定剂,并不是多步骤种子介导生长。利用Mie理论可以制备出不同尺寸和可预测消光谱的高质量准球形银纳米粒子,从而使我们能够将这些尺寸不同的均匀银纳米粒子扩展到不同的领域。研究结果还表明,形状和尺寸分布窄(例如小于10%)的Ag NPs能够在溶液中实现SERS信号的均匀性和再现性;在空间和时间尺度上,它们的RSD可以低至5%。因此,我们制备的形状和尺寸均匀的银纳米粒子的方法可以实现溶液中SERS的定量测定。
2.4 SERS基底的制备
在进行表征以及表面增强拉曼检测之前需要制备SERS基底,将合成的银纳米颗粒进行离心、浓缩处理。
2.5 银纳米颗粒粒径的选择和基底稳定性研究
由于CV分子拉曼散射截面大,信号稳定,能够稳定吸附在基底表面,因此选择CV[13]作为探针评估SERS基底的增强效果以及稳定性。实验中选择CV(10-6M)对三种不同粒径的Ag NPs的增强效果进行对比,选择增强效果最好的作为基底检测5-FU。其次,滴加10 μL 10-6M的CV至筛选的基底表面,在室温下自然干燥后,评估基底的稳定性。

图1 5-FU拉曼光谱图和SERS图Fig.1 Raman and SERS spectra of 5-FU
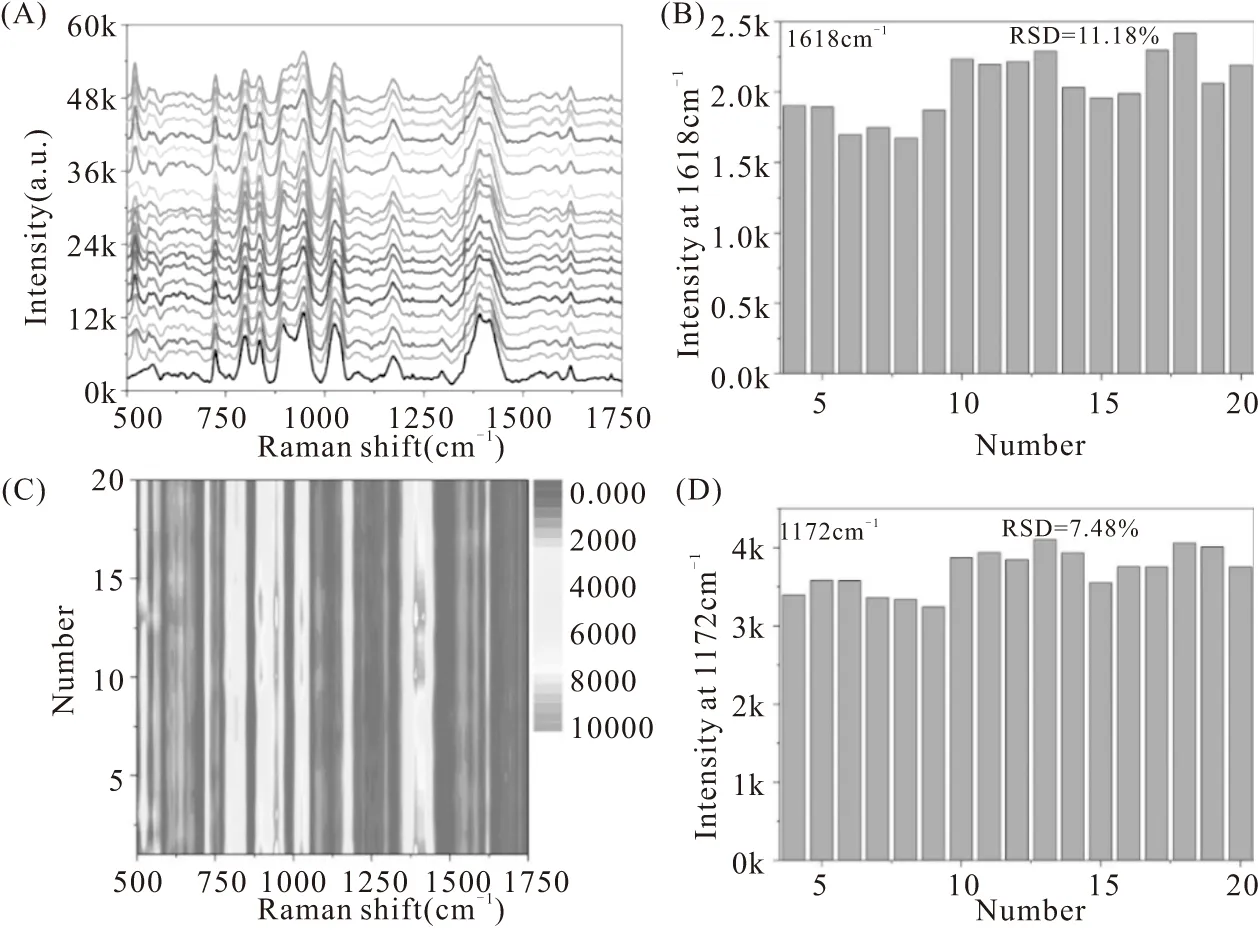
图2 银基底灵敏度和稳定性研究图谱Fig.2 Characterization of sensitivity and stability of SERS substrates
2.6 抗肿瘤药物5-FU的SERS检测
(1)5-FU的标准品的拉曼光谱:将5-FU注射液加入比色皿中,采集其拉曼光谱。结果如图4。
(2)银基底的背景信号采集:移取2 μL浓缩银基底放到硅片上,用便携式拉曼仪采集银基底的信号,评估基底对检测信号的干扰。
(3)检测不同浓度的5-FU:将配制的不同浓度5-FU与银基底混合,然后用便携式拉曼仪进行检测,激发波长为785 nm,激发功率为100 mw,积分时间为2 s。得到不同浓度5-FU的SERS光谱,并指认5-FU的特征光谱谱带。检测结果如图5。
2.7 血清中5-FU的检测[14]
将不同浓度的5-FU加入血清中,摇匀混合,加入乙醇与血清混合(体积比3∶1),沉淀去蛋白质等干扰物。离心后取上清液与基底混合检测,结果如图7。
3 结果与讨论
3.1 Ag NPs扫描电镜表征和紫外-可见吸收光谱表征
对本实验所制备的Ag NPs进行扫描电镜测试。将离心再分散后的Ag NPs滴在干净的硅片上,待其自然变干后,进行数据采集。图3A、B、C是不同粒径Ag NPs的电镜扫描图。根据扫描电镜对其形貌表征结果可知:通过调节种子的量,可以获得粒径约60~80 nm之间的纳米颗粒,且颗粒排列有序,无明显的团聚现象。
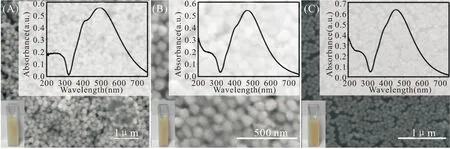
图3 不同粒径Ag NPs的光学照片、扫描电镜图以及紫外-可见吸收光谱图。Fig.3 Optical photographs,Scanning electron microscopy (SEM) and ultraviolet-visible absorption spectra of Ag NPs with different diameter
对制备的银纳米颗粒进行紫外表征。取一定量的Ag NPs加入到比色皿中,用紫外可见分光光度计采集400 nm~800 nm之间Ag NPs的吸收峰。纳米粒子的大小、形貌不同,会导致其产生吸收峰的位置有所不同,因此可以通过紫外可见吸收光谱反映其形貌颗粒大小等特点。通过上图可以观察到本实验制备的银纳米颗粒在488、468、460 nm 处有吸收峰。根据文献报道,粒径分布在60~80 nm之间,与SEM结果一致。
3.2 银基底的筛选
图4A-C分别是700 μL、1000 μL和1200 μL种子溶液合成的Ag NPs对10-6M CV的检测结果。如图所示,不同粒径的Ag NPs均可以实现CV分子的可靠检测。实验中以1602 cm-1的强度进行统计。如图D所示,通过三种不同粒径的Ag NPs对CV检测的特征峰强度对比。700 μL种子溶液合成的Ag NPs(粒径80左右)对CV的增强效果最好。因此,选用银纳米粒子作为SERS基底对 5-FU进行检测。
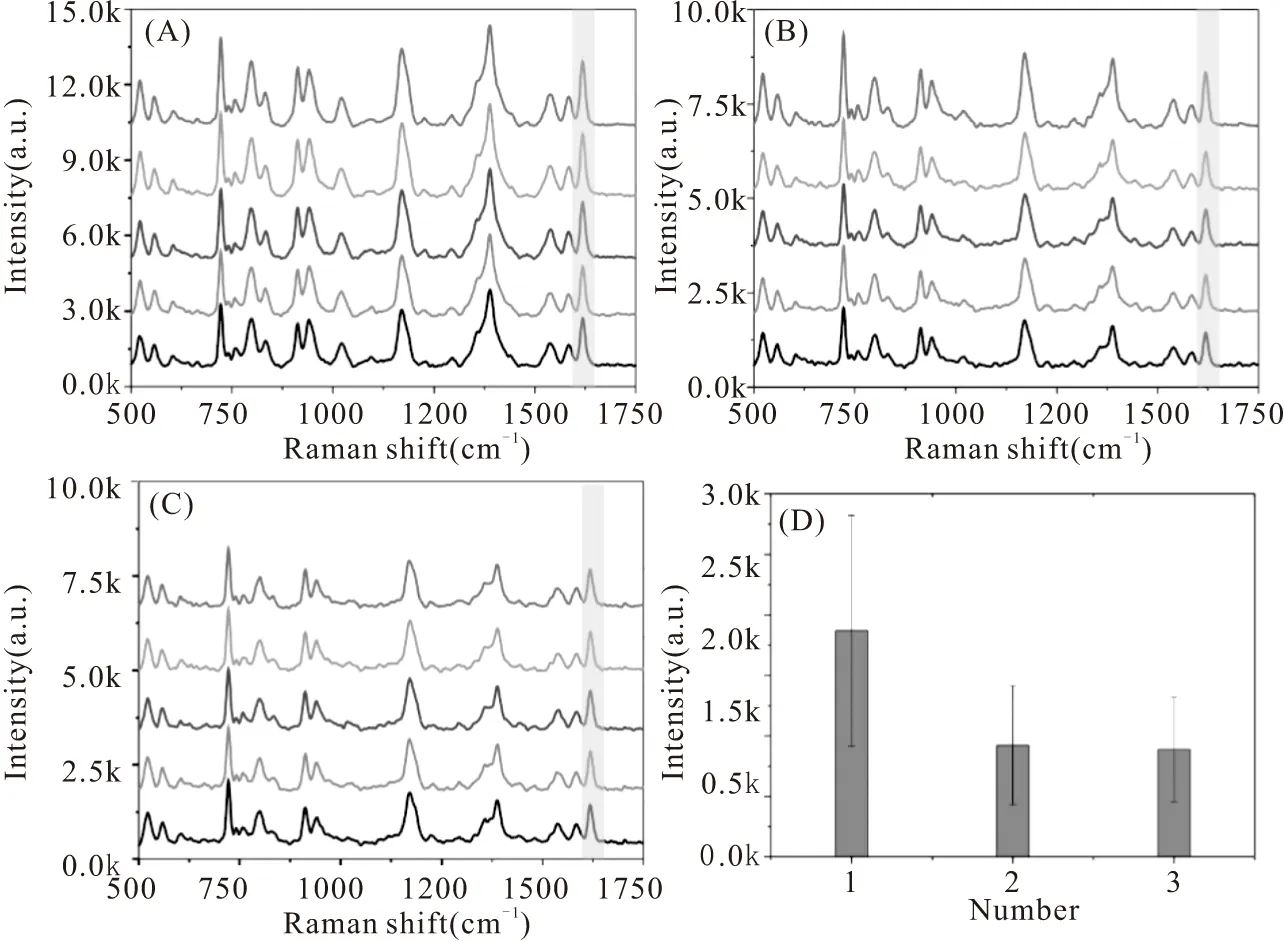
图4 不同粒径银纳米粒子的增强效果对比图Fig.4 Comparison of Enhancement Effect of Silver Nanoparticles with Different Diameter
3.3 银基底的重复性表征
基底的重复性是SERS基底可靠性的重要参数之一。为了考察银基底的重复性,实验中选择10-6MCV作为探针分子评估基底重复性。只有基底具有较好的重复性,才能保证SERS信号的稳定性。CV是一种三苯甲烷类分子,拉曼活性高,在可见区域有明显的电子吸收光谱。如图3A所示,在基底表面随机采集30条光谱,SERS光谱表现出较好的重现性和稳定性。1585 cm-1和1616 cm-1归属于苯环伸缩振动分裂;1370 cm-1归属于C-H面内弯曲振动和N-C-环-C-C对称伸缩振动叠加而成;1173 cm-1归属于苯环上C-H面内弯曲振动模式;915 cm-1归属于C-H面外弯曲振动模式;803 cm-1归属于C-N-C对称伸缩振动模式。实验中以特征峰1616 cm-1强度进行统计,量化基底的均一性。如图3B和3D所示,基底的相对标准偏差在10%左右,因此基底的均一性较好,为后期SERS信号的稳定性和重复性提供了保障。基于上述SERS谱图,可以初步说明Ag NPs基底对待测物能够进行信号放大。
3.4 5-FU标准品的拉曼光谱图和SERS图
图A为5-FU标准品的拉曼光谱图,770 cm-1拉曼光谱为嘧啶环振动,拉曼仪的设置条件为:波长为785 nm、功率为100 mw、积分时间2 s。
图B为5-FU(25 mg/L)的SERS光谱。通过文献调研,5-FU的特征峰归属如下:1234 cm-1的谱带归属于C-F 伸缩振动;1340 cm-1归属于C-H 伸缩振动;1400 cm-1归属于N-H 伸缩振动;1672 cm-1归属于C=O 伸缩振动。
图A的拉曼光谱图与图B的SERS光谱图差异较大,可能是因为分子与金属表面之间强烈的化学作用,可能导致分子的对称性甚至电子结构的改变。这种效应导致相对强度的变化和频移。这种差异还由金属表面电磁场决定的表面选择规则。
3.5 不同浓度5-FU的SERS检测图谱
图5为不同浓度的5-FU以及基底的SERS光谱,图A中5-1分别是25 μg/mL、12.5 μg/mL、2.5 μg/mL、0.25 μg/mL 5-FU的SERS特征峰以及银基底的空白背景峰。根据图A可以得知,5-FU的特征峰不受基底信号影响。图B为四种不同浓度5-FU在1234cm-1特征峰处的强度对比图。
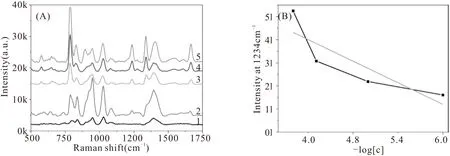
图5 不同浓度的5-FU SERS检测谱图Fig.5 SERS Spectra of 5-FU with Different Concentrations
由图B的特征峰强度对比可得:5-FU浓度越高,特征峰越强,目前5-Fu的检测限为0.25 μg/mL。
3.6 血清中的5-FU的SERS检测
将5-FU按照标准加入法加入到血清中,配制不同浓度5-FU的血清溶液。根据优化的前处理技术,取40 μL 血清与120 μL乙醇混合,由于乙醇与水的亲和力大,破坏了蛋白质表面的水滑坡,从而导致蛋白质的溶解度降低,引起蛋白质沉淀。1为银基底的光谱,2为血清的光谱,3~5分别为血清去除蛋白质后,31.25 μg/mL、15.625 μg/mL和3.125 μg/mL 5-FU的特征光谱。如图所示,纯化蛋白之后,血清的特征峰对5-FU的检测不产生干扰。血清中5-FU的检测限为3.125 μg/mL。
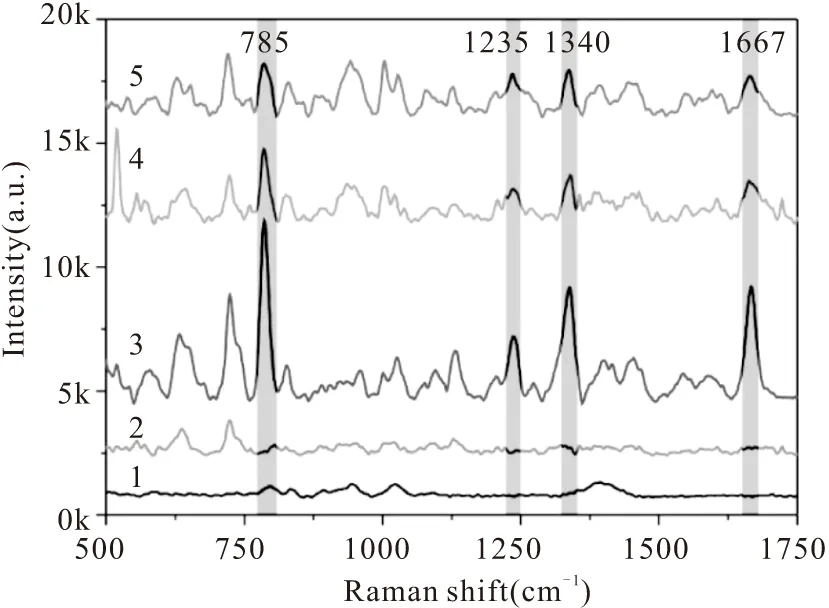
图6 血清中不同浓度5-FU SERS检测谱图Fig.6 SERS Spectra of 5-FU with different concentrations spiked in serum
4 结论
本研究建立了SERS快速检测血清中5-FU的方法,利用种子生长法制备粒径约为80 nm Ag NPs,通过CV分子评估银基底的增强能力。基底的RSD小于10%,结果表明种子生长法合成的Ag NPs,粒径均一且增强效果以及稳定性较好。对不同浓度5-FU标品进行SERS检测,检测限为0.25 μg/mL。针对血清中5-FU检测,利用乙醇沉淀去除蛋白,降低检测干扰,实现了血清中3.125 μg/mL 5-FU的灵敏检测。本方法操作简单,十分钟内能完成检测,有望应用于其他抗肿瘤药物的分析测定,为临床给药提供新的技术支撑。
