刚性二咪唑配体组装金属有机大环与金属有机凝胶的结构与性质
2021-01-29卫杨帆李嘉欣罗文琦金传明
陈 雨 卫杨帆 李嘉欣 罗文琦 金传明
(湖北师范大学,稀有金属化学湖北省协同创新中心,污染物分析与资源化技术湖北省重点实验室,先进材料研究院,黄石 435002)
0 引 言
超分子凝胶是通过超分子自组装过程而形成的一种有序纳米结构,并且其通过一种自下而上的方法形成了有规则结构的多种形态和形貌。它不是一种固体状态也不是液体状态而是一种胶状,是凝胶因子与溶剂分子通过非共价键分子间作用力,如氢键、范德华力、π-π作用、静电作用和疏水作用等,自组装成棒状、带状、纤维状等有序结构,从而阻止溶剂分子的自由流动而形成的[1-5]。金属-有机凝胶(meta1-organic ge1s,MOGs)是在超分子有机凝胶的基础上引入了金属离子,利用金属离子与有机配体的配位作用诱导形成凝胶,或者以金属配合物为凝胶因子,通过非共价键作用固定溶剂分子而形成凝胶[6-8]。金属有机凝胶具有金属配位可控、有机配体的可调节性等特点,与金属有机骨架化合物(meta1-organic frameworks,MOFs)相比,金属有机凝胶的结晶度较差,结构不明确,但是由于具有大量的路易斯位点和多孔性的结构,使得其在催化、气体吸附、传感、光电性质、磁性、药物化学等领域具有潜在的应用价值[9-13]。目前文献中报道的金属有机凝胶分子中所用到的有机配体一般是具有长链的柔性结构,柔性结构的存在不利于高结晶度的金属有机框架固体材料的形成,而倾向形成结晶度差的金属有机凝胶[14-17],鲜有刚性结构且无长链配体组装金属有机凝胶的文献报道[18-20]。本文中我们将介绍一种刚性结构且无长链的配体分子2-(4-(1-咪唑基)-苯基)咪唑(IPI)与金属银盐、锌盐等不同金属盐在不同的溶剂中分别组装金属有机大环分子和金属有机凝胶的结构与性质,为了对比研究,我们也利用与配体IPI具有相似刚性结构的配体2-(4-吡啶基)-咪唑(4-PIM)与AgC1O4反应得到了具有M4L4型金属有机大环结构。配体4-PIM和IPI的分子结构如下(Scheme 1)。
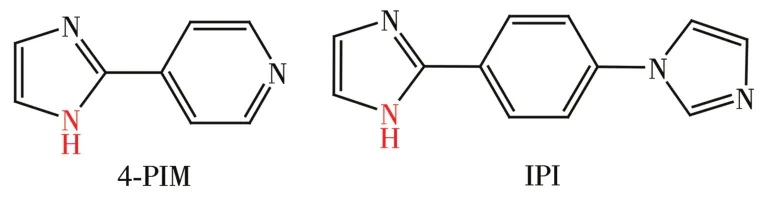
Scheme 1 Structure of 1igand 4-PIM and IPI
1 实验部分
1.1 试剂与仪器
所有试剂均为分析纯试剂,未经进一步纯化处理。配体4-PIM和IPI的合成按文献方法进行[21]。元素分析使用Perkin-E1emer 2400型元素分析仪;红外光谱(IR)使用Nico1et IR-700型红外光谱仪,波长4 000~400 cm-1,KBr压片;热重分析(TGA)在 TA50热重分析仪上,氮气气氛中进行测定;单晶测定是采用Bruker SMART APEX仪(MoKα射线,λ=0.071 073 nm);PerkinE1mer公司LS45荧光分光光度计;电镜(SEM)照片使用日立S-3400N扫描电子显微镜(工作电压为15.0 kV)获得。
1.2 配合物的合成
1.2.1 配合物[Ag(4-PIM)]C1O4(1)的合成
取一支50 mL的试管,将AgC1O4(52 mg,0.25 mmo1)溶解在5 mL水中作为下层,中间层为5 mL乙醇和5 mL水的混合溶液,把4-PIM配体(74 mg,0.5 mmo1)溶解在5 mL乙醇中作为溶液上层。上、中、下层界面明显,然后用封口胶密封静置。7 d之后,在接近液面中间的位置有浅黄色透明晶体析出,即为配合物1。产率为55%(以AgC1O4计)。元素分析按C32H28Ag4C14N12O16计算值(%):C,27.26;H,2.00;N,11.92。测定值(%):C,27.64;H,2.18;N,11.73。IR(KBr,cm-1):3 433m,2 358w,1 613s,1 563w,1 505w,1 449m,1 301w,1 228w,831w,777w,617m,527w,469w。
1.2.2 配合物[Zn(IPI)]C12·H2O(2)的合成
取一支50 mL的试管,把IPI配体(21.1 mg,0.1 mmo1)溶解在5 mL乙醇中作为溶液上层,中间层为5 mL乙醇和5 mL H2O的混合溶液,将ZnC12(27.2 mg,0.2 mmo1)溶解在5 mL H2O中作为下层。上、中、下层界面明显,然后用封口胶密封静置。一段时间之后,在接近液面中间的位置有黄色透明晶体析出,即为配合物2。产率为48%(以IPI配体计)。元素分析按 C12H12C12N4OZn计算值(%):C,39.54;H,3.32;N,15.37。测定值(%):C,39.74;H,3.68;N,14.93。IR(KBr,cm-1):3 509s,3 434s,3 124s,2 782w,2 358 w,1 618m,1 524s,1 460m,1 305m,1 259m,1 115s,1 064m,961w,840s,768m,653w,549w,488w。
1.3 晶体结构测定
晶体结构测定在273(2)K温度下,采用Bruker SMART APEX型X射线衍射仪,石墨单色器单色化MoKα射线(λ=0.071 073 nm)作辐射源,以ω-2θ扫描方式收集衍射点。晶体结构均采用直接法解析,最小二乘法F2精修,使用SHELXS-97和SHELXL-97程序包[22-23]。非氢原子坐标用直接法解出,并对它们的坐标及其各向异性热参数进行全矩阵最小二乘法修正。氢原子的位置通过理论加氢得到,并使用固定的各向异性热参数加入结构精修。配合物1和2的晶体学数据列于表1。
CCDC:2017307,1;2017308,2。

表1 配合物1和2的晶体学数据Table 1 Crystallographic data of complexes 1 and 2
1.4 金属有机凝胶的制备
选取以下溶剂进行实验:甲醇、乙醇、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、乙二醇、四氢呋喃、乙二胺、乙腈。用移液枪取0.5 mL不同溶剂于2 mL进样瓶中,称取(21 mg,0.1 mmo1)IPI配体充分溶解于上述溶剂中,此时溶液呈黄色,用注射器注入0.25 mL水溶解的金属盐(0.2 mmo1)溶液于上述进样瓶中,2种溶液混合即开始凝固。慢慢注入,当注入完成后,溶液完全凝固,形成黄色的凝胶状金属有机凝胶,倒立进样瓶无液体下流,实验操作示意图如下(Scheme 2)。
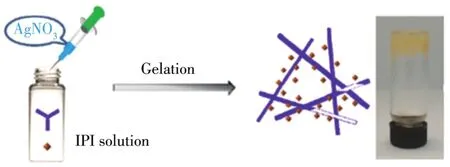
Scheme 2 Preparation of the meta1-organic ge1s
2 结果与讨论
2.1 配合物1的晶体结构与性质
单晶衍射分析表明,配合物1属于三斜晶系,P1空间群。如图1a所示,配合物1具有独立的Ag4L4分子环结构,环外4个高氯酸根离子电荷平衡。每个Ag4L4分子环单元结构中包含4个Ag(Ⅰ)离子与4个4-PIM配体,其中2个Ag(Ⅰ)离子分别与2个配体中咪唑环的N原子以直线型二配位方式配位,其键长Ag2—N2 0.207 1(7)nm,Ag2—N5 0.206 8(8)nm,键角N5—Ag2—N2 171.2(11)°。另外2个Ag(Ⅰ)离子分别与2个配体中吡啶环的4号位N原子以直线型二配位方式配位,其键长Ag1—N1 0.214 7(8)nm,Ag1—N4 0.214 9(7)nm,键角N1—Ag1—N4 173.7(4)°,同时Ag1离子也与高氯酸根中的一个氧原子进行配位,其键长 Ag1—O11 0.271 7(10)nm,键角 O11—Ag1—N1 87.7(5)°和 O11—Ag1—N4 92.7(4)°。由于配体4-PIM分子中,吡啶环的4号位N原子的配位方向与咪唑环3号位N原子的配位方向接近90°,使得4个金属Ag(Ⅰ)中心与4个4-PIM配体自组装形成一个Ag4L4型金属有机大环超分子结构,与文献中报道的Ag4L4型结构相似[24]。这种Ag4L4型金属有机大环结构的独特之处在于大环结构中4个咪唑环的1号位的N原子分别连接4个不同的氢原子(N3—H3,N6—H6),在金属有机大环的堆积过程中容易形成氢键。另一个结构特点是金属有机大环结构中所有的吡啶环与咪唑环几乎完全共平面,且不同金属有机大环堆积过程中咪唑环与吡啶环之间的作用距离为0.354 5 nm,存在较强的芳环π-π作用(图 1b)。

图1 配合物1的50%椭球率晶体结构:(a)Ag4L4金属有机大环;(b)不同分子大环间π-π作用Fig.1 Crysta1 structure of comp1ex 1 with 50% therma1 e11ipsoids probabi1ity:(a)Ag4L4-type meta1-organic macrocyc1e;(b)π-π interaction between independent mo1ecu1ar macrocyc1es in comp1ex 1
热重分析(TGA)结果表明,配合物1有两步失重过程。第一步发生在260~310℃之间,失去重量39.6%,对应于配体4-PIM的失去(理论值:41.0%);第二步发生在470~640℃之间,失去重量23.7%,反应出配合物1完全分解为氧化物(理论值:26.0%)。配合物1分子在激发波长为311 nm时,其荧光发射峰在410 nm处。而配体4-PIM的激发波长为372 nm,发射峰在454 nm处。与配体4-PIM荧光光谱相比,配合物1的发射光谱蓝移了44 nm,表明配合物1分子中可能存在配体到金属的电子转移跃迁(LMCT)或者金属到配体的电子转移跃迁(MLCT)。
2.2 配合物2的晶体结构与性质
单晶衍射结果表明,配合物2属于单斜晶系,P21/c空间群。如图2a所示,配合物2具有独立的Zn2L2C14金属有机大环分子结构,大环分子外有2个结晶水分子形成二聚体。每个Zn2L2C14金属有机大环单元结构中包含2个Zn(Ⅱ)离子与2个IPI配体和4个氯离子,其中2个Zn(Ⅱ)离子分别与配体中一个咪唑环的3号位N原子、另一个配体中咪唑环的3号位N原子和2个独立的氯离子以四面体方式顺式配位,其键长 Zn1—N3 0.201 0(2)nm,Zn1—N1 0.202 2(2)nm,Zn1—C12 0.221 85(9)nm,Zn1—C11 0.225 75(9)nm,键角N3—Zn1—N1 106.47(10)°,N3—Zn1—C12 109.64(8)°,N1—Zn1—C12 115.32(7)°,N3—Zn1—C11 109.27(7)°。由于配体IPI分子中,2个咪唑环分别用2号位碳原子或者1号位氮原子与苯环对位相连,使得2个不同咪唑环的3号位N原子的配位方向接近90°,使得2个金属Zn(Ⅱ)中心与2个IPI配体配位自组装形成了一个Zn2L2金属有机大环超分子结构。在金属有机大环分子结构中每个IPI配体的一个咪唑环与苯环几乎共平面,其二面角为20.84°,而另一个咪唑环与苯环不共平面,其二面角为49.71°,同时每个金属有机大环分子内的2个相对互相平行的共轭咪唑吡啶平面存在较强的芳环之间π-π作用,其环平面中心之间的距离为0.357 4 nm。这种Zn2L2金属有机大环超分子结构的特别之处在于,金属有机大环结构中2个咪唑环的1号位的N原子分别连接2个不同的H原子(N4—H4A),分别与分子中结晶水分子形成氢键(N4—H4A…O3:N4—H4A 0.086 nm,H4A…O3 0.198 nm,N4—H4A…O3 176°)。金属有机大环分子间的二聚体水分子分别与成键的氯离子以氢键相连(O3—H3B…C12:O3—H3B 0.083 nm,H3B…C12 0.246 nm,O3—H3B…C12 152°;O3—H3A…C11:O3—H3A 0.084 nm,H3A…C11 0.230 nm,O3—H3A…C11 165°),形成三维的金属有机大环超分子网络结构(图2b)。
热重分析(TGA)结果表明,配合物2具有稳定的金属有机大环结构,在65~110℃之间,有一个较小的失去重量过程,失去重量为5.3%,对应于分子中一个水分子的失去(理论值:4.9%);热分解温度在380~520℃之间,对应相应阴离子的失去,其失去重量为21.4%(理论值:19.5%);在560~800 ℃之间,配合物2完全分解为其氧化物,对应失去重量49.3%(理论值:53.2%)。配合物2的荧光发射峰在511 nm处(激发波长为450 nm),而配体的荧光发射峰在499 nm处(激发波长为455 nm),与配体IPI荧光发射相比,配合物2的荧光发射红移了12 nm。表明配合物2分子中可能存在配体到金属的电子转移跃迁(LMCT)或者金属到配体的电子转移跃迁(MLCT)。
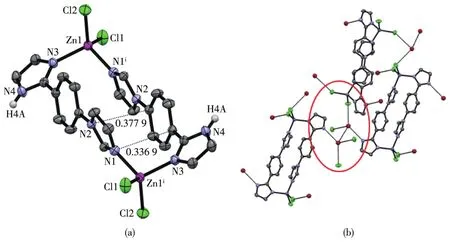
图2 配合物2的35%椭球率晶体结构:(a)Zn2L2C14金属有机大环;(b)不同金属有机大环间的氢键Fig.2 Crysta1 structure of comp1ex 2 with 35% therma1 e11ipsoids probabi1ity:(a)Zn2L2C14-type meta1-organic macrocyc1e;(b)Hydrogen-bonding between independent meta1-organic macrocyc1e in comp1ex 2
2.3 基于刚性配体IPI的金属有机凝胶的制备与性质
2.3.1 配体IPI与银盐组装金属有机凝胶与SEM表征
图3a所示为不同溶剂中IPI与Ag盐形成的超分子凝胶,图中从左到右的溶剂依次分别是:甲醇(Ge1,凝胶)、乙醇(Ge1)、DMSO(Ge1)、DMF(Ge1)、乙二醇(Ge1)、四氢呋喃(Ge1)、乙二胺(P,沉淀)、乙腈(Ge1)。可以看出硝酸银与IPI配体除在乙二胺碱性溶剂中形成沉淀外,在其他大多数有机溶剂中均可以形成金属有机凝胶。金属有机凝胶形成的可能原因是银离子与配体IPI配位时能形成金属有机大环结构,金属有机大环分子之间或者与溶剂分子之间通过分子间作用力、分子间芳环π-π堆积作用、疏水作用以及氢键等非共价作用自组装形成三维网络结构,进而阻止溶剂分子的自由流动,形成凝胶体系。极性质子溶剂更易形成氢键,同时存在较强的分子间作用力,因此形成超分子凝胶。而乙二胺碱性溶剂能够与IPI配体中咪唑氮上的酸性氢发生酸碱反应,破坏了能形成氢键的N—H键,不利于形成金属有机凝胶。当改变银盐的阴离子,用乙醇做溶剂,与配体IPI作用,可以发现也形成了超分子金属有机凝胶。如图3b中,从左到右依次加入的金属盐分别 是 :AgNO3(Ge1)、AgC1O4(Ge1)、AgBF4(Ge1)、AgPF6(Ge1)、Ag(OSO2CF3)(Ge1)。由于不同银盐与 IPI配体形成的金属有机凝胶外貌相似,因此选择AgNO3和AgC1O4形成的凝胶让其自然干燥后测试扫描电镜,其SEM如图4所示。可以看出2种金属有机凝胶在微观上均是由蓬松棉花状结构相互交织形成的三维多孔结构,表面结构凹凸不平呈现条状纹理,孔隙大小分布较均匀且连通性好,凝胶因子形成的三维网络结构将溶剂分子包结在孔隙结构中,形成金属有机凝胶。

图3 (a)不同溶剂中IPI与AgNO3形成的金属有机凝胶;(b)乙醇做溶剂时不同银盐与IPI形成的金属有机凝胶Fig.3 (a)Meta1-organic ge1s of IPI and AgNO3in different so1vents;(b)Meta1-organic ge1s of IPI and different si1ver sa1ts in ethano1

图4 IPI与AgNO3(a)和AgC1O4(b)形成凝胶的SEM图Fig.4 SEM images of ge1s of IPI and AgNO3(a)and AgC1O4(b)
2.3.2 配体IPI与锌盐组装金属有机凝胶与SEM表征
用相同的实验方法制备了配体IPI与锌盐的金属有机凝胶,图5a中从左到右依次用到的溶剂分别是:甲醇(Ge1)、乙醇(Ge1)、DMSO(Ge1)、DMF(L,液体)、乙二醇(半透明黄色 Ge1)、四氢呋喃(Ge1)、乙二胺(L)、乙腈(Ge1)。从图中可以看出,硝酸锌与IPI配体在大多数极性质子溶剂中均可以形成超分子凝胶。金属有机凝胶形成的可能原因是锌离子与配体IPI以四配位方式配位形成了金属有机大环结构,且金属有机大环分子与溶剂分子之间通过分子之间相互作用、分子间π-π堆积作用、静电作用、疏水作用以及氢键等非共价作用自组装形成了三维网络结构,进而阻止溶剂分子的自由流动而形成金属有机凝胶。然而在DMF和乙二胺溶剂中没有形成金属有机凝胶也没有形成沉淀,是一种浅黄色溶液。在DMF溶剂中,没有形成金属有机凝胶的可能原因是锌离子与配体作用形成了能溶解在DMF溶剂中的配合物分子;而在乙二胺溶剂中,由于金属锌离子与乙二胺分子很容易形成螯合配合物分子,没有形成不溶解的超分子配位聚合物,因此不能形成金属有机超分子凝胶。
当改变锌盐的阴离子时,选择乙醇做溶剂,研究其与配体IPI作用时能否形成金属有机凝胶,其结果如图5b所示。从左到右的金属盐依次为Zn(NO3)2(Ge1)、 ZnSO4(P)、 ZnC12(P)、 Zn(BF4)2(Ge1)、Zn(C1O4)2(Ge1)、Zn(SO3CF3)2(P)。 可 以 发 现 ZnSO4、ZnC12和Zn(SO3CF3)2分别形成了沉淀,没有形成金属有机凝胶,生成沉淀的原因可能是金属盐与配体分子或者溶剂分子作用自组装过程中阴离子的配位作用不同而引起的。为了深入研究配体IPI与不同金属盐之间是否可以形成金属有机超分子凝胶,我们选择乙醇做溶剂,分别试验Zn(NO3)2、AgNO3、Co(NO3)2、Ni(NO3)2、Cd(NO3)2、Cu(NO3)2与配体 IPI反应,其结果如图6所示。可以看出配体IPI与Zn(NO3)2和AgNO3可以形成黄色的金属有机超分子凝胶,与Co(NO3)2也能形成红色的金属有机凝胶,但是 Ni(NO3)2、Cd(NO3)2、Cu(NO3)2与配体 IPI反应不能形成金属有机超分子凝胶,也不能形成沉淀。这说明不同金属离子的配位方式、配位构型及溶剂分子之间的相互作用等均可能对形成金属有机超分子凝胶产生重要的影响。

图5 (a)不同溶剂中IPI与Zn(NO3)2形成的金属有机凝胶;(b)不同锌盐与IPI形成的金属有机凝胶Fig.5 (a)Meta1-organic ge1s of IPI and Zn(NO3)2in different so1vents;(b)Meta1-organic ge1s of IPI and different zinc sa1ts in ethano1
选择Zn(NO3)2和Zn(C1O4)2与配体IPI形成的金属有机凝胶,让其自然干燥后测试扫描电镜,其SEM图如图7所示。可以看出2种金属有机凝胶在微观上均是疏松似面包状结构,表面结构凹凸不平呈现孔洞结构,孔隙大小分布较均匀,内部孔洞相互交织形成三维多孔结构,凝胶因子形成的三维网络结构将溶剂分子包结在孔隙结构中,形成金属有机凝胶。

图6 配体IPI与不同金属硝酸盐在乙醇中形成的金属有机凝胶Fig.6 Ge1s of IPI and different meta1 nitriates in ethano1

图7 IPI与Zn(NO3)2(a)和Zn(C1O4)2(b)形成金属有机凝胶的SEM图Fig.7 SEM images of ge1s formed by IPI with Zn(NO3)2(a)and Zn(C1O4)2(b)
2.4 金属有机超分子凝胶形成机理探讨
由配合物1和2的晶体结构分析可以发现,配体IPI和4-PIM均为刚性结构,配体分子中咪唑环N原子和吡啶环N原子的配位方式形成的夹角几乎接近90°,使得配体4-PIM与直线型方式配位的银离子作用自组装形成刚性结构的M4L4金属有机大环结构,配体IPI与四面体方式配位的锌离子以顺式配位构型自组装构建了刚性的M2L2金属有机大环超分子结构。刚性的M4L4和M2L2金属有机大环超分子结构中具有方形的纳米空腔,就像一个“分子箱”,能够“装”进溶剂分子并“锁”住溶剂分子不让其自由流动,从而形成金属有机超分子凝胶。配合物1和2的晶体结构分析也表明金属有机大环分子结构中不同的大环之间存在较强的分子间作用力、芳环间π-π作用和氢键作用,从而使得配合物分子在有机溶剂中能自发组装形成三维网络结构。特别是配体IPI分子中咪唑环的1号位N原子连接的H原子能分别与水分子或者有机溶剂分子形成氢键,助力金属有机大环结构包结溶剂分子形成金属有机超分子凝胶,这样的氢键作用可能是刚性配体IPI与AgNO3等银盐和Zn(NO3)2等锌盐在不同溶剂中形成金属有机凝胶的关键因素,相似的由能形成氢键的酰胺键构建刚性配体组装金属有机超分子凝胶在文献中也有相关报道[25]。
3 结 论
利用含有咪唑环的刚性配体4-PIM和IPI分别与 AgC1O4和 ZnC12作用,得到了具有 M4L4和 M2L2金属有机大环结构的配合物1和2。金属有机大环分子结构中存在较强的分子间作用力、芳环间π-π作用和氢键作用,特别是配体IPI分子中咪唑环的1号位N原子连接H原子,能分别与水分子或者溶剂分子形成氢键,使得配体IPI与AgNO3等银盐和Zn(NO3)2等锌盐在不同溶剂中能分别形成蓬松棉花状结构和疏松似面包状结构的金属有机超分子凝胶。
