柚苷酶高产菌株选育及其产酶在蜜橘果汁脱苦中的应用
2021-01-29夏辛珂张媛娥雷生姣胡彪陈钰亭付彩霞
夏辛珂,张媛娥,雷生姣*,胡彪,陈钰亭,付彩霞,2
1(三峡大学 生物与制药学院,湖北 宜昌,443002)2(湖北土老憨生态农业科技股份有限公司,湖北 宜昌,443000)
柚皮苷(4,5,7-trihydroxy-flavanone7-rhamnoglucoside)是一种天然存在于柑橘中的类黄酮物质[1],柑橘加工过程中因柚皮苷产生苦味是制约柑橘加工业发展的主要问题之一[2]。相比膜技术、吸附法、超临界CO2脱苦等方法[3-4],酶法脱苦不仅效果好、无污染、工艺简单、反应条件温和,而且能增强果汁风味、保存果汁营养成分[5]。
柚苷酶(EC 3.2.1.40)具有2种糖苷酶(α-L-鼠李糖苷酶和β-D-葡萄糖苷酶)活性[6],它先在α-L-鼠李糖苷酶的作用下将柚皮苷水解为普鲁宁(柚皮苷苦味的三分之一)和鼠李糖,普鲁宁在β-D-葡萄糖苷酶的作用下水解为柚皮素(无苦味)和葡萄糖,从而实现脱苦[7]。除此之外,柚苷酶还具有提高果汁质量,增强芦笋汁抗氧化活性,水解糖苷、皂苷,增强葡萄酒香气,转化类固醇、抗生素等功能[8-11]。
柚苷酶广泛存在于自然界中[12],但微生物来源的酶远比动植物来源的更有利[13],丝状真菌是柚苷酶的主要生产菌株[14]。然而,由于缺乏安全性、稳定性好、产酶活力高的产酶菌株,柚苷酶在我国工业生产中至今没有得到广泛应用。因此选育适合工业化生产的柚苷酶高产优良菌株至关重要。
本研究从腐烂的柚子皮中筛选得到1株产柚苷酶的塔宾曲霉(Aspergillustubingensis),采用紫外(ultraviolet irradiation,UV)与常压室温等离子体(atmospheric room temperature plasma,ARTP)复合诱变技术,旨在获得1株柚苷酶高产突变株,并探究其酶解条件。同时,将突变株发酵粗酶液脱苦宜昌蜜橘果汁,并对脱苦前后果汁的理化性质进行鉴定,探究该突变株产酶在果汁脱苦中的应用效果,为柑橘工业化生产和应用提供基础。
1 材料与方法
1.1 菌株
产柚苷酶菌株,从霉变的柚子皮上分离纯化获得。
1.2 试剂与培养基
本研究使用的所有化学试剂,均购自中国国药集团化学试剂有限公司。
产柚苷酶菌株筛选培养基(g/L):柚皮粉 10.0,MgSO4·7H2O 5.0,K2HPO45.0,KCl 5.0,FeSO4·5H2O 0.1,琼脂粉 10.0,pH值自然;
固体培养基(g/L):MgSO4·7H2O 1.0,KH2PO41.0,(NH4)2SO41.5,KCl 0.5,KNO31.5,CaCl20.1,酵母提取物 2.0,柚皮苷 2.5,琼脂粉 10.0,pH值自然;
发酵培养基(g/L):MgSO4·7H2O 0.5,KH2PO41.5,K2HPO41.5,(NH4)2SO44.0,ZnSO4·7H2O 0.1,CaCl20.1,酵母提取物1.0,豆粉2.0,蛋白胨2.0,柚皮苷10.0,pH值自然,接种量为10%[15]。
1.3 仪器与设备
ARTP诱变育种仪,思清源生物科技有限公司;ZW0615062604紫外可见分光光度计,上海光谱仪器有限公司;Waters 2489液相色谱仪,美国Waters公司。
1.4 产柚苷酶菌株的筛选
柚子皮置于阴暗潮湿的环境中3~5 d,取下一块发霉的柚子皮,于无菌生理盐水(质量分数为0.85% NaCl溶液)中180 r/min,30 ℃振荡30 min,取菌悬液梯度稀释后涂布于产柚苷酶菌株筛选培养基,30 ℃恒温培养3~5 d。待菌落长出后分离纯化,直至得到纯种单菌落。
1.5 孢子悬浮液的制备
用无菌生理盐水洗下斜面孢子,装入含有无菌玻璃珠的三角瓶中,150 r/min室温振荡20 min,无菌脱脂棉过滤,即可得到均匀分散的孢子悬液。用血球计数板在电子显微镜下计数,调整孢子悬液为所需浓度。
1.6 生长曲线的测定
将孢子悬液(107个/mL)接种于发酵培养基中,在30 ℃、180 r/min的条件下培养。每12 h取发酵液5 mL,5 000 r/min离心20 min,弃上清液。沉淀用蒸馏水反复冲洗过滤至滤液澄清,于烘箱中烘至恒重,冷却称重。
1.7 酶活的测定
参照DAVIS[16]的方法。发酵液离心后上清液即为待测酶液,向具塞试管中分别加入0.6 mL柚皮苷标液(500 μg/mL)、0.3 mL醋酸缓冲溶液(0.2 mol/L pH 4.0)和0.1 mL待测酶液,60 ℃ 150 r/min振荡30 min,沸水浴灭活。向灭活后的酶解液中加入4.9 mL 90%(体积分数)的一缩二乙二醇溶液和4 mL蒸馏水,40 ℃水浴锅中预热5 min,再加入0.1 mL NaOH(4 mol/L)溶液,摇匀,40 ℃水浴10 min,用分光光度计于420 nm处测吸光值。空白用醋酸缓冲溶液代替待测酶液,酶活平行测定3组,计算如公式(1)所示:

(1)
酶活力定义为:在60 ℃,pH 4.0条件下,1 min钟消耗1 μg柚皮苷所需的酶量为1个酶活力单位,以U计。
1.8 复合诱变
1.8.1 紫外诱变
将装有孢子悬液(107个/mL)的培养皿放在搅拌器上,将灭菌的转子放入皿中,照射距离为30 cm,照射功率15 W,时间梯度依次为0、1、2、3、4、5、6、7、8、9 min。照射后,将菌悬液于4 ℃低温保存2 h,防止其自身修复[17]。取100 μL低温保存的菌悬液涂布,30 ℃静置培养3 d,待长出单菌落后计数,计算诱变致死率,绘制致死曲线,致死率计算如公式(2)所示:

(2)
1.8.2 ARTP诱变
取1 mL经紫外诱变的孢子悬浮液,加入60%(体积分数)甘油84 μL,充分混匀。取10 μL混匀后的孢子悬液均匀涂在已灼烧灭菌冷却的金属载片上,诱变工作气体为氦气,温度为20 ℃,诱变功率为120 W,气流量为10 L/min,处理距离为2 mm。孢子悬液分别处理0、1、2、3、4、5、6、7、8 min,然后将金属载片放入装有1 mL无菌生理盐水的离心管中,振荡1 min。取诱变后的菌悬液100 μL涂布于固体平板培养基中,30 ℃静置培养3 d,待长出单菌落后并计数,计算诱变致死率,绘制致死曲线。
1.9 诱变菌株的筛选
1.9.1 诱变菌株的初筛
待平板中菌落长出后,观察菌落周围是否有透明水解圈的产生,根据HC值初步判断诱变菌株产酶活力的大小,HC值计算如公式(3)所示:

(3)
1.9.2 诱变菌株的复筛
将初筛挑选出的菌株接种于发酵培养基中,30 ℃,180 r/min摇瓶培养,每隔12 h测定酶活,验证其摇瓶发酵产酶活力大小,保留产酶活力较原始菌株有所提升的突变株。
1.9.3 遗传稳定性检测
将得到的具有较高酶活的突变株传代5次,测其酶活,检测其遗传稳定性。
1.10 柚苷酶酶解条件探究
1.10.1 温度对酶解条件影响
将诱变得到的最佳突变株发酵液离心,取上清液为粗酶液。取5组试管,分别在30、40、50、60、70 ℃条件下酶解,其余步骤同1.7。
1.10.2 pH对酶解条件影响
取8组试管,分别在pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0条件下酶解,其余步骤同1.7。
1.11 突变株发酵产酶脱苦果汁应用
1.11.1 果汁脱苦
采摘的宜昌蜜橘榨汁后,经4层纱布过滤,滤液于5 000 r/min离心15 min,上清液即为待测果汁。突变株发酵72 h后于5 000 r/min离心20 min,上清液即为粗酶液。取10组具塞试管,每组3支平行,分别向其中加入0.5 mL待测果汁、0.4 mL醋酸缓冲溶液(0.2 mol/L、pH 5.0)和0.1 mL粗酶液,50 ℃ 150 r/min振荡30 min。每隔15 min取出一组试管沸水浴灭火10 min。剩余柚皮苷含量检测采用1.7中的方法。
酶解前后的果汁分别用高相液相色谱分析,验证其柚皮苷剩余量。果汁过 0.45 μm 有机滤膜,采用SunFire C18色谱柱((4.6×250) mm,5.0 μm),柱温25 ℃,进样量10 μL,流速1 mL/min,检测波长286 nm,梯度洗脱程序为:0~1 min,25%~30%A;1~6 min,30%A;6~7 min,30%~35%A;7~12 min,35%A;12~13 min,35%~40%A;13~18 min,40%A;18~19 min,40%~45%A;19~24 min,45%A;24~26 min,45%~58%A;26~50 min,58%A。
1.11.2 果汁理化指标检测
对酶解前后的果汁理化指标进行测定。可溶性固形物采用折射仪测定(NYT 2637—2014),可溶性糖含量采用3,5-二硝基水杨酸比色法测定(NYT 2742—2015),根据GB/T 12456—2008测定总酸含量。
2 结果与分析
2.1 菌种鉴定
从发霉的柚子皮上筛选到1株产柚苷酶菌株,菌落形态如图1所示。该菌菌落呈棉絮状,初生时为白色,后逐渐为褐色至黑褐色,有时会有液滴产生,菌落反面呈淡黄色。分生孢子梗发生于基质,无色透明,壁平滑,分生孢子头为近球形,呈辐射状,呈黑褐色。

a-菌落正面形态;b-菌落背面形态;c-显微镜下菌丝体形态;d-显微镜下孢子形态
通过对此菌株的 ITS 序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,获得了大约 750 bp 的拼接序列。将其在 NCBI 中 BLAST 同源性比对后,构建确定其分类地位的系统发育树(图2),可知此菌与塔宾曲霉(Aspergillustubingensis)的同源性达 100%,由此将其归为塔宾曲霉(Genbank 登录号:MN589840),属子囊菌门,散囊菌纲,散囊菌目,曲霉科,曲霉属。

图2 基于 ITS 序列构建的菌株系统发育树
2.2 生长曲线测定
根据塔宾曲霉MN589840生长曲线(图3)可知,培养时间24 h时,菌体质量明显增高,此阶段为菌体的对数生长期,而酶活较低,仅为1.78 U/mL,可能是因为此时菌体处于大量繁殖阶段,产酶量很少。随着培养时间延长,酶活逐渐增高,于96 h时达到最高,酶活为13.48 U/mL。当培养时间>96 h时,酶活开始下降,菌体质量也显著下降,可能是因为培养基中的营养物质已经消耗殆尽,有害代谢物质不断增加,其生长环境已经不再适合菌体的生长繁殖及产酶。
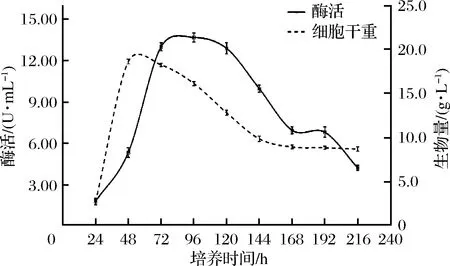
图3 塔宾曲霉 MN589840的生物量及产酶活力随时间变化曲线
2.3 诱变菌株选育
2.3.1 紫外诱变致死曲线
所有的生物细胞都富含核酸和蛋白质等紫外线吸收剂,DNA是紫外线诱导损伤的关键靶点之一。紫外辐射造成的DNA损伤主要是环丁烷-嘧啶二聚体(cyclobutane pyrimidine dimer,CPDs)和6-4光产物(6-4 photoproducts,6-4 PPs)。CPDs的含量最丰富且具细胞毒性,而6-4 PPs具有潜在的致命性[18]。由图4可知,随着诱变的时间增加,菌株的致死率升高。研究表明,紫外诱变致死率达到 80%~90% 时,产生正突变的概率较高[19]。为了便于后期实验,处理时间240 s为最佳诱变时间。
2.3.2 ARTP诱变致死曲线
ARTP产生的多种均匀分布的高活性粒子作用于DNA链,迫使细胞启动高容错水平的SOS修复机制,在修复过程中产生多种失配位点,造成基因突变。ARTP接近室温,可以避免微生物因高温造成热损伤,且操作过程无毒性和有害物质参与,在生物诱变育种中具有广阔的应用前景[20-21]。
由图4可知,ARTP诱变时间与塔宾曲霉的致死率存在着显著的剂量效应关系。低剂量时,菌株细胞受到大量的活性粒子注入,致死率急剧上升。随着诱变时间增加,细胞修复机制和修复酶被激活,单位时间内细胞的致死率降低。继续加大剂量,细胞损伤无法恢复,致死率再次急剧上升。研究表明,这种现象称为双鞍延迟规律,与微生物的修复机制有关,是传统诱变不具备的特点[22]。为了方便后期筛选,本实验选择致死率达98%,处理时间300 s为最佳诱变时间。

图4 UV诱变和ARTP诱变对塔宾曲霉的致死曲线
2.3.3 紫外-ARTP复合诱变
微生物诱变育种作为最实用、有效的育种策略之一而被广泛应用[23]。国内外关于产柚苷酶菌株诱变育种的报道并不多见。李耀等[24]将黑曲霉M53经紫外-LiCl复合诱变,选育出1株产柚苷酶突变株 M53-7,其酶活较原始菌株提高了42.77%。朱运平等[19]以米曲霉 11250为出发菌株,采用紫外-NaNO2复合诱变选育出1株产柚苷酶突变菌株 UN2,其发酵酶活是原始菌株的2.3倍。ARTP作为一种新型诱变工具,具有设备简单、操作方便、安全、高效、环境友好等特点[25]。至今,仍没有ARTP与传统诱变相结合,诱变产柚苷酶菌株的报道。复合诱变由于包含多种诱变方式,可以产生多种突变类型,避免因单一诱变产生的诱变饱和效应[26]。本研究将塔宾曲霉 MN589840经紫外-ARTP复合诱变,最终得到6株突变株。由表1可知,突变株 UA13酶活最高,是原始菌株的3.06倍。
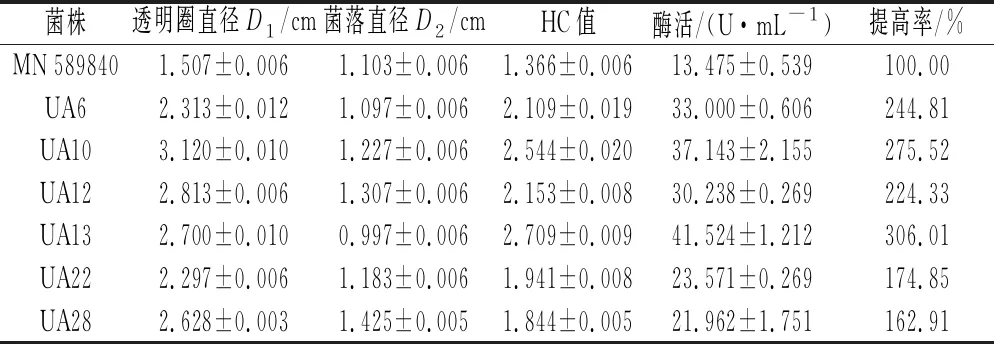
表1 紫外-ARTP 复合诱变结果
2.4 遗传稳定性检测
将突变株UA13连续传代5次(表2)具有较好的遗传稳定性。
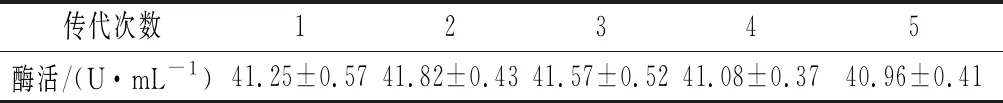
表2 突变株UA13遗传稳定性检测
2.5 柚苷酶酶解条件探究
2.5.1 温度对酶解作用的影响
温度对酶活的影响主要分为2个阶段。当温度升高时,反应速度加快,酶活升高;当温度持续升高,超过柚苷酶的热稳定性范围,酶原有结构遭到破坏,使其活力降低。如图5所示,酶解温度在30~40 ℃时,酶活逐步增大;40~50 ℃具有较好酶活,50 ℃时酶活最高;当酶解温度>50 ℃时,酶活迅速降低,温度达到70 ℃,酶活几乎完全丧失。此试验表明,该柚苷酶最适酶解温度为40~50 ℃。酶解温度过低,不能完全激活酶活,柚苷酶无法完全达到其活力;而温度过高,会使酶蛋白变性,丧失其活力。

图5 温度对酶解作用的影响
2.5.2 pH对酶解作用的影响
pH对酶活的影响主要存在2个方面。(1)pH对酶的稳定性有一定影响。若反应体系的pH使酶产生不稳定性,则会影响到酶解反应。(2)酶对底物柚皮苷具有最适pH范围。当pH处于该范围内,酶对底物可以发挥最大作用。如图6所示,柚苷酶活力随pH的增加呈现先增加后降低的趋势。当pH在3.0~5.0时,酶活随着pH的增大而增大;pH为5.0时,酶活处于峰值;pH>5.0后,反应体系pH不利于酶解,酶活迅速下降。
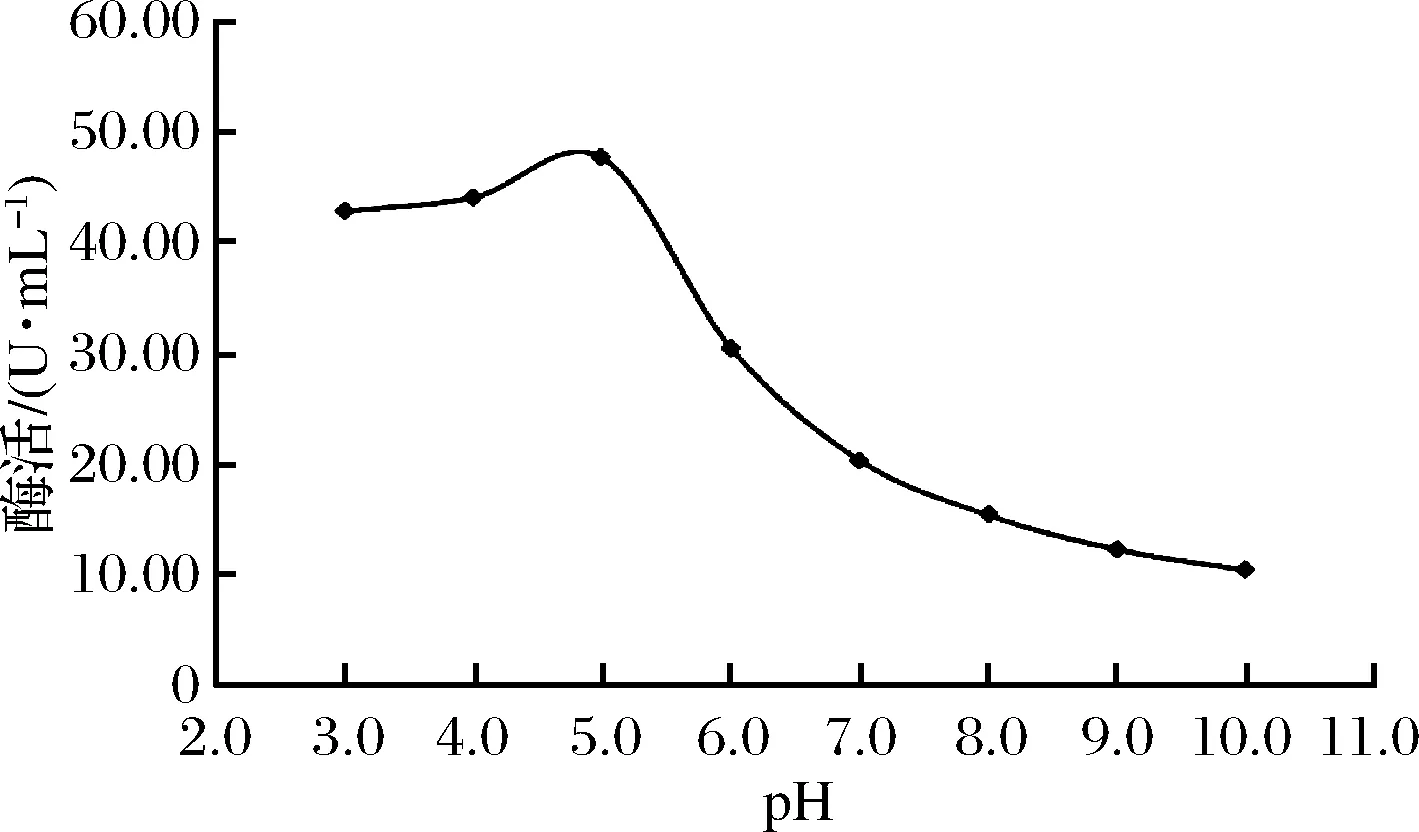
图6 pH对酶解作用的影响
2.6 突变株发酵产酶脱苦蜜橘果汁
果汁中柚皮苷含量随水解时间变化如图7所示。柚皮苷苦阈值(人们能感觉到苦味的最低质量浓度)约为30 μg/mL[27],当酶解约50 min时,果汁中柚皮苷含量低于苦阈值;当酶解时间>75 min时,果汁中仅剩下少量柚皮苷。与图8-b对比,图8-c中的柚皮苷大量降低。因此,突变株UA13能够产生柚苷酶且该酶具有高效水解果汁中柚皮苷的能力。

图7 柚皮苷含量随酶解时间的变化情况

a-柚皮苷标品;b-脱苦前柚皮苷含量色谱图;c-脱苦后柚皮苷含量色谱图
2.7 果汁脱苦理化指标鉴定
蜜橘果汁经粗酶液脱苦后理化指标变化结果如表3所示。可溶性固形物、蔗糖和总酸含量均有下降。
酶解时,加热过程会使果汁总酸、总糖及可溶性固形物含量降低。果汁中,含有可挥发性酸,加热促使其挥发,致使含量降低。而果汁中含有多种淀粉、纤维素等大分子糖类,在加热过程中加速运动,使其相互碰撞进而沉淀,导致总糖含量降低。果汁中含有大量的果胶等大分子颗粒物质。据报道,柚苷酶中的α-L-鼠李糖苷酶主要作用于末端鼠李糖键,可将果胶的α-(1,4)鼠李糖苷键水解,从而引起总糖含量减少[28]。
固酸比(可溶性固形物和总酸之比)和糖酸比(总糖和总酸含量之比)是判断果汁风味的重要指标。脱苦过程虽然会降低果汁中可溶性固形物、总糖和总酸含量,但其固酸比和糖酸比均有提高。因此,该酶具有提高果汁风味的能力。

表3 宜昌蜜橘脱苦前后理化指标的测定
3 结论
本研究从腐烂的柚子皮上筛选出1株产柚苷酶菌株,经鉴定为塔宾曲霉(Aspergillustubingensis)MN589840,其摇瓶发酵酶活为13.475 U/mL。经紫外-ARTP复合诱变,最终得到1株柚苷酶高产突变株 UA13,其摇瓶发酵酶活可达41.524 U/mL,是原始菌株的3.06倍。连续传代5次后,具有遗传稳定性。对突变株UA13产酶酶解条件进行探究得知,该酶酶解最适温度为40~50 ℃,最适pH值为5.0。用突变株UA13发酵粗酶液脱苦宜昌蜜橘果汁,结果显示,该酶能有效水解果汁中的柚皮苷,且具有一定提高果汁品质的能力。因此,该菌具有潜在的工业应用价值,可为后期实验研究奠定基础。
