高产酯化酶细菌的复合诱变选育及固态发酵条件优化
2021-01-29赵志军张艳珠刘延波周平平葛少华孙西玉
赵志军,张艳珠,3,刘延波,周平平,葛少华,孙西玉*
1(河南牧业经济学院 酒业学院,河南 郑州,450046)2(宝丰酒业有限公司,河南 平顶山,467500)3(宁波大学 食品与药学学院,浙江 宁波,315211)
中国白酒作为全球消费量最大的蒸馏酒[1],是以粮谷为主要原料,在酒曲等糖化发酵剂的作用下,经蒸煮、糖化、发酵、蒸馏而成[2]。白酒的发酵是多种微生物协同作用的结果[3],微生物代谢产生种类繁多的微量有机化合物构成了白酒独特的“香和味”[4-6]。白酒中含有约2%的呈香呈味物质决定着酒体的品质[7]。其中酯类的含量最为丰富,其含量高低是影响白酒质量和风格的主要因素[8-9]。通常来说,优质白酒中的酯含量也相对较高。
酯化酶亦称为羧基酯酶,是微生物产酯过程中的关键酶,能够催化低级脂肪酸酯的合成[10]。产酯微生物的产酯化酶能力提升,能够增加白酒中酯类的含量进而提升白酒品质[11]。因此,筛选高产酯化酶微生物并强化其产酶能力,对白酒的生产及质量的提高具有非常重要的意义。谢军等[12]从酒曲中筛选得到具备酯化力的酵母菌和霉菌。田宇敏[13]从清香型白酒酒醅中分离得到产香的白地霉。单淑芳等[14]筛选出酯化力较强的红曲霉。赵志军等[15]从窖泥中筛选得到酯化型细菌。诸多产酯微生物的获得,为其在白酒生产中的应用奠定了基础。
理化诱变是一种获得优良菌种的有效方式[16]。紫外线(ultraviolet,UV)诱变具有操作简便,效果好、安全性高的特点[17-18],是微生物诱变育种中较为常用的手段。硫酸二乙酯(diethyl sulfate,DES)是一种烷化诱变剂,常用于高产优质菌株的选育,效果显著[19-20]。复合诱变是将两种及两种以上的诱变方法结合使用,形成诱变互补优势,与单因素诱变相比效果更好。SONG等[21]通过高能碳重离子辐照和NaNO2联合处理,获得了1株高产阿维菌素B1a的突变体。刘文龙等[22]采用UV-等离子体复合诱变选育出了高产酸性蛋白酶菌株;刘刚等[23]通过UV-DES复合诱变筛选出了高产胞外多糖突变株。以上研究均表明利用复合诱变技术,使得菌株原有有益性状得到较大幅度的提升。
目前,对产酯化酶微生物的研究以酵母和霉菌居多,细菌的研究较少,对产酯化酶细菌的复合诱变选育未见报道。本研究以先期筛选获得的贝莱斯芽胞杆菌(Bacillusvelezensis)为出发菌株,对其进行UV-DES复合诱变选育,获得高产酯化酶菌株,并进行固态发酵条件优化。该研究有望获得高产酯化酶细菌菌株,为提高白酒优质酒出产率提供有价值的可参考信息。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
贝莱斯芽胞杆菌(B.velezensis)Nz 1.201[15],由河南牧业经济学院白酒风格工程技术中心分离并保藏。
1.1.2 试剂
生化试剂牛肉膏、蛋白胨,北京奥博星生物技术有限责任公司;生化试剂琼脂粉,北京索莱宝科技有限公司;分析纯无水乙醇、葡萄糖、NaOH,天津市科密欧化学试剂有限公司;三丁酸甘油酯、色谱纯硫酸二乙酯(分析纯),上海麦克林生化科技有限公司;聚乙烯醇(polyvinyl alcohol,PVA),上海臣启化工科技有限公司;HCl(分析纯),南京化学试剂股份有限公司。
1.1.3 培养基
液体培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5,调pH至5.0。
固体培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5,琼脂粉20,调pH至5.0。
种子培养基(g/L):牛肉膏20.0,葡萄糖20.0,NaCl 0.5,K2HPO41.0,(NH4)2SO41.0,SO4·7H2O 1.0,FeSO4·7H2O 0.01,调pH至5.0。
初筛培养基:细菌液体培养基与乳化液按体积比9∶1混合,琼脂粉20 g/L,并充分混匀;
固态发酵培养基:250 mL三角瓶中装入含水量调整为60%(质量分数)的麸皮100 g。
以上培养基的灭菌条件均为121 ℃、0.1 MPa高压灭菌30 min。
PVA溶液:称取3 g PVA于100 mL蒸馏水中,边加热边搅拌,使其完全溶解,并用无菌纱布过滤。
乳化液:PVA溶液和三丁酸甘油酯按体积比9∶1混合,并充分摇匀。
1.2 仪器与设备
SW-CJ-2F型超净工作台,苏州净化设备有限公司;LDZX-50KBS高压蒸汽灭菌锅,上海申安医疗器械厂;DNP-9272BS恒温培养箱,上海一恒科学仪器有限公司;ZQLY-300S恒温培养摇床,上海精宏试验设备有限公司;H1850R台式冷冻高速离心机,湖南湘仪实验室仪器开发有限公司;DHG-9143BS电热鼓风干燥箱,上海新苗医疗器械制造有限公司。
1.3 实验方法
1.3.1 初始菌株酯化酶酶活力测定
取出-20 ℃保藏的菌株Nz 1.201,接种于试管斜面固体培养基上,30 ℃条件下培养48 h,使其活化。将活化后菌种,接种到种子培养基中,在30 ℃、150 r/min条件下摇床培养48 h。按3%的接种量,将种子液接入到固态发酵培养基中,置于30 ℃的培养箱中,每隔24 h摇瓶一次,培养6 d,即为麸曲。将其倒于已灭菌的牛皮纸上,置于干燥箱中30 ℃烘干,密封保存。
酯化酶酶活力测定:参考QB/T 4257—2011《酿酒大曲通用分析方法》中酯化力的测定方法[24]。
酯化酶酶活力定义为:每100 g大曲在35 ℃,经过7 d催化,己酸和乙醇合成己酸乙酯的毫克数为1个酶活力单位(U/100g)。
1.3.2 复合诱变及筛选
对出发菌株进行UV诱变,筛选出酶活力最高的菌株,之后进行DES诱变,并从中筛选出酶活力进一步提高的突变株,随即进行遗传性能检测。
1.3.2.1 UV诱变及筛选
挑取斜面培养基上的出发菌株,接种到含有100 mL种子培养基的250 mL三角瓶中,150 r/min、30 ℃条件下培养36 h至对数期中期,制备成菌悬液。
取菌悬液5 mL置于灭菌的直径9 cm培养皿中,置于UV诱变灯正下方50 cm处,打开皿盖,准确记时,处理时间分别为0、0.5、1、2、3、4、5 min。对每个处理样品均进行梯度稀释,取0.1 mL稀释液涂布培养基平板,30 ℃倒置暗培养3 d,观察记录。统计菌落,计算致死率,选择致死率为70%~90%作为UV最佳照射时长[25],计算如公式(1)所示:

(1)
根据最佳UV照射时长对出发菌株进行UV诱变,之后进行系列稀释、涂布,并于30 ℃培养箱中倒置暗培养3 d,观察记录。
从平板上挑取长势良好的菌株,点接种于初筛培养基,30 ℃培养3 d后,观察菌落周围的透明圈,记录透明圈直径(D)与菌落直径(d)之比HC值。选取HC值大的菌株进行固态发酵,测定其酯化酶酶活力,具体方法同1.3.1。
1.3.2.2 DES诱变及筛选
将UV诱变获得的菌株制备成菌悬液。各取10 mL,分别加入一定量的DES,形成DES含量为0.5、1.0、2.0、3.0、4.0、5.0 μL/mL的6个诱变浓度梯度,以不加DES为空白对照。在30 ℃、150 r/min条件下摇床振荡30 min,然后加入1 mL 20 g/L Na2S2O3终止诱变反应[26]。将处理后的菌悬液稀释涂布,30 ℃下培养3 d,统计菌落数,计算致死率。选择致死率为80%~90%为DES最佳诱变剂量,致死率计算如公式(2)所示:

(2)
选取最佳DES诱变剂量对菌悬液进行诱变,按1.3.2.1方法对突变株进行筛选。
1.3.2.3 遗传稳定性测定
对复合诱变获得的酯化酶酶活力显著提高的突变株进行连续传代5次培养,测定其酶活力,以确定突变菌株的遗传稳定性。
1.3.3 固态发酵条件优化
1.3.3.1 单因素试验
对培养温度、培养时间、接种量、原料含水量进行单因素试验,因素水平设计具体见表1。
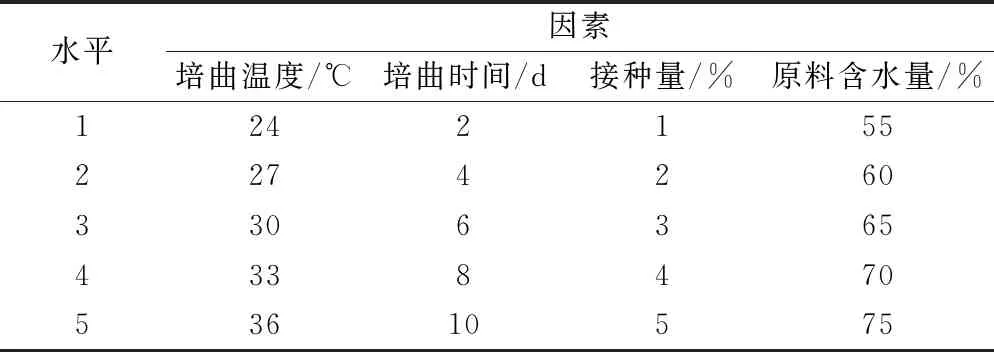
表1 单因素水平设计表
1.3.3.2 酯化酶酶活力测定
进行酯化酶酶活力测定,具体方法同1.3.1。
1.3.3.3 响应面优化固态发酵条件
根据单因素试验的结果,选择对菌株酯化酶酶活力影响较大的3个因素作为自变量,以酶活力为响应值(Y),利用Design-Expert软件设计Box-Behnken试验,确定最优固态发酵条件并对其进行验证。
2 结果与分析
2.1 初始菌株酯化酶酶活力测定
对菌株Nz 1.201进行酯化酶酶活力测定,测得其酶活力为37.70 U/100g。
2.2 复合诱变及筛选
2.2.1 UV诱变结果
对出发菌株进行UV照射,测定不同照射时长菌株的致死率,结果见图1。在一段时间内,随着UV照射时间的延长,菌株的致死率急剧增大,当照射时间为3 min时,菌株致死率约为82%,此时正突变率最大,以此作为UV诱变最佳照射时间。

图1 UV照射时间对菌体致死率的影响
2.2.2 UV诱变筛选
以UV照射3 min对出发菌株Nz 1.201进行处理,之后进行梯度稀释,涂布初筛培养培养皿上,于30 ℃倒置暗培养3 d。获得长势良好的菌株30株,编号为B1~B30,选取HC值大的10株菌株进行固态发酵,并测定其酯化酶酶活力,结果见表2。

表2 UV诱变突变株的HC值及酯化酶酶活力测定
由表2可知,突变株B28酯化酶酶活力最高,达48.52 U/100g,较原始菌株Nz 1.201提高了约29%。
2.2.3 DES诱变
将菌株B28制成菌悬液,测定在不同浓度的DES处理条件下B28的致死率,测定结果见图2。

图2 DES含量对菌体致死率的影响
由图2可知,当DES含量为3 μL/mL时,菌株B28致死率约为89%,以此作为DES处理的最佳浓度。
2.2.4 DES诱变筛选
以DES含量为3 μL/mL对B28进行处理,获得菌株共计40株,编号为D1~D40,从中挑选出HC值较大的12株菌株进行固态发酵,测定其酯化酶酶活力,结果见表3。

表3 DES诱变突变株的HC值及酯化酶酶活力测定
由表3可知,突变株D27酯化酶酶活力最高,70.90 U/100g,较B28酶活力提高了约46%,较原始菌株Nz 1.201酶活力提高了88%。因此,选取D27作为遗传稳定性测定及固态发酵条件优化菌株。
2.3 遗传稳定性测定
将筛选到的突变菌株D27连续传代培养,对连续培养的5代菌株进行酯化酶酶活力测定,以确定突变菌株的遗传稳定性,测定结果见图3。
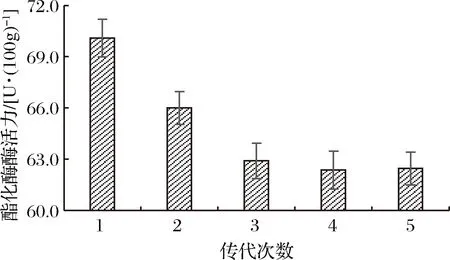
图3 突变株的遗传稳定性测定结果
由图3可知,在对突变株D27进行第3~5次传代时,酯化酶酶活力趋于稳定,为62.45 U/100g,较出发菌株酯化酶酶活力提高了66%。由此可知经UV-DES复合诱变得到的突变株D27具有较好的遗传稳定性。
2.4 单因素试验
2.4.1 培养温度对菌株酯化酶酶活力的影响
由图4可知,菌株D27的酯化酶酶活力随着培养温度的升高先增大后减小。培养温度对菌株影响较大,培养温度较低时,菌株的生长较慢,酶的分泌量少,酶活力较低;随着培养温度的升高,微生物代谢旺盛,酶的分泌量逐渐增加,酶活力增大;在培养温度为33 ℃时,菌株D27的酯化酶酶活力达到最大值为85.74 U/100g;培养温度继续升高,不利于菌株生长,酶产量和积累量减少,酶活力降低。

图4 不同培养温度菌株酶活力的影响
2.4.2 培养时间对菌株酯化酶酶活力的影响
培养时间对菌株酯化酶酶活力的影响见图5。
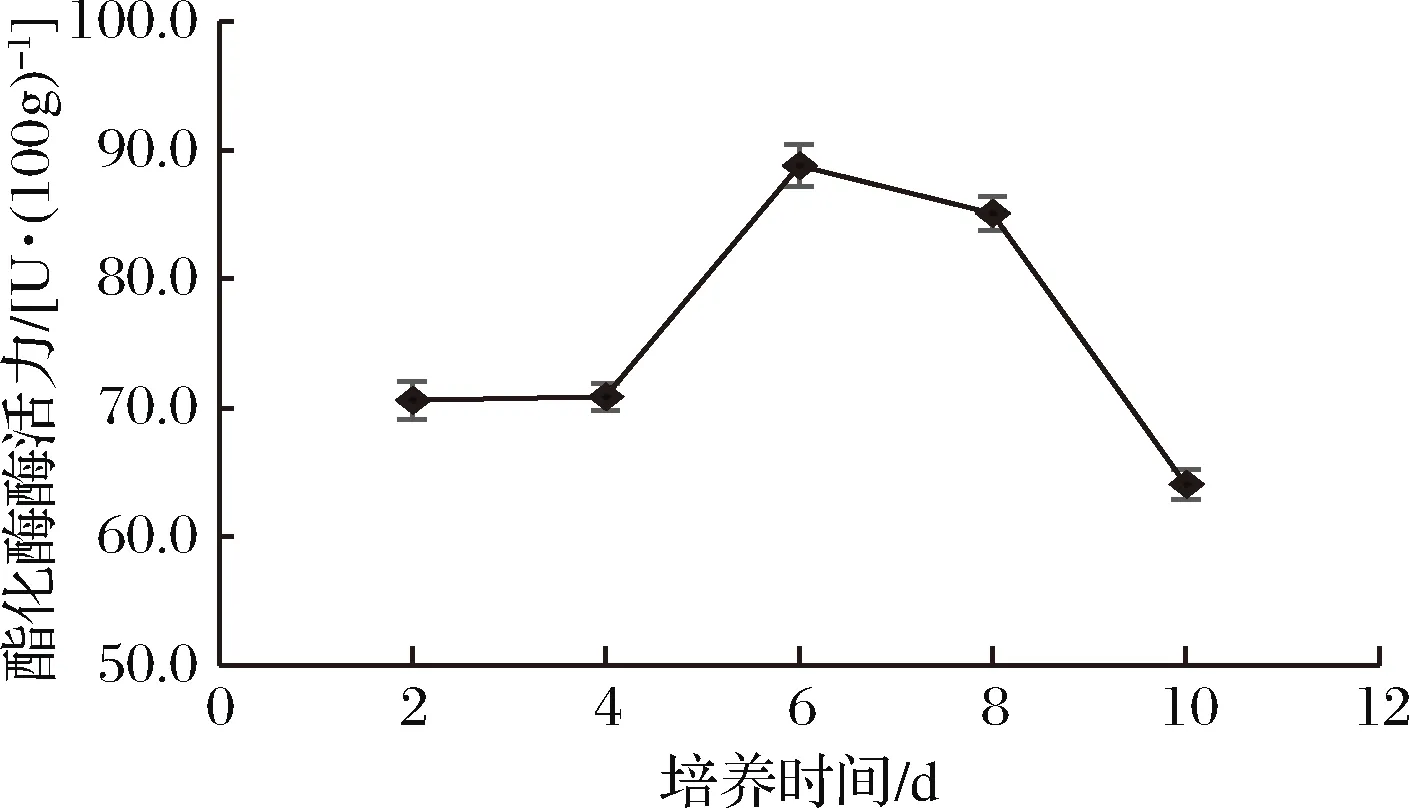
图5 不同培养时间对菌株酶活力的影响
由图5可知,菌株D27的酯化酶酶活力随着培养时间的增加先增大后减小。培养时间较短时,菌株未能充分生长繁殖,酶的分泌量和积累量较少,酶活力较低;随着培养时间的延长,酶的分泌量和积累量逐渐增加,酶活力升高;在培养时间为6 d时,菌株D27的酯化酶酶活力达到最大值为88.81 U/100g;培养时间继续增加,培养基质被大量消耗,菌株进入衰亡期,产酶量逐渐减少,部分酶开始失活,酶活力下降。
2.4.3 接种量对菌株酯化酶酶活力的影响
接种量对菌株酯化酶酶活力的影响结果见图6。

图6 不同接种量对菌株酶活力的影响
由图6可知,菌株D27的酯化酶酶活力随着接种量的增加先增大后减小。在接种量为3%时,菌株D27的酯化酶酶活力最大为82.27 U/100g;接种量继续增加,微生物大量生长加快了对基质的消耗,产酶量降低,酶活力急剧下降。
2.4.4 原料含水量对菌株酯化酶酶活力的影响
原料含水量对菌株酯化酶酶活力的影响结果见图7。
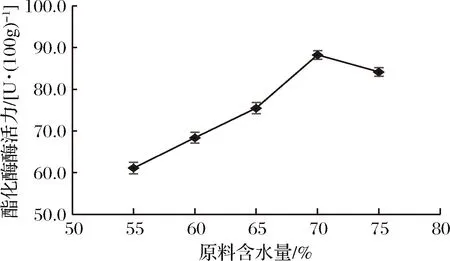
图7 不同原料含水量对菌株酶活力的影响
由图7可知,菌株D27的酯化酶酶活力随着原料含水量的增加先增大后减小。原料含水量过少,抑制微生物的生长代谢,酶的分泌量较少,酶活力较低;随着含水量的增加,微生物生长代谢增加,酶活力显著提高;在原料含水量为70%时,菌株D27的酯化酶酶活力最大为88.24 U/100g;继续增大原料含水量,固态培养基质产生粘黏现象,透气性较差,不利于微生物的生长代谢及酶活积累,产酶量减少,酶活力降低。
2.5 响应面试验结果
根据单因素分析结果,选取对菌株酯化酶酶活力影响较大的培养时间、接种量、原料含水量3因素作为自变量,以酯化酶酶活力为响应值(Y),采用Design Expert软件设计响应面分析试验。对数据进行回归分析,确定最佳固态发酵条件,并设计试验进行验证。根据Box-Behnken试验设计原理,设计试验因素水平表,见表4。

表4 Box-Behnken 试验因素与水平
2.5.1 模型方差分析及响应面分析
依据Box-Behnken试验设计原理,设计17个试验点的响应面分析试验,试验设计与结果见表5所示。
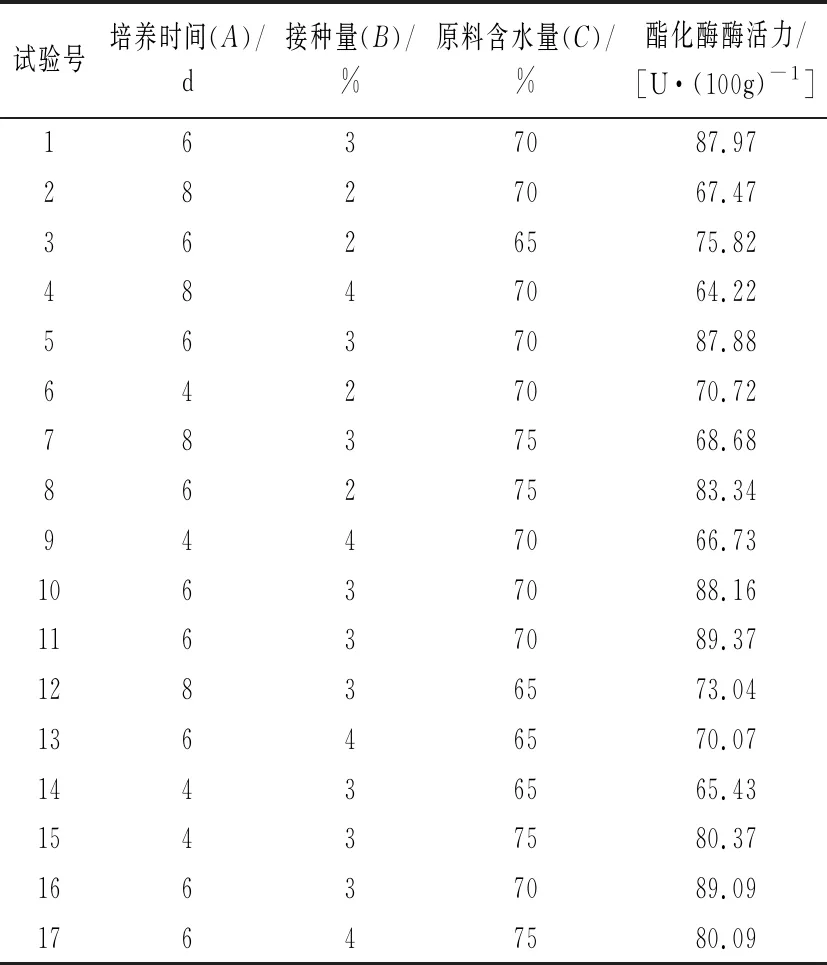
表5 Box-Behnken 试验设计及结果
采用Design Expert 8.0.6软件对表5数据进行二次回归方程拟合,得到菌株酯化酶酶活力对培养时间(A)、接种量(B)及原料含水量(C)的多元二次回归方程:酯化酶酶活力=88.49-1.23×A-2.03×B+3.52×C+0.18×A×B-4.82×A×C+0.62×B×C-13.33×A2-7.88×B2-3.28×C2具体结果见表6。
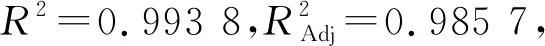
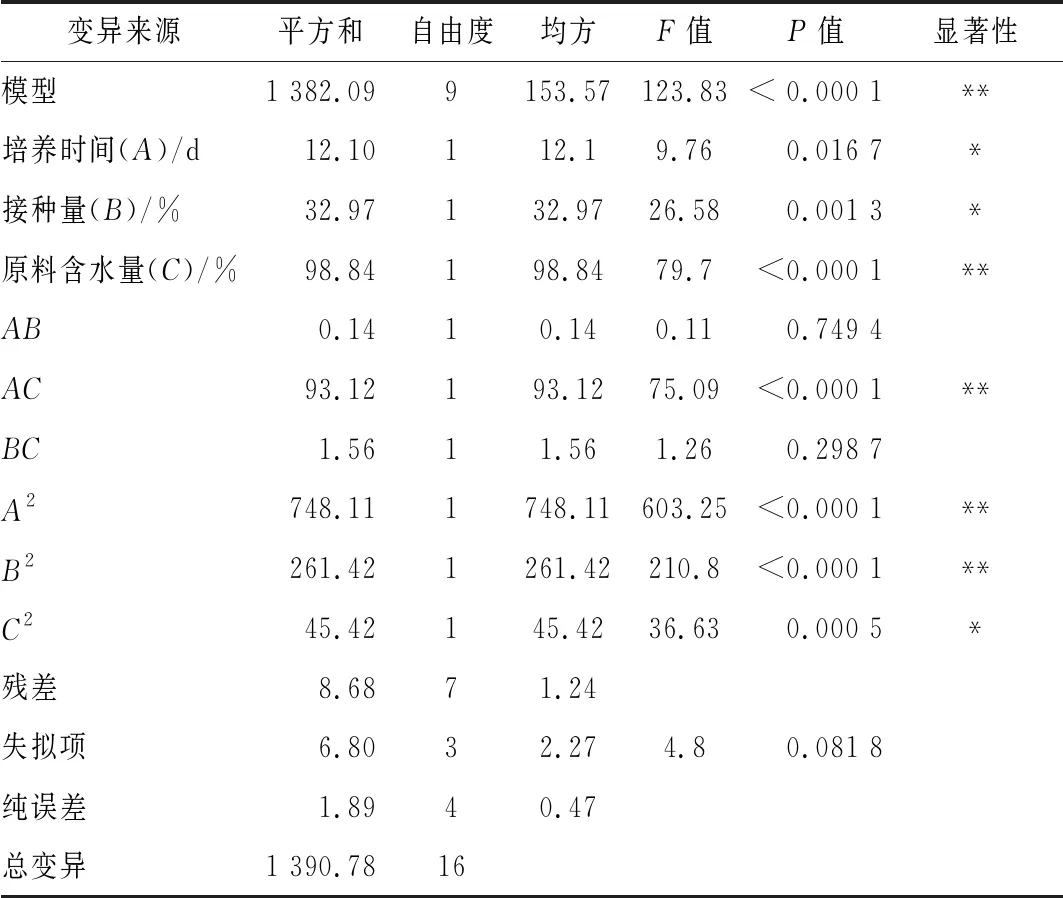
表6 响应面试验回归模型方差分析
2.5.2 各因素响应面交互作用分析
根据回归方程绘制响应面分析图,以确认培养时间、接种量和原料含水量对酯化酶酶活力的影响,响应面曲面和等高线见图8。

a~b,接种量和培养时间;c~d,原料含水量和培养时间;e~f,接种量和原料含水量
2.5.3 验证试验
通过Design Expert 8.0.6软件分析,培养温度为33 ℃时,固态发酵最佳条件为培养时间5.67 d、接种量2.90%、原料含水量73.23%,在此条件下酯化酶酶活力的理论值为89.84 U/100g。考虑到实际操作可行性,在培养温度为33 ℃时,选择固态发酵条件为培养时间6 d、接种量3%、原料含水量73%进行验证试验。
对突变株D27进行固态发酵验证,测得优化后的酯化酶酶活力为89.52 U/100g,较出发菌株酶活提升了137%,验证结果与响应面试验预测结果基本一致,说明优化条件方案可行。
3 结论
本研究利用UV-DES复合诱变处理产酯化酶菌B.velezensisNz1.201,获得了酯化酶酶活显著提高且遗传性能稳定的突变菌株B.velezensisD27,其酯化酶酶活为62.45 U/100g,比初始菌株提高了66%。基于单因素实验的响应面优化结果显示,该菌株的最佳固态发酵条件为培养温度33 ℃、培养时间6 d、接种量3%、原料含水量73%。在此条件下,B.velezensisD27的酯化酶活力最高可达89.52 U/100g,较初始菌株酶活提高了137%。综上所述,本研究获得了1株高产酯化酶菌株,为产酯化酶细菌的固态培养提供了重要的参考依据,对产酯化酶细菌在白酒生产中提高优质酒出产率领域的研究奠定了基础。
