布拉氏酵母壁多糖对早期断奶羔羊血清生化指标、肠道微生物和挥发性脂肪酸的影响
2021-01-29刘孟健张文举
刘孟健 张文举 姚 峻
(石河子大学动物科技学院,新疆石河子832000)
羔羊早期断奶技术逐渐应用于现代化的养羊生产中,其能快速促进羔羊消化系统的发育[1],并能加快羔羊对固体配合饲料的适应,同时降低母羊的饲料及管理成本,并加快母羊产后恢复的速度,实现了高频高效繁殖,提升了整体的养殖效率[2-3]。但在早期断奶技术的实施中,时常出现羔羊断奶应激和消化系统功能紊乱的现象[4],特别是在北方牧区的冬春换季时期,羔羊常常出现生长缓慢、肠道菌群发育迟缓、免疫力低下及死亡的情况[5]。
布拉氏酵母具有抵抗病原微生物、改善肠道菌群结构以及增加机体免疫力的作用[6],常常将其应用在防治婴幼儿腹泻的治疗中[7]。而布拉氏酵母壁多糖主要由β-葡聚糖、甘露聚糖、异多糖和几丁质组成,为其生物活性的主要成分,不会因其作为外源微生物进入肠道而对机体造成影响,具有安全可靠、无残留、无抗药性、无污染、安全绿色等特点,然而目前对布拉氏酵母壁多糖的生物学功能及相关应用的研究报道较少[8-9]。本试验以早期断奶羔羊为研究对象,旨在讨论不同水平的布拉氏酵母壁多糖对早期断奶羔羊的血清生化指标和抗氧化性能、以及盲肠微生物和挥发性脂肪酸的影响,为布拉氏酵母壁多糖在养羊生产中的生物学功能及应用提供理论依据。
1 材料与方法
1.1 试验材料
布拉氏酵母壁多糖来源于石河子大学动物科技学院,其主要成分为:多糖≥83%,蛋白质≤8%,水分≤6%,粗灰分≤1%;庆大霉素来源于芮城绿曼生物药业有限公司;羔羊预混料来自恒众(天津)农牧科技有限公司;幼儿配方奶粉(三段)购于内蒙古伊利实业集团股份有限公司。
1.2 试验设计
选择体况良好、健康无疾病、体重相差在100 g以内、平均日龄为17 d 的初生羔羊60 只,其中公羔45只、母羔15只,试验羔羊为萨福克种羊与当地哈萨克羊的杂交品种。按同质原则分为5组,每组3个重复,其中每个重复为3只公羔和1只母羔,试验前的组间羔羊体重差异不显著,并采用单因子试验设计,分别设置对照Ⅰ组(普通羔羊代乳料)、阳性对照Ⅱ组(代乳料+0.005%庆大霉素)、试验Ⅲ组(代乳料+0.1%布拉氏酵母壁多糖)、试验Ⅳ组(代乳料+0.3%布拉氏酵母壁多糖)、试验Ⅴ组(代乳料+0.5%布拉氏酵母壁多糖)。
1.3 试验饲粮
参照NRC(2007)绵羊(体重20 kg、日增重300 g)的营养需要量标准对羔羊代乳料进行配制,其原料组成及营养水平见表1。

表1 试验基础代乳料组成及营养水平(风干状态)
1.4 饲养管理
本试验与2019年11月23日至2020年1月8日,在昌吉市庙沟乡和谐二村兴丰养殖合作社进行,试验环境为半封闭式羊舍,各组间的饲养和管理方式一致。试验于羔羊17 日龄开始,羔羊于32 日龄强制断奶,饲喂至羔羊60日龄结束。试验期共计44 d,其中过渡期7 d(17~23日龄)、预试期8 d(24~31日龄)、正试期29 d(32~60 日龄)。过渡期羔羊以吮乳为主,人工训练羔羊采食1号代乳料;预试期逐渐减少羔羊吮乳时间(减至每日哺乳1次),自由采食2号代乳料;试验期断奶羔羊自由采食2 号代乳料。所有代乳料均用45~50 ℃的温开水以1∶4的料水比冲泡搅匀,每日饲喂4 次,分别为8:00、13:00、18:00 和23:00,自由饮水[10]。
1.5 样品采集
于试验结束的当天早晨10:00,从每个重复中随机选取2 只羔羊进行静脉采血10 mL,加入抗凝剂并充分摇匀,放入车载冰箱4 ℃保存,并于采血后4 h内送样检测[11]。
于试验结束的第2 d早晨10:00,从每个重复中随机选取1 只羔羊进行4%戊巴比妥钠肌肉注射,对其麻醉,20 min后采用颈部放血将其处死。去毛并划开腹腔,用棉绳将带有内容物的盲肠肠段分别于中间和两端结扎,将已结扎的2 段盲肠剪断并从腹腔中取出,其中一段带有内容物的盲肠用样品袋包被后迅速至于液氮中冷冻,用于盲肠内容物中挥发性脂肪酸的检测[12];在无菌环境下(酒精灯火焰上方的无菌环境),快速将另一个盲肠段中的内容物取出并放入充满ATCC 冷冻保护剂(10%甘油+5%二甲亚砜+培养液)的样品袋中,缓慢降温后置于液氮中冷冻,用于盲肠内容物中微生物的检测[13]。
1.6 测定指标与方法
1.6.1 血清生化指标测定
羔羊血清中血糖、总蛋白、白蛋白、球蛋白、尿素氮、总胆固醇、三酰甘油、谷丙转氨酶、谷草转氨酶、碱性磷酸酶、谷氨酰转移酶、乳酸脱氢酶等指标均送至昌吉回族自治州人民医院测定。
1.6.2 血清抗氧化指标测定
羔羊血清中谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)、丙二醛(MDA)含量均按照试剂盒(南京建成生物工程研究有限公司)说明书进行测定[14]。
1.6.3 盲肠中微生物的测定
液氮中的盲肠样品解冻,在无菌环境中准确称取结肠组织中的内容物2.0 g,并置于室温备用。盲肠中乳酸菌、双歧杆菌、大肠杆菌、沙门氏菌、产气荚膜梭菌和总好氧菌均用培养皿计数法测定[15]。培养基种类与培养条件见表2。

表2 待测微生物培养基种类及培养条件
1.6.4 盲肠中挥发性脂肪酸的测定
将液氮中的盲肠样品解冻,取出盲肠组织中的内容物放入密封袋中备用。参考耿梅梅等[23]的方法,准确称取1.0 g 内容物置于离心管中,并加入1.0 mL 去离子水剧烈混合均匀。15 000 r/min 离心15 min,去上清液。按体积比9∶1 添加25%偏磷酸,置于冰水中孵化3 h,通过气相色谱技术对样品中的挥发性脂肪酸进行检测。
1.7 数据统计与分析
用Excel 2017对数据进行初步统计与处理,再通过SPSS 18.0软件中的One-way Anova分析程序进行单因素方差分析,并用Duncan's法进行多重比较,结果用“平均值±标准差”表示,以P<0.05对差异显著性进行判断。
2 结果
2.1 布拉氏酵母壁多糖对羔羊血液生化指标的影响(见表3)
由表3 所示,总蛋白、球蛋白、尿素氮、谷草转氨酶和碱性磷酸酶组间差异显著(P<0.05)。Ⅱ组的总蛋白含量最低为42.61 g/L,显著低于其他组(P<0.05),Ⅳ组与Ⅴ组的总蛋白含量分别为44.01 g/L 和44.14 g/L,较Ⅰ组分别降低了3.47%和3.18%(P>0.05);Ⅱ组的球蛋白含量最低为23.28 g/L,显著低于其他组(P<0.05),Ⅳ组与Ⅴ组分别为25.33 g/L 和24.19 g/L,较Ⅰ组分别降低了5.10%和9.37%(P>0.05)。Ⅱ组的尿素氮含量最低为6.35 mmol/L,Ⅳ组和Ⅴ组分别为6.77 mmol/L 和6.58 mmol/L,较Ⅰ组分别显著降低18.43%和20.72%(P<0.05)。Ⅱ组的谷草转氨酶含量最低为33.91 U/L,Ⅳ组和Ⅴ组分别为35.56 U/L 和33.26 U/L,较Ⅰ组分别显著降低26.19%和30.97%(P<0.05)。Ⅳ组和Ⅴ组的碱性磷酸酶的含量分别为120.25 U/L 和128.52 U/L,较Ⅰ组分别显著提高10.55%和18.16%(P<0.05)。由此表明,添加0.3%~0.5%布拉氏酵母壁多糖能显著降低羔羊血清中尿素氮和谷草转氨酶的含量(P<0.05),并显著提高碱性磷酸酶的含量(P<0.05),并在一定程度上降低球蛋白、谷氨酰转移酶和乳酸脱氢酶的含量。
2.2 布拉氏酵母壁多糖对羔羊血清中抗氧化性能的影响(见表4)
2.10 nmol/mL,较Ⅰ组分别降低10.57%和7.49%(P>0.05)。由此可知,添加0.3%~0.5%的布拉氏酵母壁多糖不能显著影响羔羊血清中抗氧化酶和丙二醛的含量。与对照组相比(Ⅰ组),添加0.005%庆大霉素在降低丙二醛的同时,谷胱甘肽过氧化物酶、总超氧化物歧化酶的含量也分别下降了2.95%和3.66%。
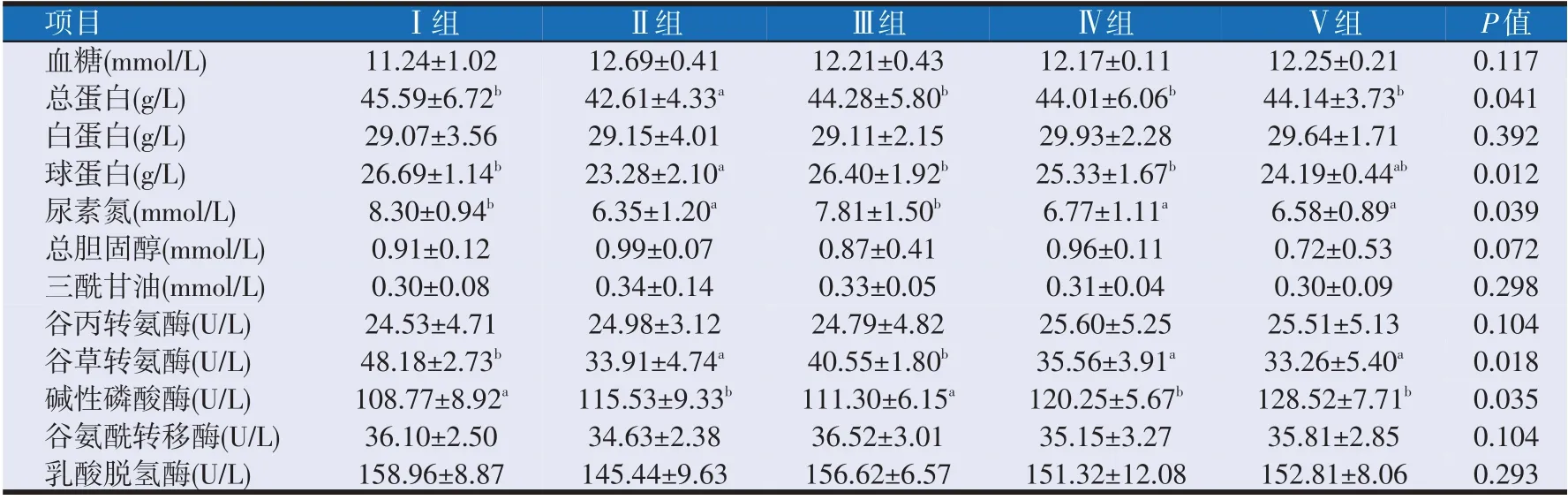
表3 布拉氏酵母壁多糖对早期断奶羔羊血清生化指标的影响

表4 布拉氏酵母壁多糖对早期断奶羔羊血清抗氧化性能的影响
2.3 布拉氏酵母壁多糖对早期断奶羔羊盲肠微生物的影响(见表5)
由表5可知,各组羔羊盲肠中双歧杆菌、乳酸菌、沙门氏菌和产气荚膜梭菌的数量差异显著(P<0.05)。Ⅳ组的双歧杆菌数量最高为6.88 lg CFU/g,显著高于Ⅰ组和Ⅱ组(P<0.05),Ⅳ组和Ⅴ组较Ⅰ组显著提高了9.90%和9.26%(P<0.05);Ⅳ组的乳酸菌数量最高为7.48 lg CFU/g,显著高于Ⅰ组和Ⅱ组(P<0.05),Ⅳ组和Ⅴ组较Ⅰ组显著提高了4.76%和4.06%(P<0.05);Ⅱ组的沙门氏菌数量最低为4.79 lg CFU/g,其次为Ⅳ组5.13 lg CFU/g,Ⅳ组和Ⅴ组较Ⅰ组显著降低了5.87%和4.59%(P<0.05)。Ⅳ组的产气荚膜梭菌数量最低为4.61 CFU/g,显著低于Ⅰ组和Ⅱ组(P<0.05),Ⅳ组和Ⅴ组较Ⅰ组显著降低了8.17%和6.37%(P<0.05)。各组大肠杆菌和总需氧数量的差异不显著(P>0.05),Ⅳ组和Ⅴ组的大肠杆菌数量和总需氧菌数量较Ⅰ组分别降低7.23%、7.96%和2.57%、4.46%(P>0.05)。由此结果推测,布拉氏酵母壁多糖的最佳添加量为0.3%~0.5%。添加0.005%庆大霉素提高了产气荚膜梭菌(P>0.05),在显著降低了沙门氏菌的同时(P<0.05),双歧杆菌也被显著降低(P<0.05),还降低了乳酸菌的数量(P>0.05)。

表5 布拉氏酵母壁多糖对早期断奶羔羊盲肠中微生物的影响(lg CFU/g)
2.4 布拉氏酵母壁多糖对早期断奶羔羊盲肠挥发性脂肪酸含量的影响(见表6)
表6可知,各组羔羊盲肠内容物中的乙酸、丁酸、戊酸和乳酸含量差异显著(P<0.05)。Ⅳ组的乙酸含量最高为56.31 mmol/100 g,显著高于Ⅰ组和Ⅱ组(P<0.05),Ⅳ组和Ⅴ组较Ⅰ组显著提高了8.66%和3.36%(P<0.05);Ⅳ组的丁酸含量最高为15.97 mmol/100 g,显著高于Ⅰ组和Ⅱ组(P<0.05),Ⅳ组和Ⅴ组较Ⅰ组显著提高了18.38%和17.57%(P<0.05);Ⅴ组的戊酸含量最高为1.69 mmol/100 g,较Ⅰ组显著提高了8.33%(P<0.05);Ⅴ组的乳酸含量最高为7.39 mmol/100 g,显著高于Ⅰ组和Ⅱ组(P<0.05),Ⅳ组和Ⅴ组较Ⅰ组显著提高了4.96%和7.88%(P<0.05);添加0.3%和0.5%的布拉氏酵母壁多糖能在一定程度上提高丙酸、异丁酸、异戊酸的含量,各组间差异不显著(P>0.05)。由此结果推测,添加0.3%~0.5%的布拉氏酵母壁多糖能提高断奶羔羊盲肠内挥发性脂肪酸的含量。另外,0.005%庆大霉素除了显著降低盲肠内丁酸的含量以外(P<0.05),对各挥发性脂肪酸水平的影响均不显著(P>0.05)。
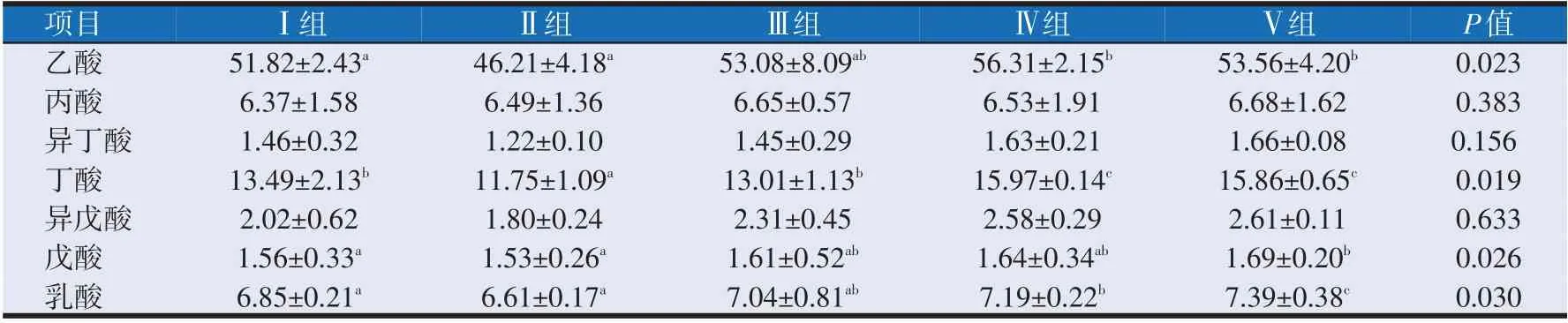
表6 布拉氏酵母壁多糖对早期断奶羔羊盲肠中挥发性脂肪酸含量的影响(mmol/100 g)
3 讨论
3.1 布拉氏酵母壁多糖对早期断奶羔羊血清生化指标的影响
动物血清指标反映了机体整体的代谢水平,也衡量了机体的免疫性能[24]。血清中的蛋白含量体现了蛋白质的代谢水平;白蛋白主要用于维持机体渗透压和养分运输,白蛋白偏低则反映出机体的代谢能力较低;球蛋白主要为特异性免疫球蛋白,其反映机体的免疫能力及炎症情况,若球蛋白的含量偏高,机体则可能发生了感染或炎症[25]。在本试验中,添加了布拉氏酵母壁多糖羔羊血清中的球蛋白比对照组有所降低,而白蛋白有所升高,表明布拉氏酵母壁多糖能在一定程度上降低感染和炎症的程度,同时能提高机体的营养物质运送的能力。尿素氮主要反映体内蛋白质的合成和分解情况,若尿素氮含量位于高水平,就能反映出机体蛋白质的分解速度大于合成速度,对动物的健康以及生产效益产生不利影响[26]。在本次试验中,添加布拉氏酵母壁多糖羔羊血清中的尿素氮显著低于对照组,表明布拉氏酵母壁多糖有利于蛋白制的合成,从而有提高机体的健康状况和生产性能的可能。谷丙转氨酶和谷草转氨酶主要反映肝脏的健康程度,如其指标过高,则反映出羔羊可能处在中毒或炎症的状态中[27]。在本次试验中,添加布拉氏酵母壁多糖羔羊的谷草转氨酶含量显著低于Ⅰ组,谷丙转氨酶虽有升高但其组间差异不显著,表明布拉氏酵母壁多糖能提高羔羊肝脏的健康状况,降低外源抗原及有毒物质对机体的损害。碱性磷酸酶主要对幼龄动物的骨骼生长和甲状腺机能进行判断的指标,其含量维持在较高水平,能对动物的生长和发育创造有利条件[28]。本试验中,布拉氏酵母壁多糖组(Ⅳ组、Ⅴ组)的碱性磷酸酶含量显著高于对照组的含量,表明其能促进羔羊的生长。谷氨酰转移酶和乳酸脱氢酶能反映机体炎症的程度,添加布拉氏酵母壁多糖有降低乳酸脱氢酶和谷氨酰转移酶的趋势,表明布拉氏酵母壁多糖在一定程度上能降低羔羊的炎症反应。
3.2 布拉氏酵母壁多糖对早期断奶羔羊血清中抗氧化能力的影响
机体内谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(T-SOD)和丙二醛(MAD)含量主要反映机体的抗氧化能力。谷胱甘肽过氧化物酶和超氧化物歧化酶能清除过氧化物及自由基,减少其对机体的伤害。丙二醛是体内多不饱和脂肪酸被氧化的产物,以此可以判断机体细胞膜被破坏的程度。在本试验中,虽然各组间的抗氧化能力差异不显著,但添加布拉氏酵母壁多糖能提高羔羊血清中谷胱甘肽过氧化物酶和总超氧化物歧化酶的含量,并降低丙二醛的含量,从而表明布拉氏酵母壁多糖在一定程度上能提高早期断奶羔羊的抗氧化能力。谢明欣等[29]在蒙古绵羊的饲粮中添加0.1%酵母甘露寡糖,结果显示其提高了蒙古绵羊血清中超氧化物歧化酶的活性。张学峰等[30]将酵母培养物通过十二指肠灌入绵羊体内,结果发现其显著提高了绵羊血清中总抗氧化能力和总超氧化物歧化酶的含量。这些结论都与本试验的研究结果相似。而添加了0.005%庆大霉不仅降低了丙二醛的含量,还降低了谷胱甘肽过氧化物酶和总超氧化物歧化酶的水平,对早期断奶羔羊抗氧化能力的提高产生不利影响。
3.3 布拉氏酵母壁多糖对早期断奶羔羊肠道微生物的影响
经大量研究证明,肠道菌群的建立与稳态是动物健康至关重要的因素,对于早期断奶羔羊更是如此[31]。肠道中微生物的数量远远超过其机体细胞数量的总和,其已被确认为机体重要的分泌器官。不同微生物产生的代谢产物能与宿主的生理机能产生互作,更深层次调节动物的消化吸收、营养代谢、机体免疫等功能[32]。众所周知,双歧杆菌和乳酸菌是肠道内的益生菌,其不仅能消耗肠道中的氧气以减少好氧菌的数量,还能产生乳酸等代谢产物,降低肠道内的pH 值,抑制致病菌的生长和繁殖。大肠杆菌、沙门氏菌和产气荚膜梭菌是导致羔羊腹泻的重要致病菌,其在肠道内的数量在一定程度上反映了羔羊肠道的健康水平。本研究结果显示,添加了0.3%~0.5%的布拉氏酵母壁多糖能显著提高盲肠中双歧杆菌和乳酸菌等益生菌的数量,同时显著降低沙门氏菌和产气荚膜梭菌的数量,有助于早期断奶羔羊盲肠内微生态的建立和菌群的平衡。而添加了0.005%庆大霉素除了提高了产气荚膜梭菌以外,降低了早期断奶羔羊盲肠内所有被检测微生物的数量,为羔羊肠道内环境稳态的建立埋下了隐患。Karaman 等[33]发现,酵母甘露聚糖能提高火鸡肠道内双歧杆菌的数量,改变了肠道内菌群结构,降低了大肠杆菌对机体的影响。贺琴等[34]发现以比例为0.3%的酵母壁多糖饲喂仔猪,结果发现仔猪肠道内的双歧杆菌、乳酸杆菌和总菌数提高,大肠杆菌和沙门氏菌数量降低。阎桂玲等[35]发现,啤酒酵母壁多糖能显著提高肉仔鸡盲肠中双歧杆菌的数量,大肠杆菌和沙门氏菌的数量显著下降。这些结论均与本试验结果相同。由于本试验仅对盲肠内有限微生物进行了研究,应通过微生物基因组学的方法进一步探讨布拉氏酵母壁多糖对羔羊肠道内整体菌群结构及丰度的影响。
3.4 布拉氏酵母壁多糖对羔羊肠道挥发性脂肪酸指标的影响
近年来的大量研究证明,肠道微生物的代谢产物与宿主健康有密切联系,挥发性脂肪酸含量的提高能有效改善肠道屏障功能,保护黏膜上皮细胞的完整性,对宿主的营养吸收、免疫调控及营养代谢有着至关重要的作用,特别是丁酸已被认为能为肠道中的淋巴器官提供能量,并对常见致病微生物有较强的抑制作用[36]。本研究结果显示,添加了0.3%~0.5%的布拉氏酵母壁多糖能显著提高羔羊盲肠中乙酸、丁酸和乳酸的含量。而0.005%庆大霉素不仅显著降低盲肠内丁酸的水平,还在一定程度上降低了乙酸、戊酸和乳酸的含量,不利于断奶羔羊肠道内微生态系统的建立。贺琴[37]以比例0.3%的酵母壁多糖饲喂仔猪,结果发现TVFA 含量显著提高。Shanmugasudara 等[38]用毕赤酵母甘露聚糖饲喂肉鸡,提高了肠道内小分子脂肪酸的含量,并被上皮细胞吸收,同时因降低了肠道内pH而抑制了致病菌的生长。这些论均与本试验的结果相同。
4 结论
本试验中,在代乳料中添加0.3%和0.5%的布拉氏酵母壁多糖饲喂早期断奶羔羊:
①显著降低了血清中尿素氮和谷草转氨酶含量,显著提高碱性磷酸酶含量;
②对血清中谷胱甘肽过氧化物酶、总超氧化物歧化酶和丙二醛的影响不显著;
③显著提高了盲肠内容物中双歧杆菌和乳酸菌的数量,显著降低了沙门氏菌和产气荚膜梭菌数量;
④显著提高了盲肠中乙酸、丁酸和乳酸的含量。
