LncRNA OCPAT1通过调控miR-320d/YOD1信号通路促进卵巢癌的发生及发展
2021-01-28黄晔赖蔚菁黄如刘佳华
黄晔 赖蔚菁 黄如 刘佳华
[摘要] 目的 研究lncRNA OCPAT1调控miR-320d/YOD1信号通路在卵巢癌发生发展中的作用及机制。 方法 2019年1月至2020年12月应用TCGA和GTEX数据库筛选,通过qRT-PCR检测确认lncRNA AC007405.3(OCPAT1)在卵巢癌组织和细胞中的表达;在ES-2细胞中敲减OCPAT1,通过实验验证,OCPAT1与miR-320d/YOD1的靶向调控关系。 结果 通过GTEX和TCGA数据库及qRT-PCR检测,确认OCPAT1高表达;敲低OCPAT1后,MTT增殖显示敲减后细胞增殖减低,EdU细胞增殖显示,敲减后处于复制期的细胞减少,流式细胞周期显示敲减后细胞停滞在G0/G1期,流式周期显示敲减后细胞凋亡增加,Transwell migration实验显示,敲减后抑制卵巢癌细胞ES-2的迁移能力,Matrigel invasion 实验显示敲减后抑制卵巢癌细胞ES-2的侵袭能力。双荧光素酶报告基因实验证实,OCPAT1可以靶向作用于miR-320d。 结论 lncRNA OCPAT1可能通过靶向调控miR-320d/YOD1信号通路调控卵巢癌细胞增殖、迁移及侵袭,进而促进卵巢癌的发生及发展。
[关键词] LncRNA OCPAT1;miR-320d/YOD1信号通路;卵巢癌;增殖;迁移;侵袭
[中图分类号] R737.31 [文献标识码] A [文章编号] 1673-9701(2021)33-0041-04
[Abstract] Objective To study the role and mechanism of lncRNA OCPAT1 in regulating the miR-320d/YOD1 signaling pathway in the development and progression of ovarian cancer. Methods From January 2019 to December 2020, the expression of lncRNA AC007405.3 (OCPAT1) in ovarian cancer tissues and cells was confirmed by RT-qPCR using TCGA and GTEX databases screening. OCPAT1 was knocked out in ES-2 cells, and the targeted regulatory relationship between OCPAT1 and miR-320d/YOD1 was verified by experiments. Results High expression of OCPAT1 was confirmed by GTEX and TCGA databases and RT-qPCR detection. After OCPAT1 knockdown, MTT proliferation showed decreased cell proliferation after knockdown. the EdU cell proliferation showed decreased cells in the replication phase after knockdown. flow cytometry cycle showed that cells stagnated in the G0/G1 phase after knockdown; flow cytometry cycle showed increased cell apoptosis after knockdown. The Transwell migration experiment showed that knockout inhibited the migration ability of ovarian cancer cell ES-2, and the Matrigel invasion experiment showed that knockout inhibited the invasion ability of ovarian cancer cell ES-2. Dual luciferase reporter assay confirmed that OCPAT1 could target miR-320d. Conclusion LncRNA OCPAT1 may regulate the proliferation, metastasis and invasion of ovarian cancer cells through the targeted regulation of the mir-320s/YOD1 signaling pathway, thus promoting the occurrence and development of the ovarian cancer.
[Key words] LncRNA OCPAT1; miR-320d/YOD1 signaling pathway; Ovarian cancer; Proliferation; Metastasis; Invasion
卵巢癌是婦科三大恶性肿瘤之一[1],发病率仅次于子宫颈癌和子宫内膜癌,居第3位,死亡率却居女性生殖细胞肿瘤的首位[2]。临床上急需卵巢癌早期的肿瘤标志物用于筛查,有利于为卵巢癌的治疗提供理论依据[3]。长链非编码RNA(lncRNA)对卵巢癌的发生和发展起重要的作用,有望为卵巢癌的治疗提供新思路[4]。研究表明,lncRNA AC007405.3在肿瘤细胞高表达,lncRNA AC007405.3可成为卵巢癌诊断的指标,及早期筛查。本研究将该lncRNA命名为卵巢癌进展相关转录本1(OCPAT1)。荧光原位杂交技术(FISH)实验显示,OCPAT1主要定位在细胞质,目前挑选miR-320d作为OCPAT1潜在的靶向微小RNA(miRNA), 同时miR-320d靶向YOD1。本研究通过体外培养卵巢癌ES-2细胞探讨lncRNA OCPAT1/miR-320d/YOD1轴在卵巢癌发生和发展中的作用,为靶向治疗卵巢癌提供理论依据,现报道如下。
1 材料与方法
1.1 材料来源
卵巢癌细胞株与正常卵巢上皮细胞株IOSE-80均购自中科院上海生科院细胞库。miR-320d mimic、miR-320d抑制物及其各自阴性对照均购自上海吉玛制药技术有限公司;胎牛血清(FBS)购自美国 Invitrogen公司;lncRNA OCPAT1 siRNA 及其阴性对照均购自美国 Dharmacon公司;DMEM培养基购自美国Gibco公司;Transwell小室购自北京明阳科华生物科技有限公司;Matrigel购自上海伟进生物科技有限公司;Lipofectamine2000转染试剂购自赛默飞世尔科技(中国)有限公司;MTT检测试剂盒购自上海东仁化学科技公司;逆转录试剂盒和实时荧光定量聚合酶链反应(Quantitative Real-time PCR, qRT-PCR)试剂盒均购自VAZYME公司;荧光素酶活性检测试剂盒及荧光素酶报告载体均购自美国 Promega 公司。以上研究方案已得到福建省立医院医学伦理委员会审核通过。
1.2方法
1.2.1 筛选确认研究的lncRNA 应用癌症基因组图谱数据库和基因型-组织表达数据库筛选出在正常组织和卵巢癌组织中有差异表达的lncRNA,进行生存分析,确认具有显著差异的前5个lncRNA,检测其在卵巢癌细胞株中的表达,最终选择lncRNA AC007405.3(OCPAT1)。
1.2.2 qRT-PCR 采用Trizol法提取ES-2中的总RNA,取1 μg RNA样本用HiScript Reverse Transcriptase (VAZYME, R101-01/02)进行逆转录以获得cDNA模板;然后使用相应的引物(OCPAT1正向引物5-CAGTGCAATAGTATTGTCAAAGC-3,反向引物5-CACACAGAGGGCTACAAGAG-3;18 S rRNA正向引物5-GGAGTATGGTTGCAAAGCTGA-3,反向引物5-ATCTGTCAATCCTGTCCGTGT-3)和SYBR Green Master Mix(VAZYME,Q111-02)进行qRT-PCR检测,每组设3个复孔。计算公式如下:目的基因ΔΔCt=目的基因ΔCt-内参基因ΔCt。
1.2.3 OCPAT1敲减质粒构建 合成包含靶点序列的shRNA颈环结构的正反向引物(正向引物5-CGTTTAGTAAATG-3 -3,反向引物5-CAGCGAATCCT-CGTCG-3),退火后,使用T4 DNA连接酶,克隆入PLKO.1-TRC-puro慢病毒质粒载体中。
1.2.4 YOD1过表达质粒构建 用设计好的引物(正向引物5-ATGTTTGGCCCCGCTAAAGG-3,反向引物5-CGGTGATGGCGGCAATTTG-3)以cDNA为模板,扩增YOD1基因,连接进pCDH-EF1a-MCS-T2A-puro载体(通过BamHI/EcoRI线性化后)。
1.2.5 MTT增殖实验 将OCPAT1敲减质粒和对照质粒瞬转ES-2细胞,第2天铺于96孔板中,并在贴壁后0 h、24 h、48 h和72 h用MTT试剂染色活细胞约4 h,接着吸去培养上清,加入500 μL DMSO震荡10 min,用分光光度计测定OD490读值。
1.2.6 流式周期实验 70%乙醇固定细胞过夜,清洗后处理细胞,清洗后PBS重悬并用PI染色,流式仪检测。
1.2.7 EdU增殖实验 ES-2细胞瞬转相关质粒,次日铺于96孔板,并根据EdU试剂盒说明书进行实验。
1.2.8 流式凋亡实验 用不含EDTA的胰酶消化细胞,同时也要收集培养基和清洗细胞PBS中的细胞。离心冲洗,100 μL染色缓冲液重悬细胞,加入5 μL Anexin V-FITC和5 μLPI染色液,室温反应10 min,上机。
1.2.9 细胞侵袭和转移实验 Transwell底膜包稀释后,风干后加入无血清培养基。24 h后,细胞用冰甲醇固定20 min,然后用0.2%结晶紫染色20 min,通过显微镜随机挑选视野进行计数,取平均值。
1.2.10 双荧光素酶报告基因实验 ①构建OCPAT1报告基因载体pmirGLO,48 h后收取细胞,进行基因活性检测。②构建YOD1 3UTR的报告基因载体pmirGLO,48 h后收取细胞,要求进行报告基因活性检测。
1.2.11 FISH实验 将ES-2细胞铺在无菌的盖玻片上培养,染完DAPI后在荧光显微镜下观察并拍照。
1.2.12 Western blot检测各组蛋白表达 提取ES-2细胞总蛋白,采用BCA法测定蛋白浓度,GAPDH为内参照,计算灰度值比值,作為其蛋白相对表达量。
1.3统计学方法
应用SPSS 22.0统计软件分析,GraphPad Prism 5.01软件作图。计量资料以(x±s)表示,组间比较采用独立样本t检验;P<0.05为差异有统计学意义。
2 结果
2.1 研究OCPAT1的差异表达
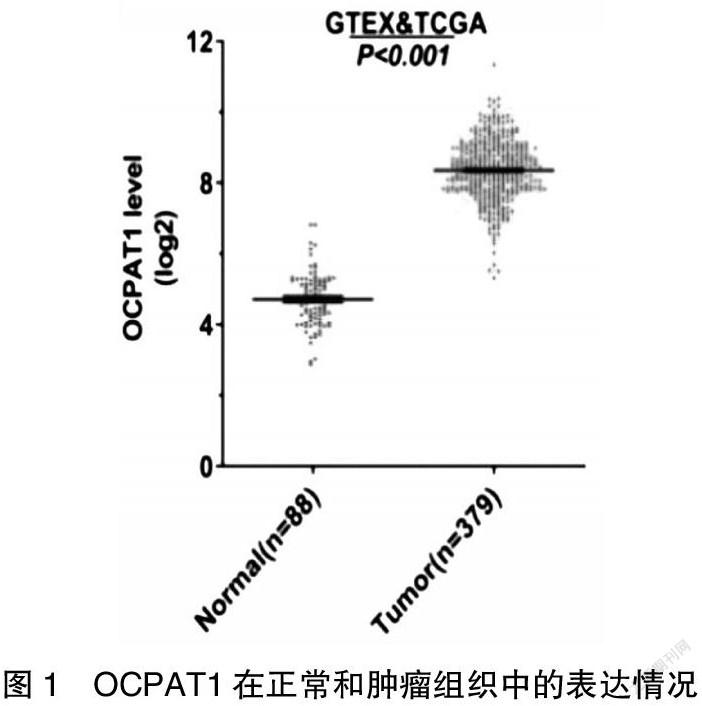
①通过GTEX和TCGA数据库,比对正常组织和肿瘤组织中OCPAT1的表达量发现,OCPAT1在肿瘤组织中高表达(图1)。②通过RT-qPCR,检测OCPAT1在正常细胞和肿瘤细胞中的表达量,结果显示OCPAT1在肿瘤细胞中显著高表达。
2.2 敲减OCPAT1,研究OCPAT1对卵巢癌细胞功能的影响
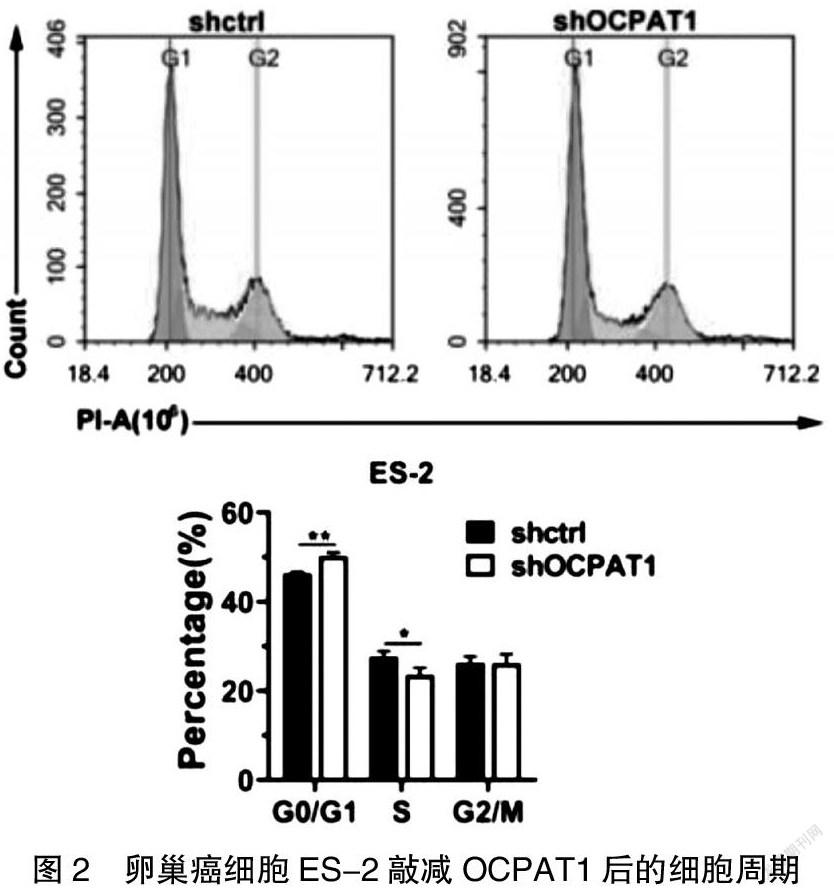
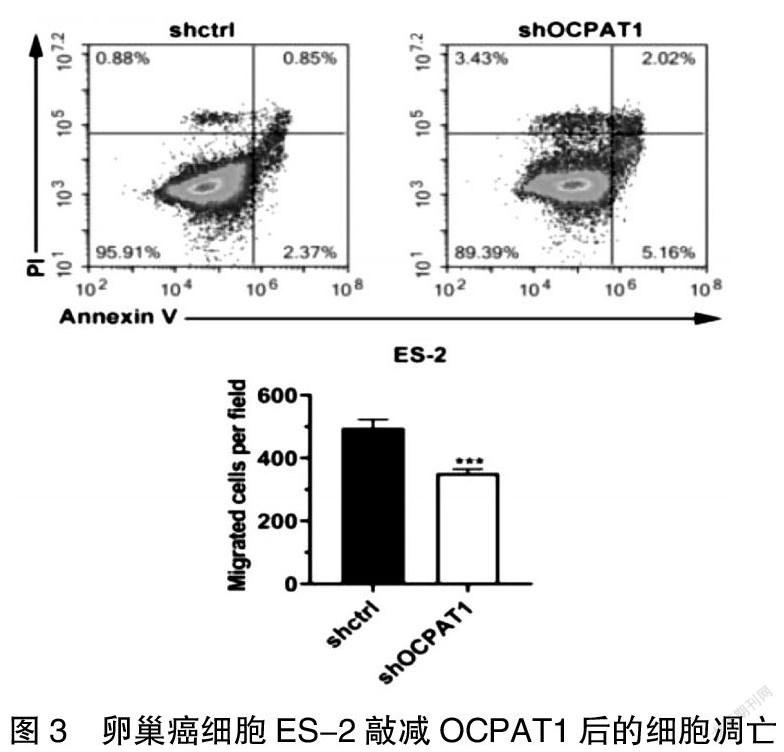
OCPAT1敲除后,ES-2细胞的细胞增殖降低,细胞增殖实验证实敲除ES-2细胞的OCPAT1,细胞增殖降低(封三图4)。通过实验检测在G0/G1期、S期相对减少(图2)。同样的,检测得知敲减OCPAT1后,细胞凋亡增多(图3)。采用Transwell migration实验和Matrigel invasion实验,两个实验结果均显示,敲除OCPAT1后,会显著抑制卵巢癌细胞ES-2的迁移和侵袭能力(P<0.001)。
2.3 检测OCPAT1在卵巢癌细胞中的定位
采用FISH实验结果显示OCPAT1主要定位在细胞质。
2.4 验证OCPAT1靶向miR-320d
①敲减OCPAT1,检测miR-320d在ES-2细胞中的表达量,结果显示升高。②将野生型和突变型OCPAT1分别克隆于萤火虫荧光素酶基因上游,双荧再分别与miR-320d或miRNA-ctrl同时瞬转ES-2细胞,降解下游luciferase,荧光读值降低,其他组不变。
2.5 验证miR-320d靶向YOD1
①ES-2细胞过表达miR-320d,qPCR和WB检测YOD1表达量,结果显示降低。②将YOD1 3UTR克隆于萤火虫荧光素酶基因上游,与miR-320d或miRNA-ctrl同时瞬转ES-2细胞,抑制下游luciferase的转录,荧光读值降低,对照组不变。
2.6 进一步验证OCPAT1/miR-320d/YOD1通路
①敲减OCPAT1,检测YOD1在ES-2细胞中的表达量,结果显示降低。②敲减OCPAT1,同时过表达YOD1,显示过表达YOD1逆转了由于OCPAT1敲减引起的细胞功能改变。
3讨论
卵巢位于女性盆腔,属于腹膜后位器官,目前缺乏有效的筛查手段,所以良性或早期恶性卵巢肿瘤一般较难发现,使得近75%的患者发现即为晚期[5]。目前针对卵巢癌的治疗以手术及以铂类为基础的化疗为主,尽管手术技能与化疗方案不断改进,但卵巢癌的5年生存率仍提升缓慢[6]。随着对卵巢癌标志物研究的深入、影像学诊断方法的进步及蛋白质组学技术的应用等,卵巢癌的诊断水平不断提高,但仍未能满足临床的需要,目前仅25%的卵巢癌患者能早期发现。由于目前尚无高敏感度和特异度的血清肿瘤标志物, 故倾向于多种血清肿瘤标志物联合检测[7-8]。
人类基因组约有超30亿个DNA碱基对,其中含有2.0万~2.5万个蛋白质编码基因,这些蛋白质编码基因只占据不到2%的基因组序列,剩余的近99% DNA均位于非编码区,且基因组70%~90%转录成非编码RNA[9]。参与基因调控的非编码RNA主要分为两类:短片段非编码RNA(siRNA、microRNA、piRNA)和长片段非编码RNA(lncRNA)。研究表明,lncRNA在生命活动中具有调节转录、转录后加工、蛋白质翻译等多种作用,同时与多种疾病的发生发展有关[10]。
近年来,越来越多的研究表明,lncRNA对卵巢癌的发生和发展起重要的作用。如lncRNA EWSAT通过靶向miR-330-5p,促进卵巢癌细胞的增殖,加快癌症的发展[11];lncRNA LINC00319可通过miR-423-5p/NACC1通路促进卵巢癌细胞增殖、迁移和侵袭[12];lncRNA NEAT1可以提高卵巢癌细胞对紫杉醇的耐药性[13];另外,lncRNA PTAR可以调节ZEB1的表达,亦促进卵巢癌细胞的上皮间质转化,从而提高卵巢癌细胞的转移[14]。
MicroRNA(miRNA)是一类内生的、长度为20~24个核苷酸的小RNA,其在细胞内具有多种重要的调节作用[15]。每个miRNA可以有多个靶基因,而几个miRNA也可以调节同一个基因。关于lncRNA与miRNA在卵巢癌发生及发展过程中的具体作用研究较少,因此探讨lncRNA与miRNA的相互作用在卵巢癌发生、侵袭和转移的过程中发挥的作用,有望为卵巢癌的治疗提供新思路[16]。
YOD1作为Otubain去泛素化酶家族重要成员之一,被报道与多种疾病密切相关,包括肿瘤和神经系统疾病等,提示其具有非常重要的生物学功能。YOD1蛋白可以通过调控LATS的E3连接酶ITCH的泛素化水平调控hippo信号通路,被认为是治疗肝癌的潜在靶标。并且YOD1蛋白与宫颈癌、神经退行性疾病、抗病毒免疫应答之间均有相关性报道。这些研究均提示YOD1蛋白对相关蛋白的泛素化水平调控参与到细胞重要的生命活动中,但目前YOD1基因与卵巢癌发生发展之间的关系尚没有文献报道,有待进一步研究。
本研究结果显示,lncRNA OCPAT1可能在卵巢癌的发生过程中发挥癌基因作用。lncRNA OCPAT1可能主要通过增强ES-2细胞增殖活性、迁移及侵袭能力进而参与卵巢癌发生及发展过程。应用starBase网站预测出 lncRNA OCPAT1可互补结合miR-320d。为验证lncRNA OCPAT1靶向调控miR-320d表达进而促進卵巢癌发生发展,本研究共同抑制lncRNA OCPAT1、miR-320d表达观察细胞活性、迁移及侵袭变化,结果说明lncRNA OCPAT1可直接靶向调控miR-320d/YOD1表达,促进ES-2细胞增殖、迁移及侵袭过程。
综上所述,lncRNA OCPAT1在卵巢癌组织及细胞中呈高表达,且与肿瘤发生及恶性化进展有关,敲减ES-2细胞中OCPAT1表达靶向miR-320d/YOD1可抑制细胞增殖及细胞侵袭力,但具体作用机制尚需进一步开展相关研究以明确。
[参考文献]
[1] 黄红丽,李静,宋玉,等.ΜiR-202靶向调节EGFR介导的PI3K/AKT信号通路在紫杉醇治疗卵巢癌中的机制研究[J].肿瘤学杂志,2020,26(9):803-807.
[2] 黎磯,梁欢欢,邓敏.多西紫杉醇诱导卵巢癌细胞凋亡及对PI3K/AKT信号通路的影响[J].转化医学杂志,2020,9(5):287-290.
[3] 李响,赵彤,吴忠,等.STAT3信号通路抑制剂AG490协同TCF21促进卵巢癌细胞凋亡的实验研究[J].现代肿瘤医学,2020,28(11):1851-1855.
[4] 李晗宇,陈飞.长链非编码RNA DRAIC调控miR-181通过STAT信号通路对卵巢癌迁移和侵袭的影响[J].转化医学杂志,2020,9(2):70-74.
[5] 常旺燕,李爱明,窦丽,等.TRIM21通过Wnt/β-catenin信号通路调控卵巢癌细胞增殖及耐药[J].中国肿瘤生物治疗杂志,2020,27(7):749-756.
[6] 田文秀,王晶,徐丹,等.miR-141靶向调控Keap-Nrf2/HO-1信号通路对卵巢癌发生发展的影响[J].临床和实验医学杂志,2020,19(11):1183-1188.
[7] 熊焰,梁承蓉,邵安娜.RIPK 4通过调控NF-КB参与TNFα信号通路从而促进卵巢癌细胞增殖和迁移[J].中国计划生育和妇产科,2020,12(8):62-66,70.
[8] 王秋宇,朱军义,邓巧子.MiRNA-92a靶向PTEN通过PI3K/AKT信号通路促进卵巢癌细胞转移[J].临床与病理杂志,2020,40(7):1658-1667.
[9] 焦晓路,何秀萍.PI3K/AKT及FAS/FASL信号通路在卵巢癌中作用研究进展[J].中国生育健康杂志,2020,31(6):596-599.
[10] 李根林,刘杰,谢晶,等.白藜芦醇通过调控IL-6/JAK2/STAT3信号通路对卵巢癌SKOV-3细胞增殖、凋亡、迁移和侵袭的影响[J].安徽医科大学学报,2020,55(5):706-711.
[11] 周倩,郝烁月,陈凤,等.血清lncRNA EWSAT1和SPRY4-IT1水平检测对卵巢癌的诊断及预后预测价值分析[J].河北医药,2020,42(16):2459-2462.
[12] 李国英,阿孜亚,张文宇,等.血清肿瘤标志物检测在卵巢癌诊断中的临床意义[J].中国现代医生,2019,57(3):112-114.
[13] Du W,Feng Z,Sun Q. LncRNA LINC00319 accelerates ovarian cancer progression through miR-423-5p/NACC1 pathway[J].Biochem Biophys Res Commun,2018,507:198-202.
[14] An J,Lv W,Zhang Y. LncRNA NEAT1 contributes to paclitaxel resistance of ovarian cancer cells by regulating ZEB1 expression via miR-194[J]. Onco Targets Ther,2017,10:5377-5390.
[15] Paraskevopoulou MD,Hatzigeorgiou AG. Analyzing miRNA-LncRNA interactions[J]. Methods Mol Biol,2016,14(2):271-286.
[16] Beermann J,Piccoli MT,Viereck J,et al. Non-coding RNAs in development and disease:Background,mechanisms,and therapeutic approaches[J]. Physiol Rev,2016,96(4):1297-1325.
(收稿日期:2021-07-26)
