后交通动脉瘤破裂致更高出血程度的相关因素分析
2021-01-28汪新宇谢满意李中林徐州医科大学附属医院神经外科江苏徐州221000
王 铮,丁 飞,汪新宇,王 强,谢满意,华 磊,李中林 (徐州医科大学附属医院神经外科,江苏 徐州 221000)
后交通动脉瘤(posterior communicating artery aneurysm,PCoAA)是常见的颅内动脉瘤之一[1],因其破裂率高且破裂后的致死、致残率极高,即使送治及时幸存者也会有不同程度的神经功能障碍、偏瘫、失语、昏迷,甚至出现植物存活状态[2]。脑血管痉挛是动脉瘤破裂后常见且与预后关系密切的并发症之一,先前的研究表明脑血管痉挛与动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)的严重程度紧密相关[3]。虽然近年来治疗颅内动脉瘤的手术技术有了显著的提高,血管内治疗也得到了较为广泛的推广,但aSAH患者的预后仍不容乐观。因此寻找有效评估aSAH严重程度的相关指标仍是目前临床上的一个重要方向。改良Fisher分级主要反映了CT表现上积血的厚度及范围,可用于预测迟发性脑血管痉挛和迟发性脑缺血[5],与Hunt-Hess分级、WFNS分级互为正线性相关,均是临床上评估aSAH严重程度的有效方法。本研究根据PCoAA已破裂患者入院时头颅CT的不同表现进行分组,通过比较临床资料及动脉瘤的形态学特点,分析PCoAA破裂后出现更高出血程度的影响因素,为临床上评估患者预后风险、及早干预提供参考。
1 资料与方法
1.1 临床资料
回顾性分析徐州医科大学附属医院2015年1月至2019年12月收治的162例PCoAA破裂患者的临床资料,其中男37例,女125例,年龄27~80岁,平均(60.4±10.9)岁。纳入标准:经头颅CT确诊为蛛网膜下腔出血;经头颅CTA或DSA确诊为PCoAA;若为颅内多发动脉瘤,经临床确定PCoAA为责任动脉瘤。排除标准:颅内多发PCoAA未能确定责任动脉瘤;梭形PCoAA;头颅CTA图像质量较差,无法进行后处理或参数测量;由外伤或感染所致的动脉瘤;合并烟雾病、脑血管畸形的动脉瘤。
1.2 分组标准
根据患者入院时头颅CT表现,采用改良Fisher分级法(modified Fisher scale,mFS)[4-5]进行分级:0级,无出血表现;1级,蛛网膜下腔出血<1 mm;2级,蛛网膜下腔出血<1 mm,且合并脑室出血;3级,蛛网膜下腔出血≥1 mm;4级,蛛网膜下腔出血≥1 mm,且合并脑室出血。将3~4级患者纳入高mFS组,0~2级患者纳入低mFS组。
1.3 观察指标
选取可能影响PCoAA破裂后出现更高出血程度的指标作为研究参数,相关指标如下:年龄(以65岁为界);性别;高血压病史;入院时血压(即收缩压、舒张压);是否合并颅内动脉粥样硬化;入院时血清镁含量;动脉瘤的形态特征,包括动脉瘤大小、瘤顶指向、瘤颈宽度、瘤高/瘤颈(aspect ratio,AR)、是否合并子囊、是否合并胚胎型大脑后动脉(fetal-type posterior cerebral artery,FPCA)。
1.4 统计学处理

2 结果
2.1 单因素分析
经单因素分析表明,年龄越大、入院时舒张压越高、入院时血清镁含量越低,患者入院时CT表现出高改良Fisher分级的概率越大。表明患者年龄、入院时舒张压、入院时血清镁含量是具有统计学意义的影响因素(P<0.05),而其他因素对其出血程度的影响均无统计学意义(P>0.05),见表1。
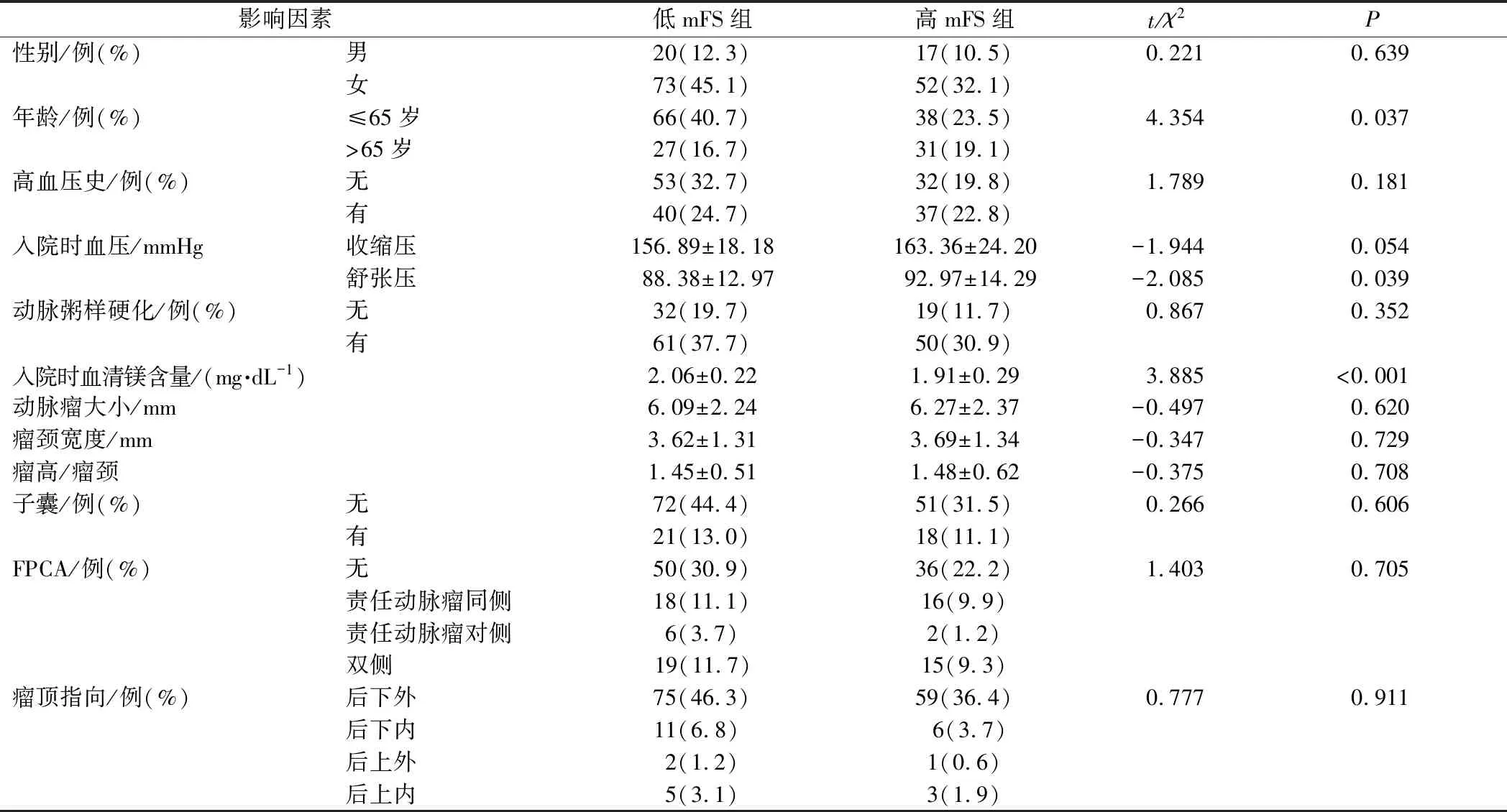
表1 患者出血程度的单因素分析结果
2.2 多因素Logistic回归分析
多因素Logistic回归分析结果表明,患者年龄、入院时血清镁含量与PCoAA破裂后出现高改良Fisher分级存在显著独立相关性,见表2。
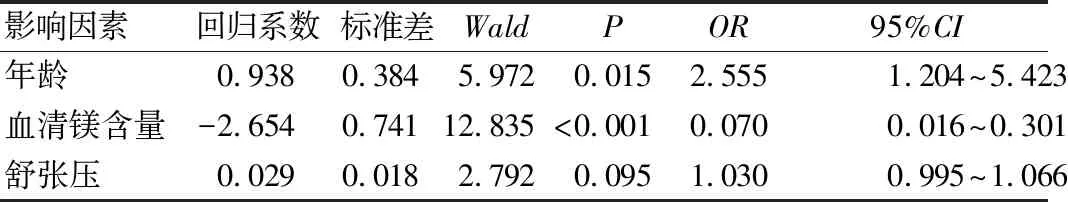
表2 多因素Logistic回归分析结果
3 讨论
颅内动脉瘤破裂是导致蛛网膜下腔出血的主要原因,患者的临床预后往往取决于多种因素,包括急性出血的严重程度、患者的初始状态、是否存在早期再出血、是否存在脑血管痉挛以及迟发性脑缺血等。其中脑血管痉挛发生在20%~40%的患者中,直接关系到患者的生存和预后。据国外资料显示,PCoAA约占所有颅内动脉瘤的25%,仅次于前交通动脉瘤,但在国内资料统计中,PCoAA的发生率占第一位,且极易发生破裂出血[6-7]。因此,本研究通过收集和分析破裂PCoAA患者的临床资料及动脉瘤形态学特点,探寻与PCoAA破裂后更高出血程度相关的危险因素。
本研究显示PCoAA破裂的患者女性比例明显高于男性(3.4∶1),与国内外研究得出的结论一致[8-9],这可能与女性年龄增加或绝经后雌激素水平下降有关。但本研究中性别与PCoAA破裂后更高的改良Fisher分级并无明显相关性。年龄在动脉瘤的研究进程中一直是临床关注的因素,目前普遍认为年龄越大,动脉瘤的破裂率越高。Jabbarli等[10]在一项系统回顾性和荟萃分析中对年龄进行了评估,结果显示高龄是颅内动脉瘤形成的危险因素,这可能与老年人群高血压及血管弹性和顺应性降低等因素有关。有研究指出,年龄越大的患者更有可能出现脑萎缩和较大的脑脊液池[12],可能会通过至少两种机制导致更多的蛛网膜下腔出血。首先,从动脉瘤流出的血液会扩散到邻近较大的蛛网膜下腔,这可能会导致动脉瘤破裂后CT上表现出更广泛的出血。其次,蛛网膜和动脉瘤附近其他组织的压力或张力被认为是阻止动脉瘤出血的重要因素,高龄患者这类压力或张力较低,从而导致更多的蛛网膜下腔出血。在Jabbarli等[11]的研究中,根据625例aSAH患者入院时头颅CT表现上初始Graeb评分来评估脑室出血的严重程度,发现年龄增加是脑室出血的独立危险因素。在本研究中,高mFS组患者的平均年龄大于低mFS组,亦说明高龄(>65岁)是影响PCoAA破裂后更高改良Fisher分级的独立危险因素。因此,对于临床上高龄的PCoAA患者应尽早进行干预,以预防不良事件发生。
长期以来,高血压一直被认为是颅内动脉瘤破裂的危险因素。但本研究发现2组患者在高血压病史上的差异并没有统计学意义,而其中入院时舒张压较高是造成PCoAA破裂后更高改良Fisher分级的一个重要因素。Jabbarli等[13]研究表明高血压是颅内动脉瘤破裂后出现颅内血肿的危险因素,这与长期高血压导致的血管壁改变、炎症反应和肾素—血管紧张素系统的激活有关[14]。当动脉瘤破裂时,囊内形成较大的缺口,加上出血后血管收缩能力下降,容易形成更大的血肿,所以在动脉瘤破裂早期,应适当控制患者血压水平以减少动脉瘤再次破裂和再出血的风险。在外科手术夹闭或血管内治疗后,需要适当升高患者血压以满足脑灌注,避免脑灌注不足引起血管痉挛和低灌注等并发症的发生。
以往动脉瘤大小通常被认为与动脉瘤破裂的风险有关[15]。但是动脉瘤大小与破裂后aSAH严重程度之间的关系并没有明确结论。在Jabbarli等[11]的研究中,动脉瘤>12 mm是颅内血肿发生和体积增大的危险因素。Russell等[16]通过对aSAH患者入院CT扫描上的蛛网膜下腔出血体积以半定量的方式从0~30进行评分,对动脉瘤大小进行分组(1~5 mm、6~10 mm、11~15 mm、>15 mm),结果显示动脉瘤的大小与破裂后蛛网膜下腔出血量呈负相关。本研究将动脉瘤大小作为连续变量进行分析,并未得出动脉瘤大小与更高出血程度之间存在显著的关系。
血清镁离子通过促进组织因子激活因子诱导的凝血途径、增强Ⅸ因子的凝血活性从而促进血小板聚集在凝血中发挥重要作用,并在肝硬化患者和创伤相关凝血障碍模型中显示出止血特性。关于血清中的镁能否对蛛网膜下腔出血患者起到止血作用,有研究指出在自发性脑出血患者中,血清镁含量越低,血肿体积越大,提示镁在出血性卒中中发挥着潜在的止血作用[17]。在本研究的PCoAA破裂患者中,入院时较低的血清镁含量与较高程度的出血独立相关,血清镁含量是动脉瘤破裂后更高出血程度的独立保护因素,这与Liotta等[17]的研究结果一致。在Liotta等[18]的研究中,血清镁含量每降低0.25 mg/dL,更严重的蛛网膜下腔出血概率则增加37%。更有研究指出,在诊断未破裂的颅内动脉瘤时,低血清镁含量与随后动脉瘤破裂的风险增加之间也存在着关联[19]。虽然一些临床研究和实验模型中已证实镁在治疗蛛网膜下腔出血和保护神经方面有效果[20],但是也有研究表明镁在治疗aSAH时似乎不能改善临床结局或减少迟发性脑缺血的发生[21-22]。因此镁输注在aSAH的治疗预后中到底发挥怎样的作用以及如何发挥作用,未来还需要更多研究来证实。
综上所述,本研究表明PCoAA患者年龄和入院时血清镁含量与动脉瘤破裂后出现更高出血程度密切相关,院前血压也需要得到临床的重视。因此临床上在处理未破裂的PCoAA患者时,要密切关注患者年龄、血压和血清镁含量的变化,及时干预,尽量避免动脉瘤破裂后出现更高出血程度导致的不良预后。