原料对盐渍泡菜细菌类群及基因功能的影响
2021-01-28向凡舒龙旭霞赵楠侯强川郭壮
向凡舒,龙旭霞,赵楠,侯强川,郭壮*
(1.湖北文理学院 食品科学技术学院 鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.四川省农业科学院农产品加工研究所,四川 成都 610066)
作为一类传统发酵蔬菜制品,泡菜可分为泡渍泡菜和盐渍泡菜两大类[1]。较之泡渍泡菜,盐渍泡菜无需泡制发酵,制作工艺包括盐渍、清洗整形、脱盐脱水和配料盐制等环节[2]。泡菜的制作属厌氧自然发酵,其中蕴含的微生物类群对泡菜风味品质的形成具有重要的作用[3],有研究指出地理环境[4]、原料[5]、制作方式[6]、发酵温度[7]和盐浓度[8]等因素均对泡菜微生物类群的形成具有明显的影响。泡菜中的微生物类群主要来源于蔬菜原料表面的乳酸菌[3],而制作泡菜的原料通常包括萝卜、白菜、豇豆、青椒和莴苣等各类新鲜蔬菜,但由于品种、季节和产地等因素的影响,不同原料表面携带的乳酸菌类群可能存在差异[2]。Liang H等[5]研究表明白菜泡菜盐水中的优势细菌为乳酸杆菌,而混合蔬菜盐水中的优势细菌为乳酸杆菌和魏斯氏菌。明确泡菜中微生物类群构成是控制和提升泡菜品质的关键,因而探讨发酵方式和原料等因素对泡菜中微生物类群的影响,对提升泡菜品质和食用安全性具有积极的意义。
位于恩施土家族苗族自治州的宣恩县有以沙葱(Allium mongolicum Regel)和切丝的青椒(Capsicum annuum var.grossum)为原料进行盐渍泡菜制作的习俗。当地农户制作发酵沙葱的方法如下:将洗净的沙葱放入浓盐水中漂洗两遍后沥干,加入食盐和陈醋置于坛中密封发酵10 d左右即可制得发酵沙葱,除无需使用浓盐水漂洗外,发酵青椒的做法与沙葱相同。由此可见,相同的地理环境及相似的制作工艺,为探讨原料这一因素对盐渍泡菜细菌类群的影响提供参考。
本研究采用MiSeq高通量测序技术对宣恩县发酵沙葱和发酵青椒样品的细菌多样性进行解析,同时对其细菌基因功能进行预测,进而探讨原料对盐渍泡菜细菌类群及基因功能的影响,以期为后续相关盐渍泡菜制品生产工艺的改良提供理论指导,同时为发酵沙葱等特色发酵蔬菜制品微生物多样性的理论研究提供数据支持。
1 材料与方法
1.1 材料与设备
发酵沙葱和青椒样品:市售;QIAGEN DNeasy mericon Food Kit DNA基因组提取试剂盒:德国QIAGEN公司;引物338F/806R:天一辉远(武汉)生物科技有限公司;10倍缓冲液、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)和脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(5 U/μL):北京全式金生物技术有限公司。
Veriti FAST梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国 ABI公司;R920 型机架式服务器:美国DELL公司;164-5050基础电泳仪:美国BIO-RAD公司;UVPCDS8000凝胶成像分析系统:美国Protein Simple公司;Illumina MiSeq PE250高通量测序平台:美国Illumina公司。
1.2 试验方法
1.2.1 样品采集
纳入本研究的样品均于2018年12月下旬采集自湖北省恩施土家族苗族自治州宣恩县三桥菜市场。发酵沙葱编号为YSC1、YSC2和YSC3,发酵青椒编号为QJ1、QJ2和QJ3。所有样品均在当地制作和销售,样品采集时其制作时间约在20 d~30 d。
1.2.2 基因组DNA提取、PCR扩增和高通量测序
每个样品各取2 g,使用试剂盒提取微生物的总DNA,并参照文献[9]中的方法进行细菌16S rRNA V3-V4区PCR扩增,PCR产物寄往上海美吉生物医药科技有限公司测序。
1.2.3 生物信息学分析
参照文献[9]中的方法对下机序列进行质控后,将合格序列上传至QIIME(V1.7.0)分析平台进行微生物类群分析,依次进行序列对齐、分类操作单元(operational taxonomic units,OTU)划分[10]、序列比对[11]、系统发育树构建[12]、α多样性和β多样性分析[13]。
将同一类盐渍泡菜中平均相对含量>1.0%的门、属和OTU,定义为优势门、属和OTU;若每个样品都含有某一OTU,则将该OTU定义为核心OTU;若某一OTU在3个发酵沙葱样品中均存在,而在3个发酵青椒样品中均不存在,则将其定义为发酵沙葱样品的独特 OTU,反之亦然[14]。
1.2.4 基因功能预测
使用phylogenetic investigation of communities by reconstruction of unobserved states(PICRUSt)软件预测盐渍泡菜中细菌的基因功能[15],并参照蛋白质直系同源簇数据库(clusters of orthologous groups of proteins,COG)进行注释[16]。
1.3 数据处理
使用曼惠尼(Mann-Whitney)检验对各α多样性指标和各基因功能类别指标进行显著性分析;使用多元方差分析(multivariate analysis of variance,MANOVA)对细菌群落结构和基因功能的整体差异性进行分析;使用非加权配对算术平均法(unweighted pair group method using arithmetic average,UPGMA)聚类对两类盐渍泡菜的β多样性进行分析。采用R语言实现数据的可视化。
2 结果与分析
2.1 测序情况和α多样性分析
本研究采用MiSeq高通量测序技术对发酵沙葱和发酵青椒的细菌类群结构进行解析,6个样品测序共得到了225 242条序列,每个样品平均测序深度为37 540条,其中有5条序列经对齐后比对失败,剩余225 237条序列依据97%相似性划分了OTU,共得到了10 213个OTU,每个样品平均含有1 702个OTU,其中发酵沙葱中共有7 689个OTU,发酵青椒中共有6 763个OTU。所有样品的测序情况和各分类学地位数量见表1。

表1 样品测序结果统计Table 1 Sequencing results of samples
由表1可知,对OTU中代表性序列进行同源性比对,将所有序列鉴定为26个门、64个纲、105个目、204个科和444个属,不能鉴定到门和属的序列数分别占总序列的0.18%和11.96%。经Mann-Whitney检验发现,发酵沙葱超1指数和香农指数均显著偏高(P<0.05),因而其细菌的丰度和多样性均高于发酵青椒。制作发酵青椒所使用的辣椒品种为二荆条,其辣度在5 000~15 000史高维尔指标(scoville heat units,SHU),其中含有的辣椒素和辣椒碱等活性成分具有一定的抑菌作用,这可能是导致其细菌丰度和多样性低的主要原因[17]。Jeong等[18]的研究亦表明,在泡菜中添加辣椒粉会影响泡菜在发酵初期微生物的演替和代谢产物的产生,从而导致泡菜发酵过程减慢。
2.2 β多样性分析
本研究进一步采用基于UniFrac距离的加权和非加权UPGMA对两类盐渍泡菜菌群差异性进行了分析见图1。
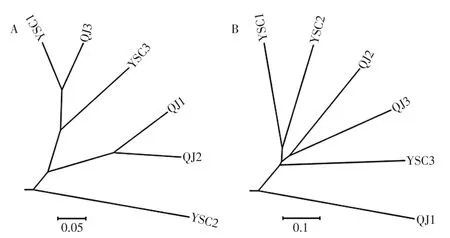
图1 基于OTU水平加权和非加权UniFrac距离的UPGMAFig.1 UPGMA based on weighted and unweighted UniFrac distance at OTU lever
由图1A可知,除QJ1和QJ2形成一个聚类外,其他同类样品并未呈现出明显的聚类趋势,而由图1B可知,QJ2和QJ3形成一个聚类,YSC1和YSC2形成一个聚类,因而基于非加权分析的同一类样品间聚类趋势要明显于加权分析。较之UPGMA,基于UniFrac距离的UPGMA考虑了不同物种在进化谱系中的遗传距离[19],同时在此基础上进行的加权分析还进一步考虑了OTU中序列丰度,而非加权分析仅考虑OTU中序列的有和无,有即为1,无则为0[20]。基于OTU相对含量矩阵,本研究进一步使用MANOVA对两类盐渍泡菜微生物群落结构的差异性进行了分析,结果显示差异显著(P<0.05)。由此可见,虽然在聚类图中存在交叠现象,但两类盐渍泡菜的微生物群落结构差异显著。
2.3 基于门、属和OTU水平的相对含量比较
发酵沙葱(A)和发酵青椒(B)中优势菌门相对含量如图2所示。
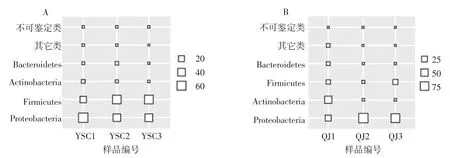
图2 发酵沙葱和发酵青椒中优势细菌门相对含量Fig.2 Relative abundance of dominant bacterial phyla in fermented Allium mongolicum Regel and Capsicum annuum var.grossum
由图2可知,发酵沙葱中的优势细菌门为Proteobacteria(变形菌门,49.92%)、Firmicutes(硬壁菌门,45.77%)、Actinobacteria(放线菌门,2.18%) 和 Bacteroidetes(拟杆菌门,1.44%);发酵青椒中的优势细菌门为 Proteobacteria(68.70%)、Actinobacteria(17.05%)、Firmicutes(10.08%)和 Bacteroidetes(2.30%)。经Mann-Whitney检验发现,发酵沙葱中Firmicutes的相对含量显著偏高(P<0.05)。
发酵沙葱(A)和发酵青椒(B)中优势细菌属的相对含量如图3所示。
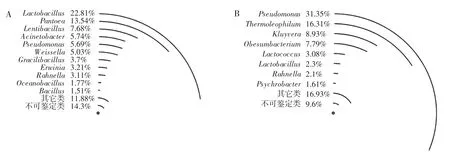
图3 发酵沙葱和青椒中优势细菌属相对含量Fig.3 Relative abundance of dominant bacterial genera in fermented Allium mongolicum Regel and Capsicum annuum var.grossum
由图3A可知,发酵沙葱中有11个优势细菌属,分别为隶属于Firmicutes的Lactobacillus(乳酸杆菌属,22.8%)、Lentibacillus(慢生芽胞杆菌属,7.68%)、Weissella(魏斯氏菌属,5.03%)、Gracilibacillus(糖球菌属,3.70%)、Oceanobacillus(海洋杆菌属,1.78%)和Bacillus(芽孢杆菌属,1.51%),隶属于 Proteobacteria的Pantoea(泛菌属,13.54%)、Acinetobacter(不动菌属,5.74%)、Pseudomonas(假单胞菌属,5.70%)、Erwinia(欧文氏菌属,3.21%)和 Rahnella(拉恩氏菌属,3.11%);由图3B可知,发酵青椒中有8个优势细菌属,分别为隶属于Proteobacteria的Pseudomonas(假单胞菌属,31.35%)、Obesumbacterium(肥杆菌属,7.70%)、Rouxiella(2.10%)和 Psychrobacter(嗜冷杆菌属,1.61%),隶属于Actinobacteria的Thermoleophilum(栖热嗜油菌属,16.31%)和 Kluyvera(克吕沃尔氏菌属,8.93%),隶属于Firmicutes的Lactococcus(乳球菌属,3.08%)和Lactobacillus(乳杆菌属,2.30%)。经 Mann-Whitney检验发现,发酵沙葱中 Lactobacillus、Pantoea、Lentibacillus和Rahnella的相对含量显著偏高(P<0.05)。沙葱为百合科葱属植物,有研究表明Pantoea allii可导致与沙葱同一属的洋葱发生枯萎病[21],因而发酵沙葱中存在Pantoea的原因可能在于制作过程中使用了患枯萎病的原料。由此可见,两类盐渍泡菜细菌类群在属水平上存在较大的差异。
发酵沙葱中存在68个特殊OTU,累计平均含量为8.40%,其中24个OTU隶属于Pantoea,累计含量达5.54%;4个OTU隶属于Pseudomonas,累计含量达0.025%;3个 OTU隶属于 Rahnella,累计含量达0.045%;而其他OTU均不可鉴定到属水平,且平均相对含量均低于0.01%。发酵青椒中存在2个特殊OTU,分别被鉴定为Lactobacillus和Bacteroides,平均相对含量分别为0.007%和0.03%。由此可见,两类盐渍泡菜在含量较低的OTU上存在一定的差异。
2.4 核心细菌类群的研究
在对不同样品中独特OTU进行甄别的基础上,进一步对核心OTU进行了解析。共发现35个核心OTU,累计平均相对含量为17.23%,其中平均相对含量>1.0%的如图4所示。
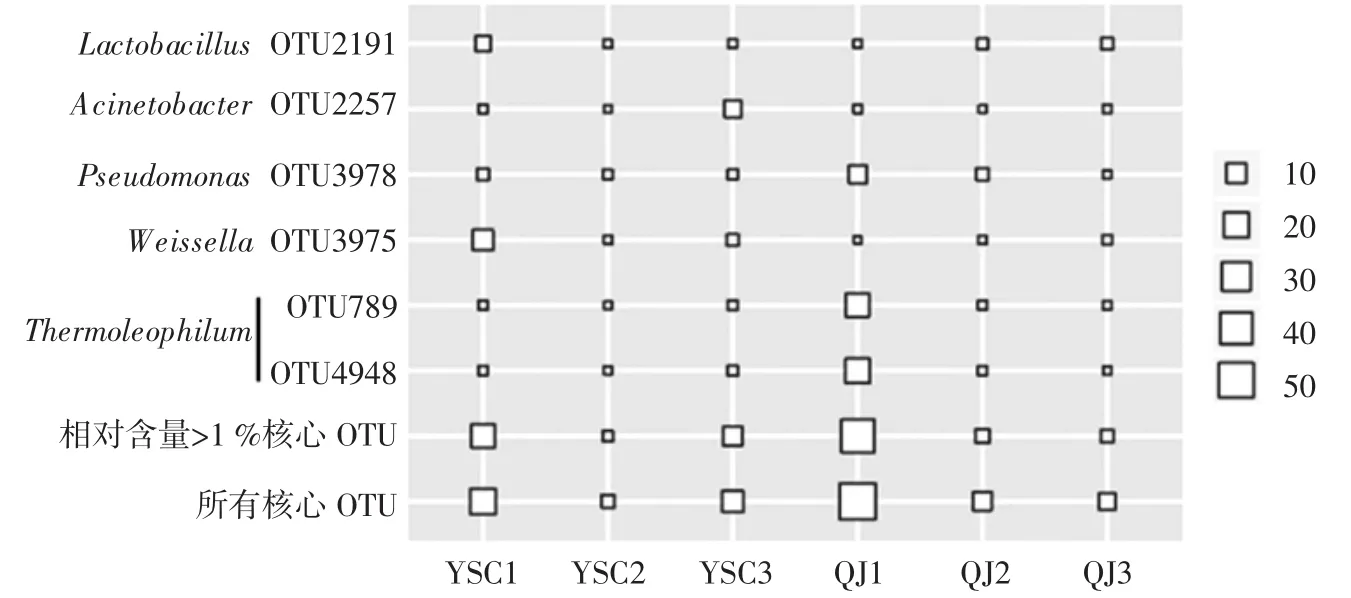
图4 发酵沙葱和青椒中优势核心OTU相对含量Fig.4 Relative abundance of dominant core OTUs in fermented Allium mongolicum Regel and Capsicum annuum var.grossum
由图4可知,共有6核心OTU平均相对含量>1.0%,累计平均相对含量达到12.34%,其中OTU4948、OTU789、OTU3975、OTU3978、OTU2257 和 OTU2191 的平均相对含量为3.38%、2.95%、2.16%、1.78%、1.07%和1.01%,除 OTU4948和 OTU789被鉴定为 Thermoleophilum外,其他4个OTU被依次鉴定为Weissella、Pseudomonas、Acinetobacter和 Lactobacillus。由此可见,虽两类盐渍泡菜在含量较低的细菌类群上存在差异,但亦共有部分相同的细菌类群。
2.5 基于PICRUSt功能预测分析
发酵沙葱和发酵青椒细菌类群功能大类的注释结果如图5所示。

图5 发酵沙葱和青椒细菌基因功能预测Fig.5 Predict gene functions of bacteria in fermented Allium mongolicum Regel and Capsicum annuum var.grossum
由图5可知,所有细菌共注释到了4 166个GOG,分别隶属于23个功能大类,且两类盐渍泡菜在氨基酸转运与代谢(E)、碳水化合物运输与代谢(G)以及转录(K)功能上均具有较高表达,而在RNA的加工与修饰(A)、染色质结构与动力学(B)和细胞运动(N)等功能上的表达较低。经Mood-median检验发现,发酵青椒中细菌在能量生产和转换(C)、氨基酸转运与代谢(E)、核苷转运与代谢(F)和转录功能(K)的表达上显著偏高(P<0.05)。由图5可知,不同类型的样品呈现出明显的聚类趋势,其中YSC1、YSC2和YSC3形成一个聚类,QJ1和QJ3形成一个聚类。基于基因功能预测数据矩阵,本研究进一步使用MANOVA对两类盐渍泡菜基因功能的整体差异性进行了分析,结果显示差异显著(P<0.05)。由此可见,两类盐渍泡菜细菌基因功能的表达存在显著差异。
3 结论
两类盐渍泡菜在细菌类群和基因功能的表达上均存在显著差异,其中发酵沙葱细菌类群的丰度和多样性及硬壁菌门、乳酸杆菌属、慢生芽胞杆菌属、泛菌属和拉恩氏菌属的相对含量均显著偏高,而菌群能量生产和转换、氨基酸转运与代谢、核苷转运与代谢和转录等功能基因的表达均显著偏低。由此可见,原料对盐渍泡菜的细菌类群与菌群基因功能的表达具有显著的影响。
