新型含苯并磷杂环戊二烯结构荧光分子的合成及性能
2021-01-28谢吴成欧艺强叶海方李杰森石君君
谢吴成, 陈 锟, 欧艺强, 叶海方, 李杰森, 石君君
(佛山科学技术学院 环境与化学工程学院,广东 佛山 528000)
有机发光二极管(Organic Light Emitting Diodes, OLED)具有轻薄、宽可视角、高对比度、高灵敏度以及柔性显示等优势, 已成功商业化[1-4]。有机发光材料是OLED器件发光层的重要组成, 其性能决定着器件最终的优异性。因此设计合成发光效率高的有机发光分子[5-6], 探索分子结构与光物理性能的内在联系, 对推动OLED器件发展方面具有重要意义。
实际应用中, 有机电致发光材料必须以无定型或微晶薄膜等固态聚集态存在;而常见的有机发光分子在聚集状态下容易形成较强的π-π堆积引起激子的浓度猝灭, 即聚集导致猝灭(aggregation-caused quenching, ACQ)效应从而降低材料的发光效率, 极大地限制了其在OLED器件中的应用[7-8]。聚集诱导发光(aggregation-induced emission, AIE)现象与ACQ完全相反, 具有AIE性质的分子在稀溶液中发光微弱或者不发光, 而在聚集后发光显著增强[9-11]。AIE分子由于其特殊的结构, 可以通过限制分子内旋转(RIR)、限制分子内振动(RIV)、激发态分子内质子转移(ESIPT)等机理[12]实现在固体状态下的高效荧光发射。由于其高固态荧光效率, 具有AIE性质的有机发光材料可以从根本上解决传统有机发光材料的ACQ现象对器件性能产生不利影响的难题, 受到科学家们的青睐[13]。
在同一分子中同时引入给电子和吸电子基团分别作为空穴和电子传输单元, 构成电子给-受体(Donor-Accept, D-A)型的分子结构是获得高性能的双极性荧光材料行之有效的方法[14]。D-A型双极性荧光材料在激发态时由于分子内电荷转移(intramolecular charge transfer, ICT)作用会产生有效的辐射发光, 减少荧光分子的自吸收损耗, 提高发光效率。同时可通过电子给/受体单元的选择, 采用 D-A, D-π-A和A-π-D-π-A 等结构较大范围调节推拉电子作用, 调控分子的轨道能级及发光波长[15-16]。近年来,苯并磷杂环戊二烯化合物因其独特的电子结构、刚性中心结构和高稳定性,被广泛用于有机光电功能材料、生物荧光探针、光致变色分子开关等方面[17-21]。研究表明,苯并磷杂环戊二烯氧化物是强的吸电子基团且具有大的空间位阻效应,能使分子具有较大的扭转构型, 是优秀的刚性受体核心骨架单元。同时, 富电子的咔唑、三苯胺基团由于优异的空穴传输性能,作为给体基团已广泛应用于构建高效的双极主体荧光材料[22-23]。
以苯并磷杂环戊二烯氧化物为原料,经Ullmann及Suzuki偶联反应,合成了2, 3-二(4-(9′-咔唑基)苯基)-1-苯基苯并磷杂环戊二烯-1-氧化物(CBZ-PIO)、 2, 3-二(4′-(二苯氨基)-[1,1′-联苯基])-1-苯基苯并磷杂环戊二烯-1-氧化物(TBN-PIO)和2, 3-二(4′-(二苯氨基)-[1,1′-联苯基])-1-乙氧基苯并磷杂环戊二烯-1-氧化物(TBN-EPIO)等3种新型含苯并磷杂环戊二烯结构的荧光分子(Scheme 1)。其结构经1H NMR,13C NMR,31P NMR, IR和MS确认,考察了紫外吸收、液体荧光、固体荧光、溶致变色及聚集诱导发光等光物理性能,对分子结构进行了模拟。
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪;UV-2700型紫外可见分光光度计;Bruker AVANCE III HD 400M型核磁共振仪(DCCl3为溶剂,TMS 为内标);IRTracer-100型红外光谱仪(KBr压片);amaZon SL型质谱仪;F-4600型荧光分光光度计。
所用试剂和药品均购自萨恩化学技术(上海) 有限公司,均为分析纯。
1.2 合成
(1) 2,3-二(4-(9′-咔唑基)苯基)-1-苯基苯并磷杂环戊二烯-1-氧化物(CBZ-PIO)的合成
依次称取化合物L177 mg(0.33 mmol),咔唑217 mg(1.33 mmol),碳酸铯432 mg(1.33 mmol)和碘化亚铜190 mg(10 mmol), 置换氮气后溶解于DMF 10 mL和1,2-环己二胺120 μL(10 mmol)中, 140 ℃遮光反应48 h。反应结束后, 加入少量水, 乙醚(2×50 mL)萃取, 合并有机相,饱和食盐水(150 mL)洗涤, 经无水硫酸钠干燥, 旋转蒸发仪蒸除溶剂。残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/4,V/V)纯化得黄绿色粉末固体CBZ-PIO0.197 g,收率84%, m.p.235~238 ℃;1H NMR(CDCl3,400 MHz )δ: 8.18(d,J=7.7 Hz, 2H), 8.12(d,J=7.7 Hz, 2H), 7.93(dd,J=12.4 Hz, 7.2 Hz, 2H), 7.87~7.80(m, 1H), 7.76(d,J=8.5 Hz, 2H), 7.70(d,J=8.4 Hz, 2H), 7.65~7.42(m, 15H), 7.42~7.37(m, 3H), 7.36~7.31(m,2H), 7.31~7.26(m, 2H);13C NMR(CDCl3,101 MHz)δ: 149.68(d,J=21.5 Hz), 143.27(d,J=26.5 Hz), 140.51, 140.37, 138.37, 137.45, 133.16, 133.00(d,J=14.8 Hz), 132.64~132.56(m), 132.49, 131.56, 131.46, 131.01(d,J=10.5 Hz), 130.84, 130.76, 130.54(d,J=5.4 Hz), 129.57(d,J=10.5 Hz), 129.36(d,J=9.3 Hz), 129.10(d,J=12.3 Hz), 128.80, 127.51, 126.56, 126.13, 125.95, 124.09(d,J=10.6 Hz), 123.62, 123.49, 120.43, 120.33, 120.24, 120.11, 109.63(d,J=17.6 Hz);31P NMR(CDCl3,101 MHz)δ: 38.87; IR(KBr)ν: 3055, 2924, 2854, 1727, 1598, 1508, 1448, 1284, 1230, 1199, 1114, 1072, 1023, 848, 747, 697 cm-1; MS(ESI)m/z: Calcd for C50H34N2OP{[M+H]+}709.2, found 709.2。

Scheme 1
(2) 2,3-二(4′-(二苯氨基)-[1,1′-联苯基])苯并磷杂环戊二烯-1-氧化物(TBN-PIO和TBN-EPIO)的合成
依次称取化合物L(0.33 mmol),四(三苯基膦)钯50 mg(0.043 mmol),碳酸钾183 mg(1.33 mmol)和4-硼酸三苯胺289 mg(1.0 mmol), 置换氮气后溶解于新除氧的水、乙醇和甲苯混合液(水/乙醇/甲苯=1/1/5,V/V/V) 15 mL中, 120 ℃反应12 h。反应结束后, 加入少量水, 乙酸乙酯(3×50 mL)萃取, 合并有机相,经无水硫酸钠干燥, 旋转蒸发仪蒸除溶剂。残余物经硅胶柱层析(洗脱剂:甲醇/二氯甲烷=1/5,V/V)纯化得化合物TBN-PIO和TBN-EPIO。
TBN-PIO: 黄色粉末固体0.235g, 收率82%, m.p.196~198 ℃;1H NMR(CDCl3,400 MHz)δ: 7.91~7.82(m, 2H), 7.78~7.74(m, 1H), 7.71(d,J=8.3 Hz, 2H), 7.60~7.26(m, 24H), 7.22~7.15(m, 6H), 7.15~7.01(m, 10H);13C NMR(101 MHz, CDCl3)δ: 149.36(d,J=21.8 Hz), 147.53, 147.46(d,J=34.6 Hz), 143.81(d,J=26.7 Hz), 140.80, 139.70, 133.91(d,J=19.7 Hz), 134.29, 134.00, 133.81, 133.34, 132.89, 132.80, 132.64(d,J=2.7 Hz), 132.13(d,J=2.5 Hz), 132.00, 131.57, 131.29, 131.19, 130.95(d,J=10.7 Hz), 130.85, 130.61, 129.61, 129.56, 129.48, 129.42, 129.25(d,J=7.9 Hz), 129.08, 128.98, 128.92, 128.80, 128.40, 127.51(d,J=21.1 Hz), 126.99, 126.27, 124.45(d,J=11.8 Hz), 123.97(d,J=11.0 Hz), 123.69(d,J=4.7 Hz), 123.01(d,J=16.6 Hz);31P NMR(101 MHz, CDCl3)δ: 39.17; IR(KBr)ν: 3030, 2923,2855, 1724, 1588, 1488, 1279, 1323,1112, 1071, 1027, 826, 750, 696 cm-1; MS(ESI)m/z: Calcd for C62H46N2OP{[M+H]+}865.3, found 865.3。

表1 化合物的光谱数据
TBN-EPIO: 黄色粉末固体0.237 g, 收率86%, m.p.217~220 ℃;1H NMR(400 MHz, CDCl3)δ: 7.80(dd,J=10.0, 7.2 Hz, 1H), 7.68(d,J=8.4 Hz, 2H), 7.60~7.41(m, 10H), 7.38(d,J=7.8 Hz, 2H), 7.34~7.21(m, 11H), 7.20~7.03(m, 14H), 4.25~4.06(m, 2H), 1.30(t,J=7.1 Hz, 3H);13C NMR(101 MHz, CDCl3)δ: 148.46, 147.22, 142.46, 140.69, 133.99(d,J=21.6 Hz), 133.23, 131.01, 129.71~128.79, 127.75(dd,J=30.9 Hz, 17.3 Hz), 127.26, 126.30, 124.53(d,J=7.4 Hz), 123.84(dd,J=14.0 Hz, 7.4 Hz), 123.08(d,J=11.7 Hz), 62.17(d,J=6.3 Hz), 16.56(d,J=6.0 Hz);31P NMR(101 MHz, CDCl3)δ: 46.35; IR(KBr)ν: 3032, 2361, 1589, 1489, 1327, 1277, 1221, 1072, 1026, 945, 858, 822, 752, 696, 517, 420 cm-1; MS(ESI)m/z: Calcd for C58H45N2NaO2P{[M+Na]+}855.3, found 855.3。
1.3 光学性能
紫外吸收光谱及液体荧光光谱以二氯甲烷为溶剂, 浓度为1×10-5mol/L, 在室温下测定。固体荧光光谱为室温下测定粉末的荧光光谱。
1.4 模拟计算
通过Gaussian09程序包中B3LYP 6-31G(d) 基组, 采用密度泛函理论(DFT)对化合物分子几何构型及前线分子轨道优化和电子云模拟计算。
2 结果与讨论
2.1 光学性能
室温下,CBZ-PIO,TBN-PIO和TBN-EPIO在二氯甲烷溶液中紫外可见吸收光谱和荧光发射光谱如图 1 所示, 固体薄膜状态下的荧光发射光谱如图2所示, 主要的光谱参数总结在表1中。
从图 1 可以看出, 在二氯甲烷溶液中, 这3种化合物都存在出两个比较明显的紫外吸收光谱带, 一个吸收峰在275~330 nm, 另一个在330~450 nm。CBZ-PIO,TBN-PIO和TBN-EPIO最大吸收波长分别为292, 308和306 nm, 主要来源于咔唑或三苯胺本身的π-π*电子跃迁。对比带有咔唑基团的CBZ-PIO, 含有三苯胺基团的化合物紫外吸收峰出现16~18 nm红移;而TBN-PIO和TBN-EPIO具有类似的紫外吸收峰。

/nm
3种化合物在二氯甲烷中都具有较强荧光发射能力,CBZ-PIO,TBN-PIO和TBN-EPIO的荧光量子产率分别为0.64、 0.77和0.85。CBZ-PIO的最大发射峰在510 nm处, 发蓝绿色的光;TBN-PIO与TBN-EPIO荧光光谱类似,发射峰分别为579及577 nm。对比带有咔唑基团的化合物CBZ-PIO, 含有三苯胺基团的化合物TBN-PIO荧光发射光谱红移(△λmax=69 nm), 因此改变供电子基团能调节整个π-共轭体系的电子排布, 可有效调控材料的荧光最大发射波长。

/nm

/nm图2CBZ-PIO, TBN-PIO和TBN-EPIO的固体(A)归一化荧光光谱和(B)荧光光谱
从图 2 可见, 3种化合物都具有较好的固体荧光。化合物CBZ-PIO的固体荧光发射峰为519 nm, 发蓝绿色光; 化合物TBN-PIO的最大发射峰在551 nm处, 发靛青色的光; 化合物TBN-EPIO固体荧光发射峰处在528 nm, 发翠绿色光。由图2b可见, 含磷杂环戊二烯骨架上磷原子上的取代基会对化合物的荧光强度产生较大影响, 磷原子上从连接-Ph变为-OEt基团时,TBN-EPIO比TBN-PIO荧光强度显著增强, 前者约为后者13倍。
2.2 溶致变色及聚集诱导发光效应
由于TBN-EPIO的荧光强度明显强于CBZ-PIO和TBN-PIO,选择TBN-EPIO作为代表性化合物,详细考察其在不同极性溶剂下的光学性能。分别配制了二氯甲烷, 四氢呋喃, 乙酸乙酯和N,N-二甲基甲酰胺的l×10-5mol/L的溶液, 测试TBN-EPIO在不同极性溶剂中的荧光光谱, 如图3所示。TBN-EPIO溶解于二氯甲烷中时最大发射峰在577 nm, 溶解于四氢呋喃时最大发射峰在561 nm, 溶解于乙酸乙酯时最大发射峰在550 nm, 溶解于N,N-二甲基甲酰胺时最大发射峰在604 nm。可见随溶剂极性增大,TBN-EPIO的荧光发射峰红移现象越明显, 具有明显的溶致变色效应。TBN-EPIO在DMF强极性溶剂中的荧光强度明显比其他溶剂低很多, 可能是由于该分子具有较强的分子内电荷转移效应(ICT), 与强极性溶剂溶剂化作用强从而导致荧光淬灭。
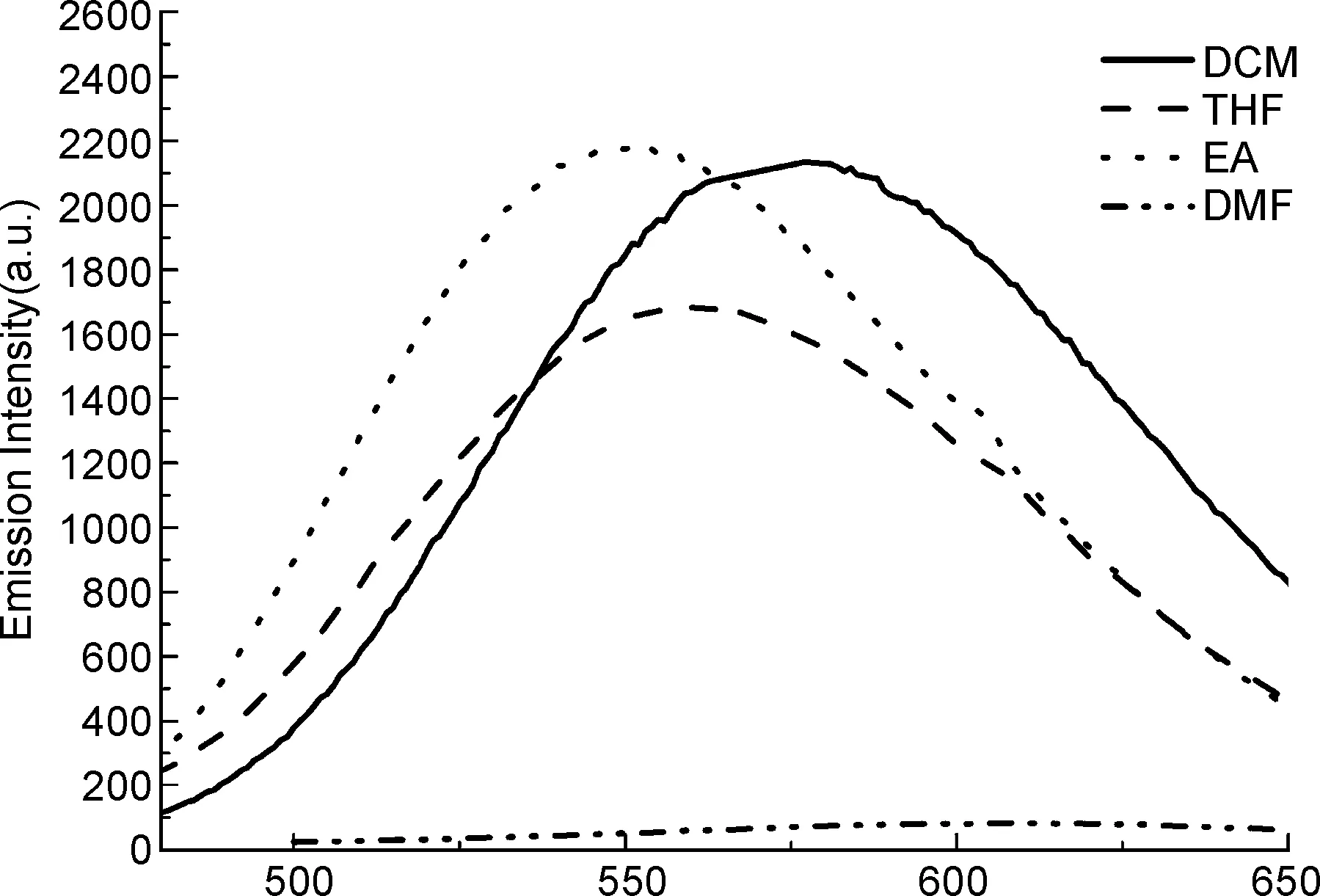
/nm
2.3 模拟计算
采用Gaussian09程序包中 B3LYP 6-31G(d) 基组, 利用密度泛函理论(DFT)模拟计算了CBZ-PIO,TBN-PIO和TBN-EPIO的几何构型及前线分子轨道电子云分布如图4所示。以苯并磷杂环戊二烯(PIO)为核心结构, 咔唑或者三苯胺为外围结构, 分子处于不同平面, 这种构型能有效地消除了分子间紧密的π-π堆积, 从而产生聚集诱导发光(AIE)性。3个化合物的 LUMO 能级均主要集中分布在受体苯并环戊二烯基团上, HOMO 能级均主要集中分布在供体结构单元咔唑或三苯胺基团上。HOMO和LUMO 轨道的电子云分离突出, 只有在苯环上有很小量的重叠, 这表明在同一分子中较好地实现了空穴与电子传输通道的分离, 电子与空穴均有各自的传输通道, 这有利于电子与空穴的传输、注入与平衡。
计算可得CBZ-PIO的HOMO能级为-5.28 eV,LUMO能级为-2.03 eV, 能级差为3.23 eV;TBN-PIO的HOMO能级为-4.86 eV, LUMO能级为-1.84 eV, 能级差为3.02 eV;TBN-EPIO的HOMO能级为-4.90 eV, LUMO能级为-1.84 eV, 能级差为3.07 eV。对比这3种化合物的轨道能级可知改变咔唑、三苯胺给体单元, 分子能级变化幅度较大, 能很好调控目标产物的紫外吸收及荧光性能。其中含三苯胺基团分子具有较高的HOMO、 LUMO能级, 较小的能级差;磷原子上引入不同的基团(如OEt, Ph), 分子能级基本无变化。

图4 化合物CBZ-PIO, TBN-PIO 和TBN-EPIO的HOMO和LUMO轨道电子云分布图
以苯并磷杂环戊二烯的氧化物为受体中心单元, 咔唑、三苯胺为给体单元, 设计合成了3种基于苯并磷杂环戊二烯骨架的D-A-D型双极主体荧光分子。通过UV-Vis和荧光光谱详细研究了化合物的光物理性能;利用量子化学计算法研究了该分子的几何构型和轨道分布。研究发现:3种分子都具有良好的液体及固体荧光性能, 当磷原子上为-OEt取代的TBN-EPIO荧光强度最强;TBN-EPIO分子存在溶致变色效应和聚集诱导发光AIE效应。此外, 利用密度泛函理论对3种分子进行理论模拟计算。
