LncRNA MEG 3通过抑制HIF1α的表达降低胶质瘤 U251细胞的增殖与侵袭能力
2021-01-28罗奇志邬力祥黄柏胜
罗奇志,张 帆,李 威,王 芳,邬力祥,黄柏胜
中南大学基础医学院1免疫学系,2生理学系,湖南 长沙 410008
胶质瘤是最常见的中枢神经系统原发性恶性肿瘤,发病机制仍然不清楚,其恶性表型的发生发展与肿瘤细胞增殖、侵袭、血管生成相关基因表达等复杂过程有关。胶质瘤具有独特的侵袭性从而影响其有效治疗[1],中位生存期仅14.6月[2]。近年来长链非编码RNA(lncRNA)作为一个重要的分子在生物调控中得到广泛的关注[3-4],lncRNA为长度大于200nt的非编码RNA,几乎不具有蛋白编码能力[5],肿瘤抑制因子母系表达基因3(MEG3)是lncRNA的一种,定位于染色体14q32。MEG3通过靶向Rac1抑制甲状腺癌的迁移和侵袭,通过调控BMP4而促进间充质干细胞的成骨分化,下调MEG3的表达促进膀胱癌细胞的增殖[6]。lncRNA在胶质瘤中发挥广泛的作用,lncRNAXIST通过miR-133a/SOX4促进胶质瘤的增殖和转移[7];MEG3可通过各种信号通路抑制胶质瘤等肿瘤的发生发展[8-10],MEG3可作为一个强有力的生物标志物和预后指标[11]。缺氧诱导因子1α(HIF1α)是肿瘤细胞的主要生存因子,在许多肿瘤细胞中高表达,介导肿瘤血管和淋巴适应缺氧环境。HIF1α可增强肿瘤细胞的增殖、凋亡、侵袭和迁移而促进肿瘤的血管形成[12],在肿瘤的放疗、化疗失敏感性及预后不良等方面均发挥关键作用[13]。然而,胶质瘤中MEG3作用的靶点及机制尚未阐明,胶质瘤中MEG3能否通过调控HIF1α的表达,从而影响胶质瘤细胞的生长和侵袭,目前尚无相关文献报道。因此,本研究探讨U251细胞中MEG3与HIF1α的表达水平,研究MEG3对HIF1α表达的影响,揭示U251细胞的增殖和侵袭与MEG3调控HIF1α的表达相关,研究结果可能将MEG3作为胶质瘤的临床治疗提供潜在的分子靶点。
1 材料和方法
1.1 材料
胎牛血清(Invitrogen),DMEM培养液(Hyclone),Trizol(Invitrogen),SYBR-Green RT-PCR 试 剂 盒(Takara),脂质体lipofectamine 2000(Invitrogen),HIF1α一抗(百奥莱博),辣根过氧化物酶标记羊抗兔IgG二抗(SantaCruz)、MTT 试剂(Promega)、Transwell小室(Corning)、人胚脑胶质细胞(Human fetal glial cells,HFGC)和U251细胞(上海细胞所),pcDNA3.1-MEG3重组载体为本实验室前期构建。
1.2 方法
1.2.1 细胞培养 胶质瘤U251细胞、HFGC细胞于含10%胎牛血清的DMEM培养液中,置于37℃,5% CO2培养箱中培养,根据各细胞的生长情况进行换液或传代。
1.2.2 重组载体转染 实验分为未转染组(Con)、pcDNA3.1空载体转染组(NC)及重组载体pcDNA3.1-MEG3转染组(MEG3)。在培养的U251细胞融合度为70%~80%时,更换不含胎牛血清的DMEM培养液,按照脂质体lipofectamine 2000转染说明书将pcDNA3.1-MEG3重组载体及相应空载体(NC)转染至培养的U251细胞。
1.2.3 细胞缺氧处理 将Con、NC、pcDNA3.1-MEG3组U251细胞的培养液换成不含血清且无糖DMEM培养液,立即将各组细胞置入缺氧密闭盒内,将5% CO2+95% N2的缺氧混合气体通入密闭盒内0.5 h排除盒内空气,然后用封口膜封闭密闭盒,置于37℃饱和湿度培养箱中培养12h,即为缺氧处理。
1.2.4 MEG3和HIF1α表达的检测
1.2.4.1 qRT-PCR检测MEG3和HIF1α mRNA的表达采用Trizol试剂分别从培养的HFGC细胞、U251细胞中抽提总RNA,逆转录合成cDNA,再以cDNA为模板,进行PCR扩增。采用标准SYBR-Green RT-PCR试剂盒,按照说明书的操作步骤分别检测MEG3和HIF1α的表达水平。引物序列分别为:MEG3上游5'-atagcgcccc ctattcatgc-3',下游 5'-gggagcagctatggatcacc-3';HIF1α上游 5-ccacagaaactaccttcaactcc-3',下游 5'-gtgatctccttctgc atcctgt-3',内参β-actin上游5'-aggggccggactcgtcatact-3',下游5'-ggcggcaccaccatgtaccct-3';反应条件如下:95℃预变性2 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 15 s,35个循环,72℃5 min终止反应。MEG3及HIF1α的相对表达水平通过 2-ΔΔCt方法分析获得。
1.2.4.2 Western blot检测HIF1α蛋白的表达 收集上述各组细胞用0.25%胰酶消化,1500 r/min离心后弃上清;再分别用1 mLPBS重悬细胞,1500 r/min离心弃上清,细胞沉淀用于提取蛋白。取一定量总蛋白样品进行SDS-PAGE电泳,转移到PVDF膜上,用TBST室温封闭1 h,分别用稀释的抗HIF1α或内参β-actin一抗4℃孵育过夜。TBST漂洗3次,加入辣根过氧化物酶标记羊抗兔IgG二抗,室温孵育1 h。TBST漂洗3次,用ECL试剂盒检测。
1.2.5 MTT方法 将处于对数生长期的U251细胞以终浓度2×103/孔种殖在96孔板,待细胞生长融合度为70%~80%时,将U251细胞进行pcDNA3.1-MEG3重组载体转染。在U251细胞转染后0、24、48、72 h每孔分别加入5 mg/mL的MTT20 μL(终浓度为0.5 mg/mL),孵育4 h,弃上清,每孔加入200 μL DMSO,震荡20 min,置酶标仪570nm处测定吸光度(A570nm)。
1.2.6 Transwell侵袭实验 分别将转染了pcDNA3.1-MEG3重组载体及相应空载体的U251细胞置于侵袭小室上层,含有10%胎牛血清的DMEM培养液置于侵袭小室的下层;在37℃培养箱孵育48 h后,用棉签将小室上层细胞刮下去除,然后用4%多聚甲醛将小室下层细胞固定15 min、结晶紫染色15 min后在显微镜下观察。
1.2.7 统计学分析 用SPSS17.0软件对数据进行统计分析,结果以均数±标准差表示,组间比较采用单因素方差分析,两组比较采用t检验。Real-time PCR数值分析采用2-ΔΔCt分析法计算基因表达的相对比值,结果以P<0.05为差异有统计学意义。
2 结果
2.1 MEG3在HFGC细胞及U251细胞中的表达
qRT-PCR结果显示,与HFGC细胞比较,U251细胞中MEG3的表达明显降低(P<0.05,表1)。

表1 HFGC组与U251细胞组MEG3表达比较Tab.1 Comparison of MEG3 expression between HFGCs and U251 cells(Mean±SD)
2.2 HIF1α在HFGC细胞及U251细胞中的表达
qRT-PCR结果显示,与HFGC细胞比较,U251细胞中HIF1α的表达明显增高(P<0.05,表2)。Western blot结果显示,与HFGC细胞比较,U251细胞中HIF1α蛋白的表达亦明显增高(图1)。

图1 HFGC与U251细胞中HIF1α的表达Fig.1 Expression of HIF1α in HFGC and U251 cells.
2.3 过表达MEG3对HIF1α表达的影响
常氧培养条件下,qRT-PCR结果显示,过表达MEG3使 HIF1α mRNA的表达降低(P<0.05,表3);Western blot结果显示,过表达MEG3使HIF1α蛋白的表达亦降低(图2A),在缺氧处理的上述细胞中,MEG3过表达亦使HIF1α蛋白的表达降低(图2B)。

图2 过表达MEG3对HIF1α蛋白表达的影响Fig.2 Effect of overexpression of MEG3 on expression of HIF1α protein.A:Normoxic treatment.B:Hypoxic treatment.

表2 HFGC组与U251细胞组HIF1α表达比较Tab.2 Comparison of HIF1α expression betweenHFGC group and U251 cell group(Mean±SD)
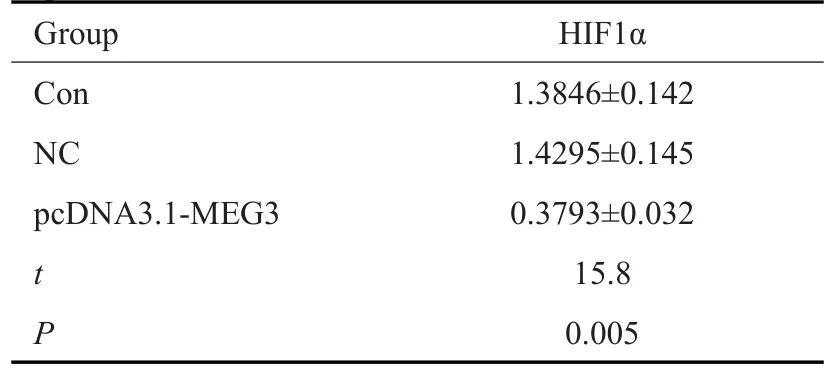
表3 过表达MEG3对HIF1αmRNA表达的影响Tab.3 Effect of overexpression MEG3 on HIF1α mRNA expression(n=6,Mean±SD)
2.4 MEG3对U251细胞增殖的影响
将pcDNA3.1-MEG3重组载体转染U251细胞,在不同的时间点检测细胞增殖情况,MTT结果显示,与未转染组(Con)细胞及转染pcDNA3.1空载体组(NC)细胞比较,转染pcDNA3.1-MEG3组48h后细胞的吸光度A值明显降低(P<0.05,表4)。
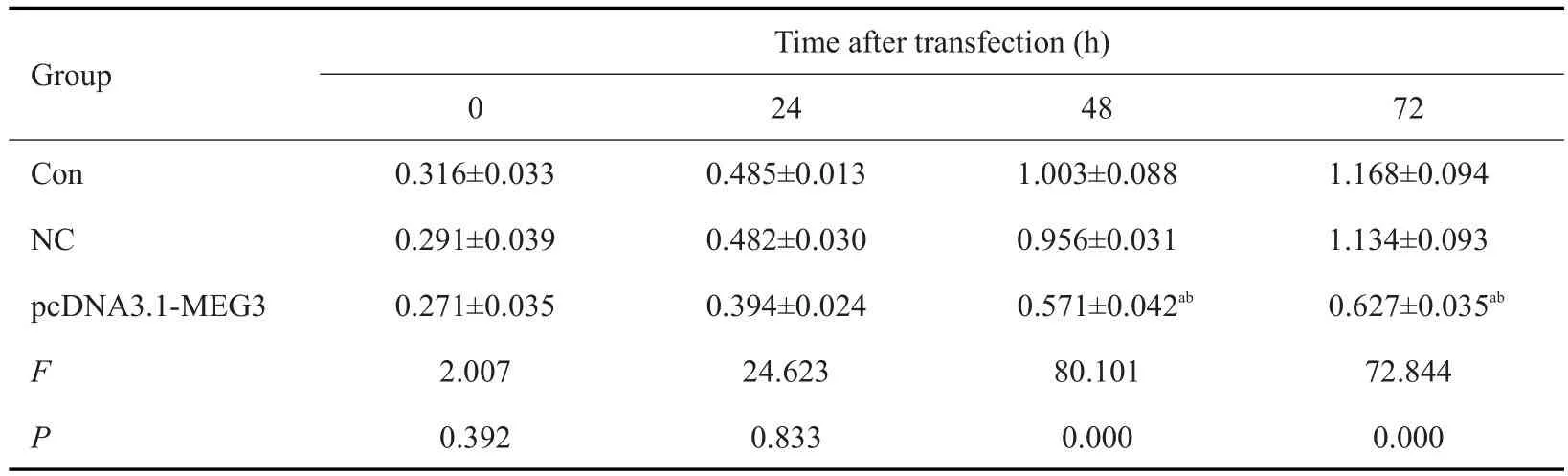
表4 过表达MEG3对U251细胞增殖的影响Tab.4 Effect of overexpression of MEG3 on proliferation of U251 cells(n=6,Mean±SD)
2.5 MEG3对胶质瘤细胞侵袭的影响
Transwell实验结果显示,与Con组相比较,NC组细胞侵袭数无差异(P>0.05),而过表达MEG3组细胞侵袭数明显降低(P<0.05,图3)。
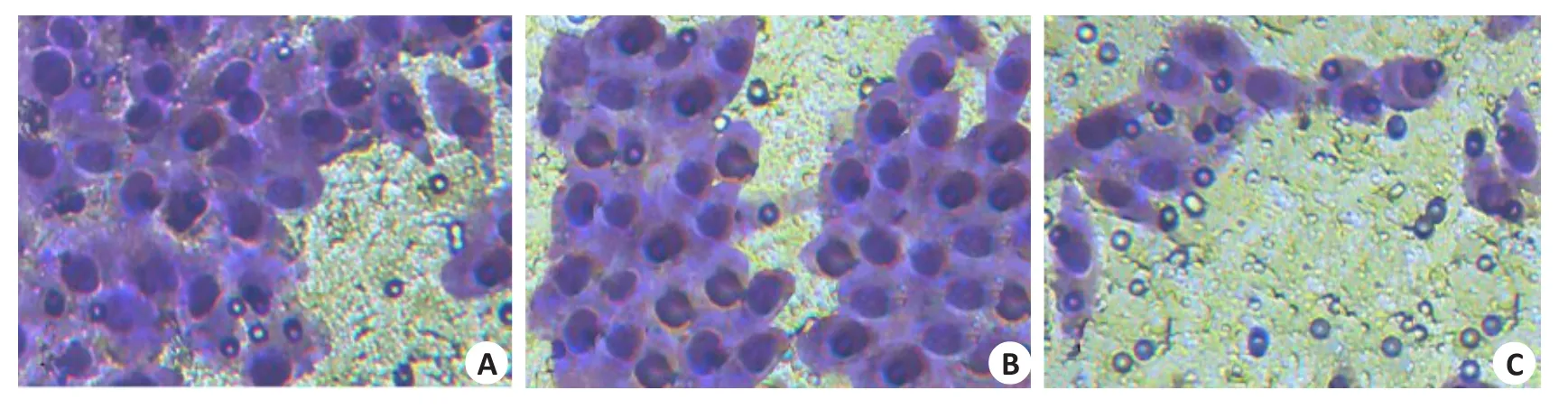
图3 Transwell实验检测U251细胞侵袭能力的变化Fig.3 Change of invasion ability of U251 cells detected by Transwell assay(Original magnification:×400).A:Con group;B:NCgroup;C:pcDNA3.1-MEG3group.
3 讨论
影响肿瘤细胞血管生成、侵袭和增殖相关基因表达的复杂过程导致胶质瘤恶性表型的发生发展,对基因调控网络的进一步研究将阐明胶质瘤发生的分子机制以及找出新的生物标志物和治疗靶点。胶质瘤是人类最常见的脑肿瘤,具有独特的侵袭性而影响其有效治疗,死亡率高,整体预后非常差[14]。近年来胶质瘤的靶向治疗成为新的方向,因此,寻找新的分子靶点和治疗方法对胶质瘤的临床治疗至关重要。本研究检测了U251细胞中MEG3及HIF1α的表达,qRT-PCR结果显示,与HFGC细胞比较,U251细胞中MEG3的表达水平低,而HIF1α的表达水平高;Western blot结果亦显示U251细胞中HIF1α蛋白表达高于HFGC细胞HIF1α蛋白表达,结果与文献报道胶质瘤中MEG3低表达[8,15],而HIF1α高表达一致[16];另外研究报道,MEG3在肺癌[17]、肝癌[18]、膀胱癌[19]、前列腺癌[20]、胃癌[21]及乳腺癌[22]组织中的表达明显低于邻近正常组织,表明MEG3在多种肿瘤中低表达,说明MEG3是一种潜在的肿瘤抑制基因,然而胶质瘤中MEG3的功能尚未阐明,需要进一步研究。
研究表明lncRNA在肿瘤的发生发展中发挥致癌或抑癌基因的功能,lncRNA表达水平与肿瘤的发展有关[23]。经生物信息学GTRD数据库(http://gtrd.biouml.org/)分析,预测HIF1α可作为MEG3的候选靶基因。文献报道,在慢性间隙性缺氧小鼠主动脉内皮细胞中,沉默MEG3可下调HIF1α的表达[24]。在氯化镍处理的肺支气管上皮细胞癌中,MEG3可通过Akt/p70S6K/S6轴抑制HIF1α的表达[25]。本研究发现:无论在常氧培养下还是缺氧状态下,当过表达胶质瘤U251细胞中MEG3时,候选靶基因HIF1α蛋白表达水平均出现下调,表明在胶质瘤U251细胞中MEG3可以抑制HIF1α的表达。至于胶质瘤U251细胞中的MEG3是直接抑制HIF1α,还是间接抑制HIF1α的表达,尚有待进一步研究证实。为研究其生物学功能,我们亦分析了MEG3对U251细胞增殖和侵袭的影响。结果可见,过表达MEG3,U251细胞吸光度值及侵袭数明显降低,表明过表达MEG3可抑制U251细胞的增殖及侵袭。研究报道,肿瘤抑制因子MEG3存在多种抗肿瘤机制,胶质瘤组织中MEG3的表达低于癌旁组织,它通过靶向miR-93及抑制PI3K/AKT信号通路从而抑制胶质瘤细胞的生长[8]。过表达MEG3抑制胶质瘤细胞的增殖、诱导凋亡[26],抑制黑色素瘤细胞的DNA合成、克隆形成等[27]。宫颈癌中MEG3低表达,它通过miR-21影响宫颈癌细胞的生长[28]。另外,骨肉瘤组织中MEG3的表达显著低于癌旁组织,MEG3过表达抑制骨肉瘤MG63细胞的增殖与侵袭、促进凋亡[29]。HIF1α能诱导血管新生,增强糖酵解,上调细胞增殖因子及侵袭相关基因的表达水平,从而适应缺氧微环境。在缺氧环境下,HIF1α作为肿瘤恶性进展的一个重要分子,在肿瘤的增殖、转移以及发生、发展中起着重要作用。本研究结果显示胶质瘤中MEG3作为肿瘤抑制因子的潜在机制可能包括MEG3通过调控HIF1α的表达,从而影响胶质瘤U251细胞的增殖与侵袭。
总之,在胶质瘤中MEG3低表达与HIF1α高表达同时存在,MEG3通过抑制HIF1α的表达从而影响胶质瘤U251细胞的增殖和侵袭。但MEG3也可以调控miR-96-5p[30]等其他下游基因或HIF1α亦受到miR-377-5p[31],miR-24-3p[32],NAT12/NAA30[33],FAT1[34]等其他上游基因的调控。本研究结果揭示了MEG3通过调控HIF1α影响胶质瘤U251细胞增殖与侵袭作用机制,为临床治疗胶质瘤提供新思路。
