长链非编码RNA Kcnq1ot1促进成骨细胞分化和抑制破骨细胞分化
2021-01-28时哲敏韩晓辉王敬朝
章 坤,时哲敏,任 怡,韩晓辉,王敬朝,洪 伟
天津医科大学基础医学院人体解剖与组织胚胎学系,天津 300070
骨质疏松症是一类在绝经后妇女中发病率高、治愈率低的慢性疾病。其发病机制主要是由于破骨细胞引起的过度骨吸收、成骨细胞减少引起的骨形成减少,进而骨重量和骨骼稳态被破坏;其特征表现为骨密度降低、骨微细结构改变,最终可能导致骨折[1]。随着社会经济和健康产业的发展人类寿命延长并进入老龄化,老年人骨质疏松症的发病率以及由其导致的骨折随年龄的增长而增加。在中国大约有8800万患者患有骨质疏松症,在美国大约有5000万患者[1-4]。此外,将近16%的骨质疏松症患者一生中会经历一次骨折。骨质疏松症骨折给患者本人和社会造成严重的经济负担和社会问题。患者往往已经发生了骨质疏松症甚至是非常严重的骨质疏松症后才去就诊。目前虽然开发了治疗骨质疏松症的药物,但是也存在临床应用的局限性。本项目的研究目的是通过深入探究骨质疏松症发生的分子机理,为骨质疏松症的预警和早期诊断及开发针对骨质疏松症的精准治疗药物提供理论和实验依据。
长链非编码RNA(lncRNA)是一类长度超过200个核苷酸但未翻译成蛋白质的RNA,这一限制将lncRNAs 与 小 RNAs(miRNAs)、小 干 扰 RNAs(siRNAs)、核仁小RNA(snoRNA)和其他短RNA区分开来。lncRNAs起初被认为是基因组转录的“噪音”,是RNA聚合酶Ⅱ转录的副产物,不具有生物学功能[5-6]。然而,近年来越来越多针对lncRNAs的研究发现lncRNAs可以通过多种层面调控基因的表达水平,进而参与多种生理和病理过程[7-14]。lncRNA Kcnq1重叠转录物1(Kcnq1ot1)是一个位于Kcnq1位点、具有物种同源性、由RNA聚合酶II催化合成的长链非编码RNA,其人转录本全长91 671核苷酸,定位于人染色体11p15.5;而小鼠转录本全长83437核苷酸,定位于小鼠7号染色体[15]。Kcnq1ot1是一个印记基因,即只表达父源等位基因。其转录本调控位于同一印记基因簇的其他基因父源拷贝的沉默[15]。近年来,越来越多的文献报道Kcnq1ot1与包括淋巴瘤、非小细胞肺癌、心肌病等在内的多种疾病相关[16-21]。尽管有文献报道lnc-KCNQ1OT1可以促进间充质干细胞向成骨细胞分化[22-23],然而其在骨质疏松症以及破骨细胞分化过程中的表达及作用仍不明确。本研究致力于解决以上问题,拟检测lnc-Kcnq1ot1在多种骨质疏松模型、成骨细胞和破骨细胞分化过程中的表达;并探究其在成骨和破骨过程中的作用,为临床骨质疏松症的治疗提供新靶点。
1 材料和方法
1.1 实验材料
小鼠单核巨噬细胞系RAW264.7、小鼠前成骨细胞系MC3T3-E1和HEK293T细胞均购自中国科学院细胞库。小鼠骨髓源巨噬细胞BMMs从6~8周龄的C57BL/6雄性小鼠的股骨中提取。C57BL/6小鼠购自北京华阜康生物科技股份有限公司。实验小鼠在天津医科大学实验动物中心繁育,所有的程序按照天津医科大学实验动物中心的操作规范流程进行。DMEM高糖、MEM-α培养基、OPtI-MEM培养基、Lipofectamine RNAiMAX转染试剂和核浆分离提取试剂盒(英潍捷基);逆转录试剂盒(Thermo fisher);Trizol、SYBG(Takara);重组人核因子κB受体活化因子配体(RANKL)、巨噬细胞集落刺激因子(M-CSF)(派普泰克)。TRAP染色试剂盒、抗坏血酸、β-甘油磷酸酯和地塞米松(Sigma)。
1.2 研究方法
1.2.1 细胞提取、培养及破骨诱导 BMMs细胞提取方法;取6~8周龄雌性C57小鼠,颈椎脱臼处死小鼠。用75%乙醇消毒腹部和后腿。固定小鼠四肢,在腹部中线切开一个切口,去除皮后用剪刀分离出后腿,用75%乙醇以及高压灭菌过的1×PBS清洗干净后腿。用剪刀剔除骨头上的所有肌肉组织,分离出股骨,分别切断股骨的两端,在10 mL细胞培养皿中加入20 mL预热好的MEMα完全培养基(含有10%胎牛血清FBS和1%青链霉素),用1mL注射器吸取MEMα完全培养基反复将针头插入髓腔进行冲洗,直至髓腔呈现白色,将细胞培养皿中含有骨髓细胞的培养液收集到50 mL离心管中,吹散细胞使细胞悬浮,用70目钢目网过滤细胞悬浮液,取90µL进行台盼蓝染色并细胞计数,观察活细胞数量;1500 r/min离心3 min,弃去上清,加入适量预热好的完全培养液和25 ng/mL的M-CSF重悬细胞后铺板,培养3 d后换液,此时在完全培养液中加入25 ng/mL的MCSF和100 ng/mL的sRANKL诱导细胞,1次/2 d换液,诱导6~8 d直至细胞出现融合。RAW264.7细胞用含10% FBS和1%青链霉素的DMEM培养基在37℃、5% CO2培养箱中培养,用100 ng/mL的sRANKL诱导分化为破骨细胞,1次/2 d换液,共诱导4 d。MC3T3-E1细胞用含10% FBS和1%青链霉素的MEM-α培养基在37℃、5% CO2培养箱中培养,诱导成骨分化时,在培养液里加入50 μg/mL抗坏血酸(维生素C),10 mmol/mL β-甘油磷酸酯和10-7mmol/mL地塞米松。1次/2d换液。
1.2.2 TS(鼠尾悬吊)诱导的骨质疏松模型 选用6~8周雄性C57BL/6小鼠20只,实验室常规喂养1周后,将小鼠单笼饲养,考虑到鼠尾悬吊的致死性以及成功率,其中14只鼠尾悬吊(另外6只作为对照),前肢着地,后肢悬空,身体与平面呈30°夹角。小鼠能自由进食进水,28d即可建立骨质疏松模型。
1.2.3 OVX鼠绝经后骨质疏松模型建立 选用12~14周龄雌性C57BL/6小鼠14只,实验室常规喂养1周后,其中8只进行卵巢去除手术(另外6只作为对照)。用7.7 μL/g的乌拉坦腹腔注射麻醉小鼠。取俯卧位,手术区备皮,碘伏消毒,在小鼠髂嵴顶部外上方1 cm左右,腰椎骶棘肌两侧做纵向切口长约0.8 cm,打开后腹膜,切除双侧卵巢,清理伤口后分两层缝合皮肤和肌层。卵巢为粉红色颗粒状组织,多被其周围脂肪组织所掩盖,术中需拨开这些组织,方能将其显露。对照组手术方法与实验组相同,但打开后不切除卵巢。术后正常饮食饮水,6月即可建立骨质疏松模型。
1.2.4 siRNA转染细胞 靶向Kcnq1ot1的siRNAs由上海吉玛基因公司提供si-NC:UUCUCCGAACGUGU CACGUTT;si-lncKcnq1ot1-1#:GGGAAUCUGGUC UAAUGAATT;si-lncKcnq1ot1-2#:CCUGGUGAAG GUACUAAAUTT;si-lncKcnq1ot1-3#:GCCUGUGU CUGUCAUAGAATT;si-lncKcnq1ot1-4#:GCUGCUC ACUUAGUAACUATT;待六孔板细胞密度达到50%~70%即可转染siRNAs,转染前将六孔板换为无双抗完全培养基。A液:250μLopti-MEM+3μLsiRNA;B液:250 μLopti-MEM+5 μLLipofectamine RNAiMAX;混匀,离心静置5 min后,将B液加入至A液,混匀,离心静置20 min。将AB液复合物加入到每孔培养液中,轻轻摇动六孔板混匀。37℃、5% CO2培养。
1.2.5 慢病毒构建 设计并合成Kcnq1ot1的shRNAs序列:Kcnq1ot1-Mus-31 978-F:GATCCCCCCTGGAGA CTTGCCCTATTTTCAAGAGAAATAGGGCAAGTC TCCAGGTTTTTA;Kcnq1ot1-Mus-31978-R:AGCTT AAAAACCTGGAGACTTGCCCTATTTCTCTTGAA AATAGGGCAAGTCTCCAGGGGG;Kcnq1ot1-Mus-45566-F:GATCCCCGCTGCTCACTTAGT AACTATT CAAGAGATAGTTACTAAGTGAGCAGCTTTTTA;Kcnq1ot1-Mus-45566-R:AGCTTAAAAAGCTGCTC ACTTAGTAACTATCTCTTGAATAGTTACTAAGTG AGCAGCGGG。梯度退火得到双链shRNA序列;并连接到经BglⅡ和HindⅢ双酶切的线性pSuper载体上;随后EcoRⅠ酶切pSUPER-shRNAs、T4聚合酶补缺口、XhoⅠ酶切后的产物连接到经EcoRV和XhoⅠ双酶切的线性慢病毒载体pCCL.PPT.hPGK.GFP.Wpre。经测序确证得到正确的Kcnq1ot1-shRNAs和对照shRNA。
1.2.6 荧光实时定量PCR TRIzol法抽提细胞总RNA。根据逆转录试剂盒说明书逆转录合成cDNA,荧光实时定量PCR采用TAKARA染料说明指导,运用LightCycler仪器检测基因表达的情况。引物序列为:mGapdh-F:ACCCAGAAGACTGTGGATGG;mGapdh-R:TTCA GCTCAGGGATGACCTT;mKcnq1ot1-F:GGTCTGA GGTAGGGATCAGG;mKcnq1ot1-R:GGCACACGG TATGAGAAAAGATTG;mRunx2-F:GGGGCAGTC ATAACTGGGTT;mRunx2-R:GCGTGGGAACAGG TCACTTA;mAlp-F:ACACCTTGACTGTGGTTACT GCTGA;mAlp-R:CCTTGTAGCCAGGCCCGTTA;mNeat1-F:GGGAAGGGTGTGGTCAGAAG;mNeat1-R:GGCAGGTTGGCTCCTACAAT;mBsp-F:CCGGC CA CGCTACTTTCTT;mBsp-R:GGACTGGAAACC GTTTC;mBglap-F:CAGACAAGTCCCACACAGCA;mBglap-R:CTTGGCATCTGTGAGGTCAG;mCtsk-F:GAAGAAGACTCACCAGAAGCAG;mCtsk-R:TCC AGGTTATGGGCAGAGATT;mOscar1-F:TGGCGGT TTGCACTCTTCA;mOscar1-R:GATCCGTTACCAG CAGTTCCAGA;mNfatc1-F:CTCGAAAGACAGCA CTGGAGCAT;mNfatc1-R:CGGCTGCCTTCCGTCT CATAG。
1.2.7 核浆分离提取RNA 按照life invitrogen公司PARISTMKit(货号AM1921)说明书分别提取MC3T3-E1和RAW264.7细胞的细胞核和细胞浆RNA;随后逆转录、荧光实时定量PCR检测Kcnq1ot1亚细胞定位。
1.2.8 TRAP染色 将RAW264.7或BMMs铺于24孔板中,用100 ng/mLRANKL联合M-CSF诱导培养至显微镜下可见融合(一般6~8 d)后进行抗酒石酸酸性磷酸酶染色。染色时,首先移除培养液,用PBS洗3遍,每次3 min。4%的多聚甲醛固定10 min,PBS洗3遍,每次3 min。0.1% Triton-100通透30 min,PBS洗3遍,每次3 min。PBST孵育10min后,按照24孔板每孔400~500 μL加入新鲜配制的TRAP染液,37℃烘箱反应1 h。每孔加入100μLPBS进行拍照。
1.2.9 ALP染色 将MC3T3-E1细胞铺于96孔板中,用50 μg/mL抗坏血酸,10 mmol/mL β-甘油磷酸酯和10-7mmol/mL地塞米松(1次/2 d换液)诱导7 d后用4%多聚甲醛4℃固定30 min,PBS洗3遍,每次3 min;加入BCIP/NBT染液室温避光孵育30 min,随后用蒸馏水洗3遍,每次3min;每孔加入50μLPBS进行拍照。
1.2.10 统计学方法 本研究实验均独立重复3次,实验中所有数据均采用SPSS21.0软件进行分析。计量资料以均数±标准差表示,多组间数据比较采用单因素方差分析,两组比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 卵巢去势(OVX)小鼠骨质疏松模型中lnc-Kcnq1ot1的表达
与对照组相比,OVX小鼠股骨组织中破骨相关基因Nfatc1表达显著上调(P<0.05),而成骨相关基因Bglap、Runx2以及lnc-Kcnq1ot1表达显著降低,差异具有统计学意义(P<0.05,图1A)。
2.2 鼠尾悬吊(TS)小骨质疏松模型中lnc-Kcnq1ot1的表达
与对照组相比,TS小鼠股骨组织中破骨相关基因Mmp9和Nfatc1表达显著上调(P<0.05),而成骨相关基因Bsp以及lnc-Kcnq1ot1表达显著降低,差异具有统计学意义(P<0.05,图1B)。
2.3 自然衰老骨质疏松模型中lnc-Kcnq1ot1的表达
与对照组相比,老龄小鼠股骨组织中破骨相关基因Nfatc1表达显著上调(P<0.05),而成骨相关基因Bglap、Runx2以及lnc-Kcnq1ot1表达显著降低,差异具有统计学意义(P<0.05,图1C)。

图1 长链非编码RNA Kcnq1ot1在小鼠疏松股骨组织中的表达Fig.1 Expression of lnc-Kcnq1ot1 in different mouse models of osteoporosis.A:OVX and shamoperated mice(n=5).B:TS and control mice(n=5).C:8-and 18-month-old mice(n=5).The data are presented as Mean±SD from at least triplicate experiments.*P<0.05vsSham or 8 months.
2.4 MC3T3-E1细胞成骨分化过程中lnc-Kcnq1ot1的表达变化
与未诱导组相比,成骨诱导后Bglap、Alp和lnc-Kcnq1ot1的表达显著升高,差异具有统计学意义(P<0.05,图2)。

图2 长链非编码RNA Kcnq1ot1在MC3T3-E1细胞向成骨分化过程中的表达Fig.2 Expression of lnc-Kcnq1ot1 during osteoblast differentiation of MC3T3-E1 cells.The data are presented as Mean±SD from at least triplicate experiments.*P<0.05 vs0d.
2.5 BMMs破骨分化过程中lnc-Kcnq1ot1的表达变化
与未诱导组相比,破骨诱导后破骨相关基因Ctsk和Oscar表达显著升高(P<0.05,图3A),而lnc-Kcnq1ot1的表达显著降低,差异具有统计学意义(P<0.05,图3B)。
2.6 RAW264.7细胞破骨分化过程中lnc-Kcnq1ot1的表达变化
与未诱导组相比,破骨诱导后破骨相关基因Ctsk和Oscar表达显著升高(P<0.05,图3C),而lnc-Kcnq1ot1的表达显著降低,差异具有统计学意义(P<0.05,图3D)。

图3 长链非编码RNA Kcnq1ot1在破骨细胞分化过程中的表达Fig.3 Expression of lnc-Kcnq1ot1 during osteoclast differentiation of BMMs and RAW264.7cells.The data are presented as Mean±SD from at least triplicate experiments.*P<0.05vs0d.
2.7 沉默lnc-Kcnq1ot1对成骨分化的影响
与shRNA-NC组相比,lnc-Kcnq1ot1-shRNAs组细胞中lnc-Kcnq1ot1表达显著降低,且成骨相关基因Alp和Bglap的表达同样显著降低,差异具有统计学意义(P<0.05,图4A~C)。与NC+成骨诱导7d组相比,lnc-Kcnq1ot1-shRNAs+成骨诱导7 d组细胞中lnc-Kcnq1ot1表达显著降低,且成骨相关基因Alp和Bglap的表达同样显著降低,差异具有统计学意义(P<0.05,图4A~C)。ALP染色结果进一步证实沉默lnc-Kcnq1ot1抑制成骨诱导剂引起的成骨细胞分化(图4D)。
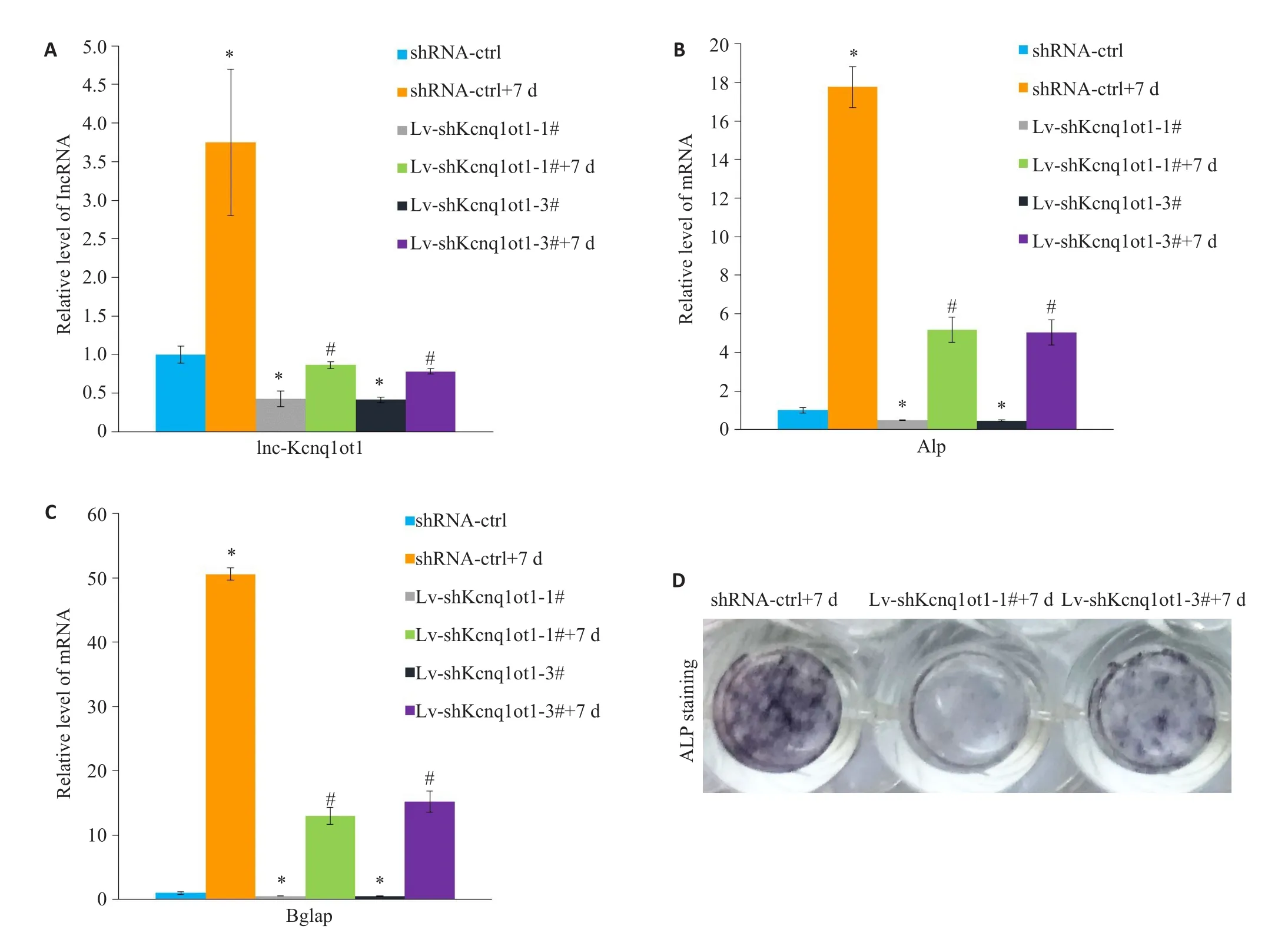
图4 沉默lnc-Kcnq1ot1对成骨细胞分化的影响Fig.4 Knockdown of lnc-Kcnq1ot1 inhibits osteoblast differentiation.MC3T3-E1 cells were infected with lentivirus-mediated sh-lnc-Kcnq1ot1 or sh-control,and subsequently stimulated with osteogenic differentiation medium for 7 days.The RNA levels of lnc-Kcnq1ot1(A),Alp(B)and Bglap(C)were determined by qRT-PCR.D:Representative images of ALP staining.The data are presented asMean±SD from at least triplicate experiments.*P<0.05vsshRNA-Ctrl;#P<0.05vsshRNA-Ctrl+7d.
2.8 沉默lnc-Kcnq1ot1对BMMs破骨分化的影响
与si-NC组相比,lnc-Kcnq1ot1-siRNAs组细胞中lnc-Kcnq1ot1表达显著降低,而破骨相关基因Ctsk和Oscar的表达显著升高,差异具有统计学意义(P<0.05,图5A~C)。与NC+破骨诱导8 d组相比,lnc-Kcnq1ot1-siRNAs+破骨诱导8 d组细胞中lnc-Kcnq1ot1表达显著降低,而破骨相关基因Ctsk和Oscar的表达显著升高,差异具有统计学意义(P<0.05,图5A~C)。诱导8 d后进行TRAP染色,结果进一步证实沉默lnc-Kcnq1ot1后破骨细胞活性显著增强(图5D)。

图5 沉默lnc-Kcnq1ot1对小鼠BMMs向破骨细胞分化的影响Fig.5 Knockdown of lnc-Kcnq1ot1 promotes osteoclast differentiation of BMMs.BMMs were transfected with si-lnc-Kcnq1ot1 or si-NC every three days,and simultaneously stimulated with or without M-CSF and/or RANKL for 8 days.The expression of lnc-Kcnq1ot1(A),Ctsk(B)and Oscar(C)was determined by qRT-PCR.D:Representative images of TRAP staining(Original magnification:×100).The data are presented as Mean±SD from at least triplicate experiments.*P<0.05vsNC;#P<0.05vsNC+8d.
2.9 沉默lnc-Kcnq1ot1对RAW264.7破骨分化的影响
与si-NC组相比,lnc-Kcnq1ot1-siRNAs组细胞中lnc-Kcnq1ot1表达显著降低,而破骨相关基因Ctsk和Oscar的表达显著升高,差异具有统计学意义(P<0.05,图6A~C)。与NC+破骨诱导4 d组相比,lnc-Kcnq1ot1-siRNAs+破骨诱导4 d组细胞中lnc-Kcnq1ot1表达显著降低,而破骨相关基因Ctsk和Oscar的表达显著升高,差异具有统计学意义(P<0.05,图6A~C)。诱导4 d后进行TRAP染色,结果进一步证实沉默lnc-Kcnq1ot1后破骨细胞活性显著增强(图6D)。

图6 沉默lnc-Kcnq1ot1对RAW264.7细胞向破骨细胞分化的影响Fig.6 Knockdown of lnc-Kcnq1ot1 promotes osteoclast differentiation of RAW264.7 cells.RAW264.7 cells were transfected with silnc-Kcnq1ot1 or si-control every two days,and simultaneously stimulated with RANKL for 4 days.The expression of lnc-Kcnq1ot1(A),Ctsk(B)and Oscar(C)was determined by qRT-PCR.D:Representative images of TRAP staining(×100).The data are presented asMean±SD from at least triplicate experiments.*P<0.05vsNC;#P<0.05vsNC+4d.
2.10 lnc-Kcnq1ot1的亚细胞定位
亚细胞定位结果显示,lnc-Kcnq1ot1主要存在于细胞核(图7)。

图7 核浆分离确定lnc-Kcnq1ot1亚细胞定位Fig.7 Determination of the subcellular localization of lnc-Kcnq1ot1.RNA was extracted from the nuclei or cytoplasm of MC3T3-E1(A)and RAW264.7(B)cells.The RNA level of lnc-Kcnq1ot1,Neat1(nuclear retained),and Gapdh(cytoplasm retained)was determined by qRT-PCR.The data are presented as Mean±SD from at least triplicate experiments.
3 讨论
人类全基因组测序结果显示,具有编码蛋白质功能的基因不到全部基因组序列的2%,而在占据人类基因组98%以上的非蛋白编码序列中,绝大多数被转录成长度大于200个碱基的lncRNAs[5]。近年来针对lncRNAs的功能研究表明,一方面lncRNAs在中枢神经系统发育、心脏发育以及骨骼肌发育等生理过程中发挥着关键作用[18,24-27];另一方面,lncRNAs的异常表达与多种人类疾病密切相关,例如阿尔茨海默病、心血管疾病、肝纤维化和癌症等[7-9,12,17-18,28]。lnc-Kcnq1ot1与H3K9和H3K27特异性组蛋白甲基转移酶G9a和PRC2结合,进而沉默位于同一印记基因簇的其他基因[15]。lnc-Kcnq1ot1通过调节miR-129-5p及JAG1的表达,进而促进非小细胞肺癌细胞的增殖、转移及侵袭[11]。lnc-Kcnq1ot1通过miR506-3p促进氧化应激、细胞焦亡和炎症,进而促进糖尿病肾病进展[21]。最新研究表明,lnc-Kcnq1ot1通过miR-221促进IκB表达,进而抑制血管平滑肌细胞的增殖、炎症及内膜增生[20]。lnc-Kcnq1ot1还被报道参与骨肉瘤的进展以及促进骨折愈合[29-30]。然而,lnc-Kcnq1ot1在骨质疏松症以及破骨细胞分化过程中的作用仍不明确。本研究发现lnc-Kcnq1ot1在OVX致小鼠的疏松骨组织中、鼠尾悬吊致小鼠疏松骨组织中、自然衰老致小鼠疏松骨组织中以及BMMs、RAW264.7细胞向破骨细胞分化过程中表达量显著降低,而在MC3T3-E1细胞成骨分化过程中表达量显著上调,提示lnc-Kcnq1ot1参与成骨与破骨分化的调节。在本研究中,我们以慢病毒为载体在MC3T3-E1细胞中沉默lnc-Kcnq1ot1后可显著下调Alp和Bglap的表达,并抑制成骨诱导剂引起的这些基因的上调。ALP染色结果同样证实沉默lnc-Kcnq1ot1抑制成骨诱导剂引起的成骨细胞分化,这部分的结果与其他课题组报道的lnc-KCNQ1OT1促进间充质干细胞向成骨细胞分化的结论相一致[22-23,31]。我们进一步运用小干扰RNAs在BMMs和RAW264.7细胞中沉默lnc-Kcnq1ot1的表达,随后向破骨方向诱导。荧光实时定量PCR结果首次证实沉默lnc-Kcnq1ot1促进破骨相关基因Ctsk和Oscar的表达;TRAP染色结果进一步确证下调lnc-Kcnq1ot1显著促进破骨分化,以上的结果为lnc-Kcnq1ot1成为治疗骨质疏松症的潜在靶点提供了理论基础和实验依据。
lncRNAs可与蛋白质、DNA和RNA相互作用,实现其在不同多种层面上调控基因的表达水平,例如在表观遗传调控、转录调控以及转录后调控。而lncRNAs的细胞定位决定着其发挥作用的途径和机制[5]。在细胞浆内,lncRNAs主要通过转录后调控机制对基因表达进行调控。目前的研究表明lncRNAs主要可以通过增加mRNA的稳定性、降低mRNA的稳定性、促进mRNA的翻译、抑制mRNA的翻译、作为microRNA的前体调节基因、ceRNA这6种机制起作用。而在细胞核内,lncRNAs主要通过各种机制调控基因的转录,并且lncRNAs还参与细胞核内各种亚核结构的构建[5]。尽管近年来很多文献报道lnc-Kcnq1ot1可以通过ceRNA机制,吸附不同的miRNAs调控相关靶基因的表达,进而参与多种疾病的进展[17-18,22-23]。然而,在本研究中,我们通过核浆分离提取细胞核和细胞浆中RNA,并用实时荧光定量PCR技术证实lnc-Kcnq1ot1主要存在于细胞核,这也与最初报道的lnc-Kcnq1ot1是一个细胞核内较稳定的长链非编码RNA一致[15],同时也提示我们在后续的机制研究中需要关注其亚细胞定位。
综上所述,长链非编码RNA Kcnq1ot1促进成骨细胞分化和抑制破骨细胞分化,为临床骨质疏松症的治疗提供了新靶点。
