大枣多糖对小鼠淋巴细胞免疫调节作用的研究
2021-01-28李凤娇李敬双王一伦
李凤娇,李敬双,王一伦,金 鑫,李 贤,于 洋✉
(锦州医科大学 食品科学与工程学院,辽宁 锦州 121001)
大枣(Ziziphus jujuba Mill),鼠李科植物枣的干燥成熟果实,主要分布在亚洲和美洲的热带和亚热带,少数分布在非洲和两半球温带,大枣味美甘甜,营养价值丰富,我国已有几千年的栽培历史,大枣也是脾胃虚弱、气血不足、倦怠无力、失眠多梦等患者良好的保健营养品。此外,大枣对慢性肝炎、肝硬化、贫血、过敏性紫癜等病症有较好疗效,典型的药食同源之品。
大枣多糖(Jujube polysaccharide,JP)是大枣中一种重要的活性物质,具有多种生理活性,将其提取、纯化、分级[1],可作为免疫促进剂。大枣多糖能控制细胞的分裂和分化,调节细胞的生长与衰老[2];能有效清除人体内的氧自由基[3]。大枣多糖是抗衰老的主要活性成分,具有明显抗补体活性,且中性多糖的活性要强于酸性多糖。研究发现,大枣多糖具有抗氧化活性[4]、免疫调节活性[5]、保肝作用[6]、抗高脂血症作用[7]、抗肿瘤作用[8]、减缓疲倦[9]。可广泛应用于医药、保健食品及功能食品,作为绿色生物医药产品,大枣多糖具有广阔的市场前景和应用价值。
随时代的进步,关于大枣多糖的造血功能、抗氧化功能、修复肝损伤、抗疲劳、改善肠道、抑制肿瘤细胞等的报道越来越多,大枣多糖毒性低,不良反应少,为了广泛应用于临床和保健食品,大枣多糖的抗癌、抗氧化和增强免疫力的研究仍将是未来研究重点,因此,进一步探讨其作用机制对于为大枣多糖的深入研究、饲料添加剂的研制和开发具有重要意义。
本文以大枣多糖为研究对象,建立免疫模型,通过 MTT法观察大枣多糖对小鼠淋巴细胞增殖的影响;ELISA法观察大枣多糖对小鼠淋巴细胞上清液中IL-2、IL-6、IL-10、IL-12水平的影响;QRT-PCR检测大枣多糖对小鼠淋巴细胞 IL-2、IL-6、IL-10、IL-12信使核糖核酸(mRNA)的表达,为大枣多糖的进一步开发与利用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
Balb/c小鼠 SPF级,体重在(20±2)g,8~10周龄,饲养条件20~26 ℃,锦州医科大学生命科学院,生产许可证号为SCXK (辽)2014~0004。
1.1.2 药品
大枣多糖,纯度≥90%:晨光生物技术有限公司;四季青优级胎牛血清:浙江天杭生物科技有限公司产品;甲基噻唑蓝298-93-1(MTT)、台盼蓝(Trypan Blue)、RPMI-1640培养基-11875、二甲基亚砜 D8370-100(DMSO)、红细胞裂解液(Tris-NH4Cl)、磷酸盐缓冲溶液(PBS)和氯仿-P1014:北京索莱宝科技有限公司;Trizol-R0016:碧云天生物技术;异丙醇、乙醇:山东旭晨化工科技有限公司;小鼠IL-2、IL-6、IL-10和IL-12 mRNA细胞因子检测试剂盒:上海酶联生物科技有限公司;TaKaRa逆转录试剂盒、TB GreenTMPremix Ex TaqTMII (Tli RNaseH Plus)试剂盒RT-PCR试剂盒RR047A TAKARA、QPCR试剂盒RR820A TAKARA:宝生物工程有限公司。
1.1.3 仪器
Varioskan FlashT多功能酶标仪:美国赛默飞世尔科技公司;超净工作 SW-CJ-1F型:苏州净化设备有限公司;倒置显微镜 CKX41SF:日本OLYMPUS公司;低速离心机 TD5A:湖南赫西仪器装备有限公司;96孔或24孔板台式离心机:上海安亭(TDL80-2B);CO2培养箱:日本SHELLAB;FA2004N型电子天平:上海精密科学仪器有限公司;Mastercyler ep realplex4型实时荧光定量PCR仪、AG 22331 Hamburg型PCR扩增仪、BioPhotometer plus型蛋白核酸分析仪:德国 Eppendorf公司;全自动凝胶成像系统:中国Tanon 2500。
1.2 方法
1.2.1 淋巴细胞悬液的制备
参考桑卡娜等[10]、马玉芳等[11]实验方法,颈椎脱臼法处死小鼠,将小鼠身体浸泡在75%酒精3 min消毒,注意不要将小鼠口鼻浸入酒精,将浸泡后的小鼠放在培养皿中移到无菌超净工作台内取出脾脏,放于盛有磷酸盐缓冲溶液(PBS)的平皿中冲洗干净,将脾脏用10 mL注射器拉杆柄尾部将其磨碎,使脾脏通过200目滤网浸入1640培养基中。收集全部的细胞悬液于离心管中吹匀,将离心机调整至1 500 r/min 4 ℃,离心5 min,将上清液弃去,使用移液枪将红细胞裂解液(Tris-NH4Cl)滴加3 mL至大离心管中吹匀重悬,静置5 min,离心5 min,弃去上清液,若离心管中仍存在红细胞,重复操作至红细胞完全裂解。加入适量 RPMI-1640完全培养基(胎牛血清3 mL,1640 27 mL,配成30 mL的完全培养基)重悬沉淀细胞,离心弃上清,取900 μL细胞悬液置于EP管内,加100 μL台盼蓝(Trypan Blue)溶液,染色计数细胞活力,混匀后,吸出少量混合液放在计数板上,在显微镜下倒置观察,调整直至细胞活力≥95%。用RPMI-1640完全培养液调整细胞密度为5×106个/mL,得到淋巴细胞悬液。
1.2.2 分组方式和分组处理
由于我国目前的司法改革主要以借鉴美国法律为趋势,而德国是较早且较为细致地将技术侦查法治化的国家[4],我国法律对上述问题并无明文规定,因此本文先介绍美国通讯监察法的相关规定,并与大陆法系的德国法进行比较,以便为我国立法及司法实务的运作提供参考,之后在详细分析我国刑事诉讼法有关该制度规定所存在的主要问题的基础上,提出构建偶然监听所得材料的证据能力规则的具体建议。
设置空白组,阳性对照组(左旋咪唑),大枣多糖组(终浓度为 20、40、80、160、320 μg/mL),空白组孔中加入RPMI 1640完全培养基,大枣多糖组加入不同浓度的大枣多糖溶液,阳性对照组加入左旋咪唑。
1.2.3 MTT法检测大枣多糖对淋巴细胞增殖的影响
参考张思哲等[12]实验方法,上述制备好的淋巴细胞悬液加到96孔板中,每组设置5个复孔,每孔 100 μL,将加入淋巴细胞的培养板置于37 ℃、5%CO2培养箱中培养2 h,2 h后加药。将96孔板置于 37 ℃、5%CO2培养箱中连续培养44 h,取出后,每孔加入20 μL MTT溶液(称取MTT 0.005 g,溶于1 mL PBS缓冲液中,摇匀至全部溶解,使其终浓度为 5.0 mg/ mL,0. 22 μm滤膜过滤除菌,20 ℃避光保存)。继续培养4 h,取出培养板将离心机调整至1 800 r/min 4 ℃离心10 min,弃去上清液,每孔加入150 μL DMSO溶液。振荡混匀,置于全自动酶标仪570 nm处检测OD值。结果以增殖指数(PI)的大小,表达小鼠淋巴细胞增殖含量,PI =(实验组OD值/对照组OD值)×100%
1.2.4 ELISA法检测大枣多糖对淋巴细胞分泌细胞因子的影响
参考Xie等[13]实验方法,上述制备好的淋巴细胞悬液加到24孔板中,每组设置3个复孔,每孔1 mL,置于37 ℃、5%CO2培养箱中,培养2 h后加1 mL不同浓度的大枣多糖溶液,空白组加入1 mL1640完全培养基,再培养48 h。将离心机调至1 500 r/min 4 ℃离心5 min,收集上清液。用ELISA法观察大枣多糖对淋巴细胞IL-2、IL-6、IL-10和IL-12 mRNA分泌的影响,按照试小鼠白细胞介素细胞因子剂盒说明书进行操作。
1.2.5 大枣多糖对 IL-2、IL-6、IL-10和 IL-12mRNA表达的影响
参考Pan L C等[14]实验方法,24孔细胞培养板,每孔加入1 mL淋巴细胞悬液,按1.2.2分组方式和分组处理。37 ℃ 5% CO2培养24 h。弃去上清液,用PBS清洗干净,每管加1 mL Trizol,使细胞完全裂解,换EP管,以12 000 r/min 4 ℃离心10 min,弃沉淀,每管加入200 μL三氯甲烷,用力上下颠倒,并剧烈摇晃震荡30 s,取出碎冰放在泡沫箱,冰浴10 min。调整离心机以12 000 r/min 4 ℃离心10 min,弃去上清液,加入500 μL的异丙醇,上下颠倒8次,放入盛有冰块的泡沫箱里,冰浴10 min,调整离心机以12 000 r/min,4 ℃离心15 min,仔细弃去上清液,将底部小部分沉淀物小心保留。加入1 mL 75%冰乙醇,上下颠倒混匀,调整离心机以12 000 r/min,4 ℃离心10 min,再弃去上清液后,置于室温下30 min。加入RNase-free水20 μL使沉淀溶解。取1 μL已经溶解好的RNA溶液,在超微量紫外或者可见分光光度计下调整波长为260/280 nm观察其吸光度A的比值,并将其total RNA的浓度记下,若比值在1.8~2.1之间,则表明提取的RNA未被污染,且质量好。
根据 NCBI基因库中相关基因序列,采用Primer 6引物设计软件设计,如表1所示。

表1 实验中小鼠IL-2、IL-6、IL10、IL-12和内参ACTB引物序列Table 1 Mouse IL-2,IL-6,IL-10,IL-12 and internal reference ACTB primer sequences in the Experiment
采用TB GreenTMPremix Ex TaqTMII (Tli RNaseH Plus)试剂盒的说明配制反应体系:2×TB Green Premix Ex Taq II 12.5 μL,引物为 2 μL,cDNA 模板 2 μL,灭菌水为 8.5 μL,总共 25 μL,混合均匀,进行Real time PCR反应,采用扩增试剂盒的程序,将仪器调整为预变性95 ℃ 30 s,变性95 ℃ 5 s,退火60 ℃ 30 s ,调整为40个循环。以ACTB作为内参,扩增完后按照2-ΔΔCt方法进行数据分析从而得到目的基因的相对表达量。
1.2.6 统计学分析
按照(平均数±标准差)表示数据结果。应用SPSS 20.0统计软件分析实验结果,数据用(x‾±s)表示,按照单因素方差分析进行观察,用LSD法表达其显著性,检验水准α=0.05,α=0.01。
2 结果与分析
2.1 大枣多糖对淋巴细胞增殖的影响
由表 2可知,与空白组相比,阳性对照组淋巴细胞指数显著升高(P<0.01),说明淋巴细胞在阳性对照组的加入后,增殖量有所提升;与空白组相比,大枣多糖处理组淋巴细胞指数呈现上升趋势(P<0.01),说明大枣多糖能够刺激淋巴细胞增殖,当大枣多糖浓度在20~160 μg/mL时,淋巴细胞增殖指数随大枣多糖浓度升高出现显著上升趋势,表现出一种良好的剂量-效应关系;当大枣多糖浓度到达320 μg/mL时,淋巴细胞指数反而显著下降,说明大枣多糖对淋巴细胞增殖呈双向调节作用。与阳性对照组相比,大枣多糖为20、40、80、320 μg/mL浓度组淋巴细胞指数显著降低(P<0.01),当大枣多糖浓度为160 μg/mL时,淋巴细胞指数不存在统计学意义(P>0.05)。
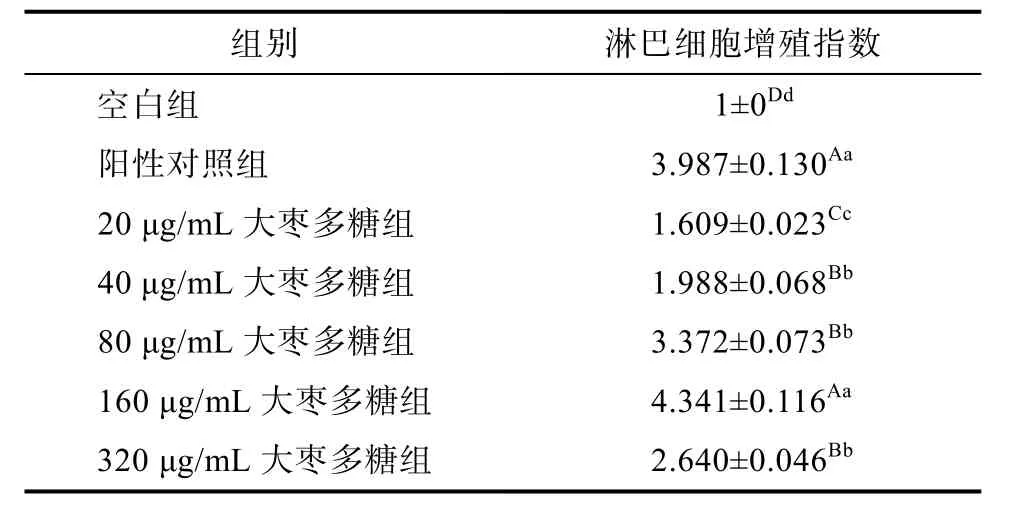
表2 大枣多糖对淋巴细胞增殖的影响(x‾±s,n=5)Table 2 Effect of jujube polysaccharide on lymphocyte proliferation (x‾±s, n=5)
2.2 大枣多糖对淋巴细胞分泌细胞因子的影响
由表3可知,与空白组相比,IL-2、IL-6、IL-10、IL-12的阳性对照组分泌量显著升高(P<0.01),说明阳性对照组能够诱导细胞因子分泌;与空白组相比,大枣多糖浓度组中细胞因子分泌量呈现上升趋势(P<0.01),说明大枣多糖能够诱导细胞分子分泌;当大枣多糖浓度组在20~160 μg/mL范围时,淋巴细胞的分泌量随大枣多糖浓度组浓度的升高呈现上升趋势,表现出一种良好的剂量-效应关系;当大枣多糖浓度到达320 μg/mL时,淋巴细胞分泌量反而下降,由此可以说明,大枣多糖对诱导细胞因子分泌呈现双向调节作用。与阳性对照组相比,当大枣多糖浓度为 160 μg/mL时,细胞因子分泌量不存在统计学意义(P>0.05),其余各浓度组均存在统计学意义(P<0.01)。
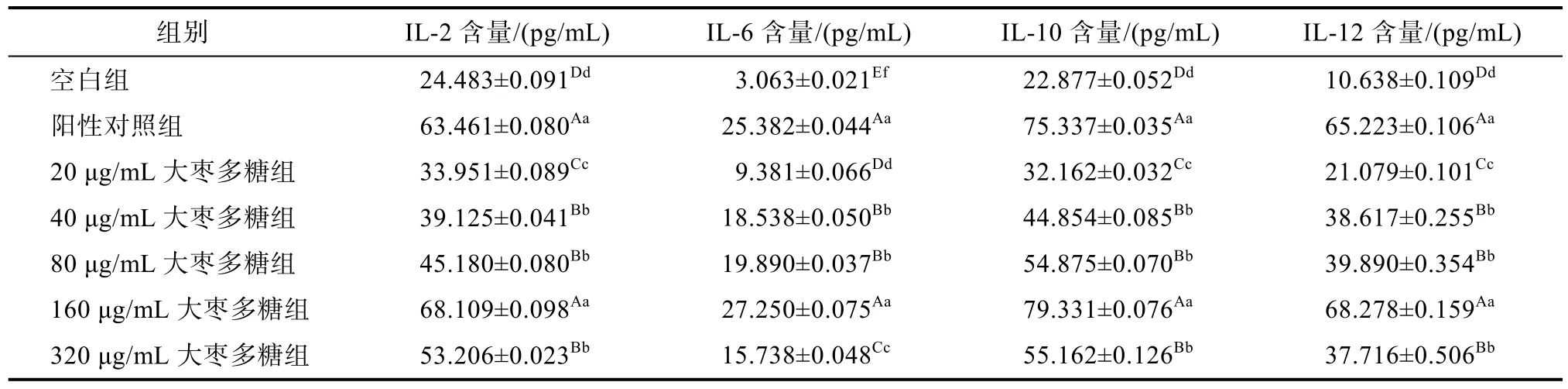
表3 大枣多糖对淋巴细胞IL-2、IL-6、IL-10和IL-12分泌的影响(x‾±s,n=5)Table 3 Effect of jujube polysaccharide on the secretion of IL-2、IL-6、IL-10、IL-12in lymphocytes (x‾±s, n=5)
2.3 大枣多糖对淋巴细胞IL-2、IL-6、IL-10和IL-12mRNA的影响
由表4可知,IL-2、IL-6、IL-10、IL-12与空白组相比,阳性对照组细胞因子mRNA表达显著升高(P<0.01),由此说明,阳性对照组通过增加细胞因子mRNA表达量调节,促进细胞因子的分泌。与空白组相比,大枣多糖浓度组细胞因子mRNA表达显著升高(P<0.01),由此说明,大枣多糖通过增加细胞因子mRNA表达量调节,促进细胞因子分泌。当大枣多糖的浓度在 20~160 μg/mL时,细胞因子mRNA表达量随大枣多糖浓度的升高出现上升的趋势,表现出一种良好的剂量-效应关系;当大枣多糖浓度达到320 μg/mL时,细胞因子mRNA表达量反而下降,说明大枣多糖对诱导淋巴细胞细胞因子mRNA表达量呈双向调节作用。与阳性对照组相比,大枣多糖浓度为160 μg/mL时,细胞因子 mRNA表达量不存在统计学意义(P>0.05),其余各浓度组都存在统计学意义(P<0.01)。

表4 大枣多糖对淋巴细胞IL-2、IL-6、IL-10和IL-12 mRNA的影响(n=5)Table 4 Effect of jujube polysaccharide on IL-2、IL-6、IL-10 and IL-12 mRNA of lymphocytes (n=5)
3 讨论
3.1 大枣多糖对淋巴细胞增殖的影响
本实验研究表明,大枣多糖浓度在 20~320 μg/mL范围内,对小鼠淋巴细胞体外增殖具有促进作用,当大枣多糖浓度为160 μg/mL时效果最佳,与阳性对照组差异不显著;有效提高小鼠淋巴细胞增殖的能力。众所周知,脾脏是动物机体重要的外周淋巴器官,脾脏免疫功能的正常发挥与其生长发育和组织结构密切相关,脾脏是由大量的淋巴细胞组成的[15],因此,可以说脾脏生长发育的优劣取决于脾脏内淋巴细胞的增殖和凋亡。本实验中,大枣多糖可以使小鼠的淋巴细胞增值率显著提升,淋巴细胞增殖产生效应淋巴细胞,清除非己抗原,提高机体免疫功能。机体的系统免疫中淋巴细胞增殖是机体对非己抗原刺激产生免疫应答过程中的关键一步。淋巴细胞增殖效果决定了机体免疫应答反应的强度,反应机体的细胞免疫状态[16]。
3.2 大枣多糖对淋巴细胞 IL-2、IL-6、IL-10和IL-12分泌及mRNA表达的影响
机体的免疫细胞可以通过分泌细胞因子来发挥免疫作用,本研究主要测定了淋巴细胞几个重要细胞因子 IL-2、IL-6、IL-10、IL-12的分泌。大枣多糖可浓度依赖性增加淋巴细胞中细胞因子IL-2的浓度,作用于免疫细胞,包括T细胞、大颗粒淋巴细胞、单核细胞、B细胞等,促进细胞增殖和分泌细胞因子以及Th0和CTL的增殖。研究发现菜籽多糖体外可促进小鼠脾淋巴细胞IL-2、IL-4、IL-6、IFN-γ m RNA 的表达[17]。大枣多糖可使淋巴细胞分泌细胞因子IL-6水平成浓度依赖性升高,诱导B细胞分化产生免疫球蛋白,促进T细胞增殖生长,增强血细胞的分化及其抗瘤效应,促进骨髓造血干细胞增殖,IL-6可以上调STAT3介导的维甲酸,促进CD4+幼T细胞向Th17细胞转化[18]。大枣多糖可浓度依赖性增加淋巴细胞中细胞因子IL-10的浓度,对于T细胞、NK细胞、B细胞、单核巨噬细胞和肥大细胞起抑制作用,为T细胞发育的辅动生长因子、刺激抗体激活 B细胞快速生长和分化,T细胞产生的IL-10可以作为抗炎因子,在疾病中发挥其抗炎镇静作用,黄芪多糖可抑制高糖状态下HMCs细胞过度增殖,下调高糖状态下HMCs细胞IL-8 mRNA及蛋白的表达,上调IL-l0 mRNA及蛋白的表达,可能通过减轻炎症反应对 DN肾脏起到保护作用[19]。大枣多糖可浓度依赖性增加淋巴细胞中细胞因子IL-12的浓度,诱导受刺激的T细胞增殖,与IL-2 有协同作用,增加NK细胞活性,促进T辅助细胞1(TH1)的增殖,IL-12促进Th0向Th1分化,IL-12在诱导时产生 Th1,使 Th2转化为Th1,在Th细胞亚群的平衡中起着关键性作用,中药复方多糖能不同程度的促进各 MHC B-LβⅡ基因型IL-2、IL-4、IL-12 mRNA的表达[20]。本实验研究发现大枣多糖的浓度依赖性增加淋巴细胞中的 IL-2、IL-6、IL-10、IL-12的浓度,通过调控 IL-2、IL-6、IL-10、IL-12 mRNA表达,最终达到细胞因子的分泌量,提高机体免疫功能。
4 结论
大枣多糖在小鼠淋巴细胞体外免疫活性中起着重要的作用,大枣多糖在 20~320 μg/mL范围内,小鼠淋巴细胞体外增殖显著增加,通过上调IL-2、IL-6、IL-10、IL-12 mRNA表达量实现免疫活性的提高,促进IL-2、IL-6、IL-10和IL-12细胞因子的分泌,增强了机体的免疫功能,更好的保障人类的健康。
