一株红霉素降解菌的筛选、鉴定与降解特性
2021-01-28许双燕水贤磊郑华宝
许双燕,张 涛,张 成,2,林 辉,水贤磊,郑华宝,2,*
(1.浙江农林大学 环境与资源学院,浙江 杭州 311300; 2.浙江省土壤污染生物修复重点实验室,浙江 杭州 311300; 3.浙江省农业科学院 环境资源与土壤肥料研究所,浙江 杭州 310021)
抗生素是一种低到中分子量的化合物,具有多种化学和生物学特性,可用来治疗细菌感染。抗生素现已广泛应用于规模化畜禽养殖,包括四环素类[1]、磺胺类[2]、氟喹诺酮类[3]、大环内酯类[4]、氨基类等[5]。我国每年约生产21万t抗生素,约占世界总量的60%,涉及36种抗生素化合物,其中过半的抗生素被用于养殖业。据报道,养殖业大约90%的抗生素都是在亚治疗浓度下使用的,其中70%是为了预防疾病,30%是为了促进生长[6-7]。养殖业中过剩的抗生素主要通过排泄物、污水灌溉和污泥堆肥等途径直接和间接地排放进入环境[8-10]。环境中的抗生素残留不仅会改变环境微生物的群落结构和丰度,还会影响微生物群落的正常功能[11-12]。长期接触低毒性和亚毒性的抗生素,可改变微生物生态,促进抗生素耐药性细菌的发展和传播[13-14]。另外,抗生素甚至可以通过食物链途径直接威胁人类健康[15-16]。目前,环境中的抗生素微量污染、耐药菌,及抗性基因的存在和传播已经演变成全球性问题。
当前,养殖业废弃物资源化的过程中普遍采用好氧高温堆肥、厌氧发酵等技术消减粪便中残留的抗生素、病原菌和虫卵。我国养殖业规模普遍较小且分散,这就使得我国畜禽抗生素污染呈现出分布广、易积累扩散和环境生态风险大的特点。如果养殖业废弃物未能得到科学的处理,很容易造成大面积的农业面源污染问题。
近年来,利用微生物降解抗生素的方法受到越来越多的关注[17-18]。红霉素属于大环内酯类抗生素,具有很强的抗菌作用,应用广泛,而且是一种多组分抗生素,临床上主要应用红霉素A,其化学结构由具有14元环的红霉内酯(erythronolide)、脱氧氨基乙糖(desosamine)和红霉糖(cladnose)3部分组成。红霉素结构稳定,很难通过水解或光解等自然降解途径去除,易在环境中不断积聚,达到一定浓度后会抑制植物生长,特别不利于农作物的生长,甚至会影响农作物的产量[19]。但因为红霉素药效好、成本低,现已广泛应用于水产养殖业。研究发现,在鱼体组织中脱水红霉素的残留量明显高于其他抗生素,其残留质量分数在9.8~20 ng·g-1,且在虾塘底泥和水体中均存在一定比例的红霉素耐药细菌[20-21]。来自孟加拉国、印度、印度尼西亚等地的研究报告显示,在海产养殖水中也可检测到红霉素,其质量浓度达到180 ng·L-1[22]。在一些养殖场周围和污水处理池中,红霉素残留的质量浓度高达6 mg·L-1[23]。在自然界的生态系统中,微生物与微生物的相互作用和它们对有机污染物的共代谢,可加快或促进有机污染物的降解速度[24];因此,利用微生物对各类有机污染物进行降解和转化极具潜力。现有的处理工艺,如曝气生物滤池[25],只能消减废水中的微量红霉素,若要更有效地降解环境中的红霉素残留,还要依靠特定的微生物[26-27]。因此,生产中亟需筛选到可有效降解红霉素的微生物,并投入使用。有研究发现,红酵母属的黏性红圆酵母(Rhodotorulasp.)在适宜条件下对红霉素的降解率可以达到100%[28]。但是,目前国内外针对红霉素等大环内酯类抗生素造成的污染,筛选红霉素降解菌进行治理的报道甚少,已经报道的菌种资源也非常有限,极大地阻碍了红霉素污染微生物修复技术的应用,也限制了对红霉素降解酶、降解途径等的阐明[28-29]。本研究以长期堆放鸡粪的有机肥生产车间土壤为材料,经多次驯化,筛选到一株能够以红霉素作为唯一碳源的高效降解菌株Ery-6,并对其降解特性进行系统研究,以期为红霉素污染的微生物修复提供菌种资源,为阐明微生物降解红霉素的分子机制提供物质基础。
1 材料与方法
1.1 试验材料
UltiMate 3000型高效液相色谱仪(HPLC,美国赛默飞世尔公司),配DAD(二极管阵列)检测器;XTERRA RP C18色谱柱(250 mm×4.6 mm,5 μm),美国Waters公司;UV-5100型紫外分光光度计,上海元析仪器有限公司;THZ-98AB型摇床,上海一恒科学仪器有限公司;DHP-9082型恒温培养箱,沙鹰科学(上海)仪器有限公司;YXQ-50SIⅠ型高压灭菌锅,上海博迅医疗生物仪器股份有限公司;DS-5510DTH型超声波清洗机,上海生析超声仪器有限公司;Mini-15K型高速离心机,杭州奥盛仪器有限公司;YR-PTB型真空泵,上海亚荣生化仪器厂;0.22 μm针筒式微孔滤膜,天津市津腾实验设备有限公司。
红霉素(纯度98%),上海源叶生物科技有限公司;乙腈(色谱纯)、甲醇(色谱纯),德国Tedia公司;磷酸二氢铵(分析纯),上海麦克林生化科技有限公司。其余化学药品均为分析纯试剂。试验用水系由哇哈哈纯净水经Milli-Q型超纯水机(美国Millipore公司)制备的超纯水(18.2 MΩ·cm)。
无机盐液体培养基:NH4Cl 1 g,KH2PO40.5 g,K2HPO41.5 g,MgSO40.2 g,NaCl 1 g,微量元素溶液(每1 L溶液中含FeCl31.6 g、CoCl2·6H2O 0.1 g、MnCl2·4H2O 0.425 g、ZnCl20.05 g、NiCl2·6H2O 0.01 g、CuSO4·5H2O 0.015 g、H3BO30.05 g、Na2MoO4·2H2O 0.01 g、CaCl20.05 g)2 mL,加超纯水至1 000 mL,调节pH值至7.0,121 ℃灭菌30 min。
1.2 试验方法
1.2.1 菌株驯化、分离和纯化
以Qian等[26]报道的浙江省有机肥中抗生素残留现状为依据,选择浙江省德清县某有机肥生产车间为红霉素降解菌筛选来源,采集该有机肥生产车间内长期堆放鸡粪的场地土壤开展后续菌株驯化分离工作,具体步骤如下。在装有100 mL无机盐液体培养基的锥形瓶中加入10 g土壤,同时加入红霉素50 mg·L-1、酵母膏0.2 g、葡萄糖0.1 g,30 ℃、120 r·min-1振荡培养3 d;补加100 mg·L-1红霉素,30 ℃、120 r·min-1振荡培养3 d;补加100 mL无机盐液体培养基和100 mg·L-1红霉素,30 ℃、150 r·min-1振荡培养3 d;补加100 mg·L-1红霉素,30 ℃、120 r·min-1振荡培养3 d。经过4轮驯化后的菌液,以10%的接种量接入装有5 mL无机盐液体培养基的试管中,并以梯度压力式驯化法继续驯化,红霉素质量浓度依次为100、200、300、400、500、600、800、900、1 000 mg·L-1,以红霉素为唯一碳源,在30 ℃、120 r·min-1条件下避光培养48 h。取驯化后的菌液,接种于含有对应红霉素质量浓度的无机盐固体培养基,放入30 ℃恒温培养箱中避光培养48 h,观察生长情况,挑取单菌落,接种至含1 000 mg·L-1红霉素的无机盐固体培养基,经过4次分离纯化,得到纯培养的菌株。
1.2.2 菌株鉴定
观察菌落形态,包括菌株在平板上生长的形态、光泽、大小等。挑取对数生长期的菌株,送至浙江省农业科学院测试中心进行电子显微镜观察,对菌株个体形态做进一步完善。同时,挑取对数期菌株进行16S rDNA基因序列分析,以细菌总DNA为模版,利用细菌16S rDNA通用引物(正向引物27F,5′-AGA GTT TGA TCC TGG CTC AG-3′;反向引物1492R,5′-TAC GGC TAC CTT GTT ACG ACT T-3′)进行PCR扩增。反应体系25 μL:模版DNA 2 μL,通用引物27F和1492R各5 μL,Taq酶 0.2 μL,10×TaqBuffer缓冲液(含Mg2+)2.5 μL,dNTPs(各2.5 mmol·L-1)2 μL,ddH2O 8.3 μL。PCR反应条件:94 ℃预变性10 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃延伸5 min。扩增产物经1%琼脂糖凝胶电泳检测后送至有康生物工程有限公司进行测序。将所得序列通过BLAST程序与GenBank中的已知序列进行同源性分析比较,确定与该红霉素降解菌同源程度最高的序列。基于获得的该菌株的16S rDNA片段序列(1 392 bp),利用Mega 7.0软件对该菌株及其近缘属种进行遗传距离分析,采用邻接法构建系统发育进化树。
1.2.3 生长曲线与菌体对红霉素吸附量的测定
将分离纯化后的菌株接种至含100 mg·L-1红霉素的无机盐液体培养基中,30 ℃、120 r·min-1条件下进行培养,于不同时间取样,采用分光光度法在600 nm波长下测定菌液的D600值,确定菌株的生长曲线。将菌株灭活后,加入含100 mg·L-1红霉素的无机盐液体培养基中,振荡培养6 h,分别在0、6 h测定红霉素含量,以确定菌株本身对红霉素的吸附量。
需指出,并非所有乘坐慢车的乘客均会延误时间,仅为越过慢车待避车站的乘客才会延误时间(约3 min)。被耽搁的客流量可由到达避让站前的区间断面流量减去避让站的下客量得出。以远期早高峰为例,根据运行图铺画结果显示,远期早高峰慢车需在白芒站、罗租站、同观路站、东周路站、长春北站待避,每趟慢车在上述避让站待避的概率为1/3,远期早高峰慢车效益预测如表4所示[3]。由表4可知,远期早高峰慢车延误时间约3 276.5 h。按照上述方法计算,远期晚高峰、平峰延误时间分别增加2 967.35 h、12 337 h,可得到慢车全日延误时间为1.86万h。
1.2.4 菌株对红霉素的降解特性分析
采用单因素试验,将分离纯化后的菌株按照5%(体积分数)的接种量接种于含有不同质量浓度(分别设置10、50、100、200、400、800、1 000 mg·L-1和10、30、50、70、90、110 mg·L-12个区间)红霉素、温度(20、25、30、35、40、45 ℃)、转速(100、120、140、160、180、200 r·min-1)、pH值(5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5)、外加碳氮源(50 mg·L-1的葡萄糖、蔗糖、酵母膏或蛋白胨)、金属离子(10 mg·L-1的Fe3+、Ca2+、Mg2+、Zn2+、Cu2+、Mn2+)等条件下进行培养,测定培养基中红霉素的残留量。每个处理均设置1个不接菌的对照和3个重复。
1.3 红霉素含量检测
红霉素含量采用液相色谱法进行检测,流动相A相为0.02 mol·L-1的pH值3.0的磷酸二氢铵、B相为乙腈,洗脱程序详见表1,流速为1 mL·min-1,柱温35 ℃,进样量20 μL,检测波长210 nm。根据构建的线性回归方程测算样品中红霉素的含量,并采用以下公式计算红霉素降解率:
降解率(%)=(对照样品残留量-试验样品残留量)/对照样品残留量×100。
1.4 数据分析
采用Excel 2013和GraphPad Prism 5.0软件进行数据整理和图表绘制,应用SPSS 22.0进行单因素方差分析,对有显著(P<0.05)差异的,采用最小显著差法(LSD)进行检验。
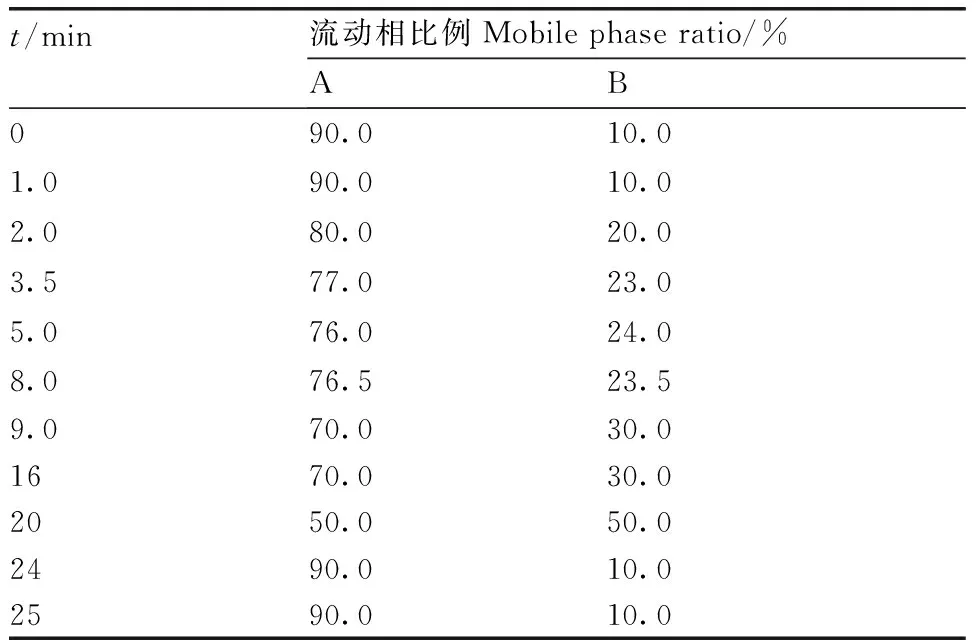
表1 液相色谱测定红霉素时的梯度洗脱程序
2 结果与分析
2.1 菌种鉴定
经过多重驯化分离和富集筛选,得到一株能够降解高浓度红霉素的菌株Ery-6。其菌落形态(图1-A)呈圆形,直径2~3 mm,乳白色,不透明,表面光滑、湿润,且边缘整齐。在透射电镜下观察菌株形态(图1-B)发现,该菌以鞭毛运动,无芽孢。该菌株的系统发育进化树如图1-C所示。Ery-6与甲基菌属(Methylobacillussp.)的模式菌株位于进化树的同一类群,结果显示,Ery-6与甲基菌属菌株MethylobacillusflagellatusKT(NC 007947.1)的亲缘关系最近。结合细菌表型特征,将菌株Ery-6鉴定为甲基菌属。
2.2 Ery-6菌株的生长曲线及其对红霉素的降解动力学
测定Ery-6菌株在含有100 mg·L-1红霉素的无机盐液体培养基中的生长曲线,结果如图2-A所示,0~14 h为菌株的生长迟缓期,14~60 h菌株进入对数生长期,60 h后进入稳定期。
Ery-6菌株对红霉素的吸附试验结果显示,0 h液体培养基中的红霉素质量浓度为97.52 mg·L-1,6 h后红霉素质量浓度为96.08 mg·L-1。这说明,菌体本身对红霉素的吸附量很少。在试验条件下,Ery-6菌株对红霉素的降解动力学曲线如图2-B所示。菌株对红霉素的降解率随培养时间延长而增加,在0~48 h快速增长,最大降解率达74.10%,之后趋于平稳。采用准一级动力学方程拟合接菌和不接菌条件下的红霉素降解过程(表2),决定系数(R2)均在0.9以上,说明拟合度较好。从拟合结果看,红霉素的自然降解较弱,接种Ery-6菌株可大幅提高红霉素的降解速率,使其半衰期缩短一半以上。
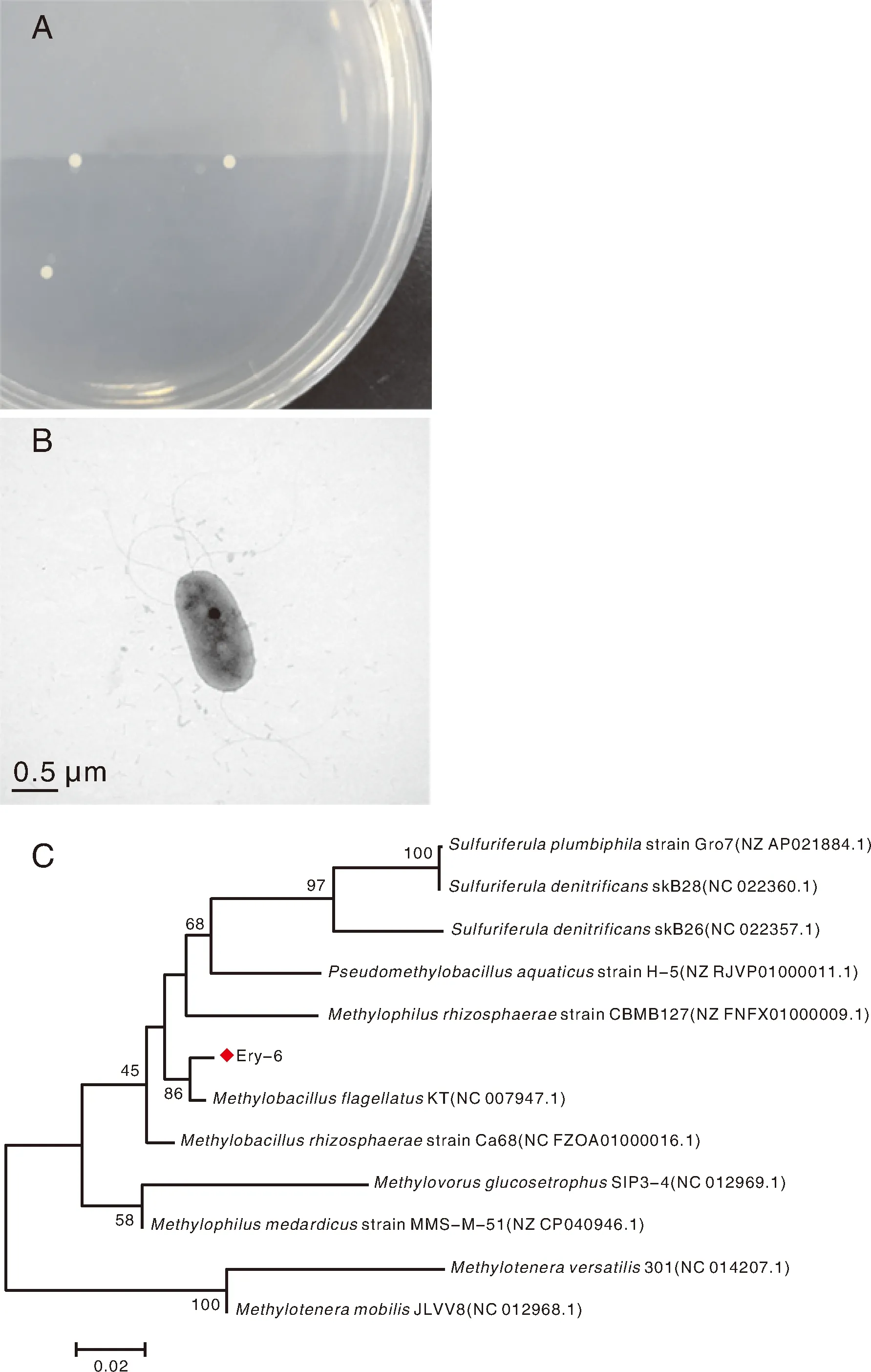
图1 Ery-6的菌落形态(A)、透射电镜图(B)和系统发育树(C)Fig.1 Colony morphology (A), transmission electron microscopy (B) and phylogenetic tree (C) of Ery-6 strain
2.3 环境因素对Ery-6菌株降解红霉素的影响
2.3.1 红霉素质量浓度
将Ery-6菌株按照5%(体积分数)的接种量接种于含有不同质量浓度红霉素(底物)的无机盐液体培养基中,设置初始条件为30 ℃、pH 7.0、120 r·min-1,振荡培养48 h。如图3所示,当红霉素质量浓度为90~200 mg·L-1时,菌株对红霉素的降解效果最明显。在该范围内,菌株的D600值均大于1,当红霉素的质量浓度过低或过高时均会抑制菌株的生长。测算单位菌量对红霉素的去除量,发现不同质量浓度红霉素条件下相差不大。这说明,在一定程度上,不同质量浓度的红霉素是通过影响菌体生长从而影响红霉素降解的。当红霉素质量浓度达到1 000 mg·L-1时,红霉素降解率为31.95%,说明Ery-6菌株可以在高浓度红霉素条件下生存,并产生可观的降解效果。
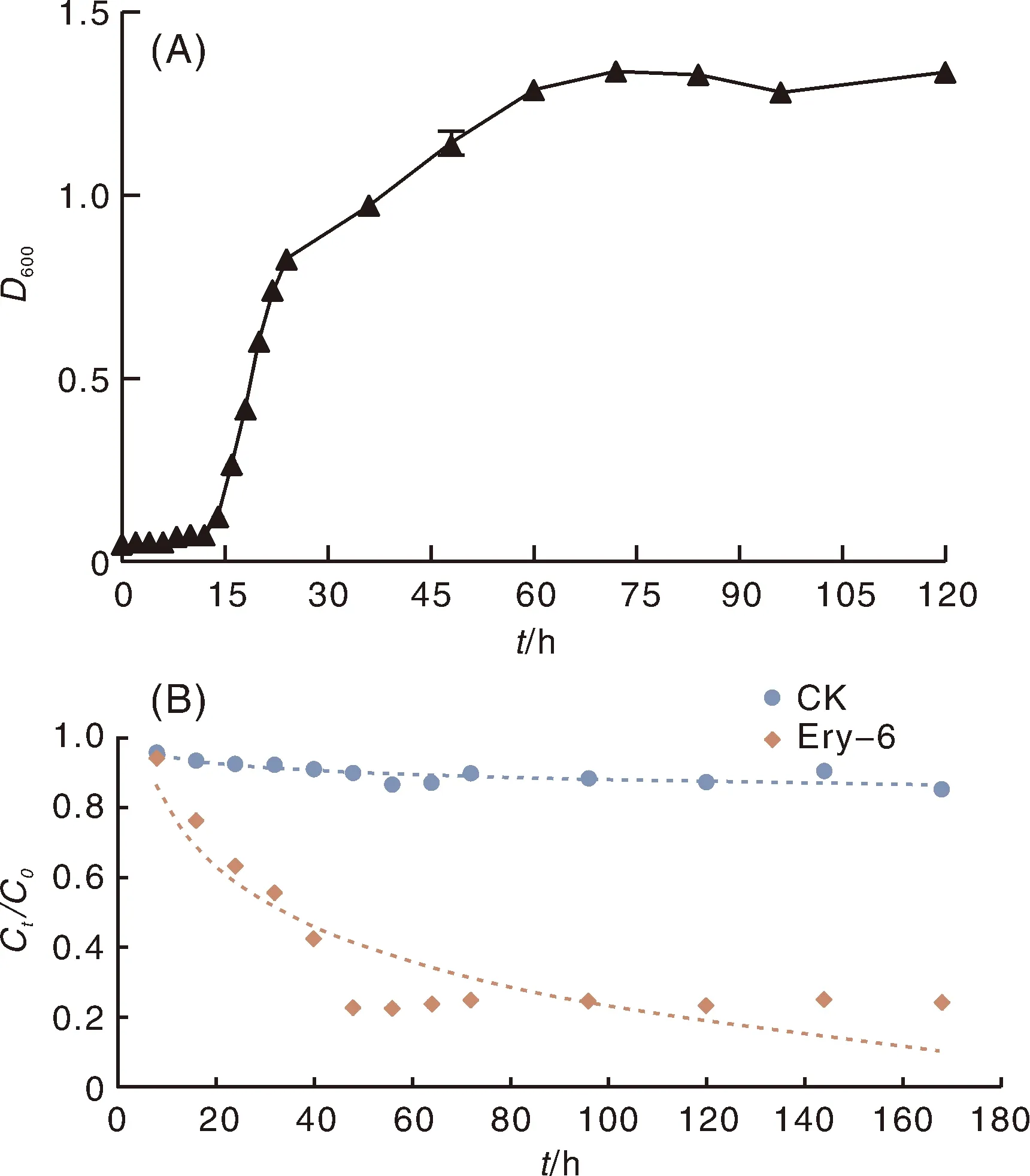
Ct/C0为t时体系中红霉素质量浓度与初始红霉素质量浓度之比。CK为不加菌的对照。Ct/C0 was the ratio of erythromycin concentration at t time to the initial concentrution.CK, Control withow Ery-6 strain inoculation.图2 Ery-6菌株的生长曲线(A)和对红霉素的生物降解动力学曲线(B)Fig.2 Growth curve (A) and biodegradation kinetic curve (B) of Ery-6 strain

表2 红霉素降解的动力学方程与动力参数
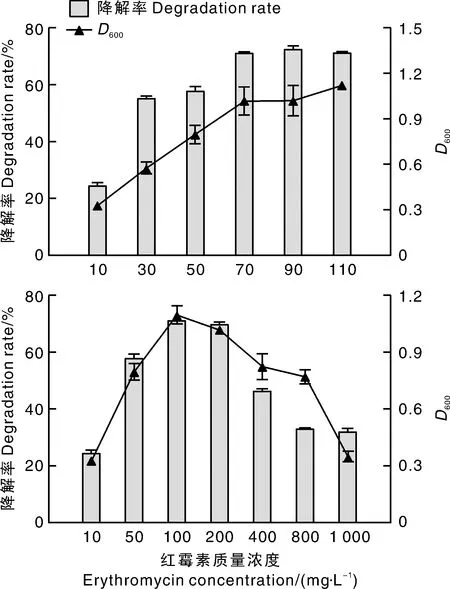
图3 初始红霉素质量浓度对Ery-6菌株降解红霉素的影响Fig.3 Effect of initial erythromycin concentration on erythromycin degradation by Ery-6 strain
2.3.2 温度
按照5%(体积分数)的接种量将菌株接种到含100 mg·L-1红霉素的无机盐液体培养基中,在pH 7.0、120 r·min-1的条件下振荡培养48 h。如图4所示,菌液的D600与红霉素降解率变化趋势相近。当温度为30~35 ℃时,菌液的D600在1以上。总的来看,该菌株最适宜生长的温度为35 ℃。在此条件下,红霉素降解率为79.59%。测算单位菌量对红霉素的去除量可知,当温度在30 ℃以上时,红霉素降解率受菌体生长量的影响较大;在20~25 ℃,菌液的D600值较低,但红霉素降解率却能达到65%左右,说明此时菌的生长情况对降解率的影响较小。
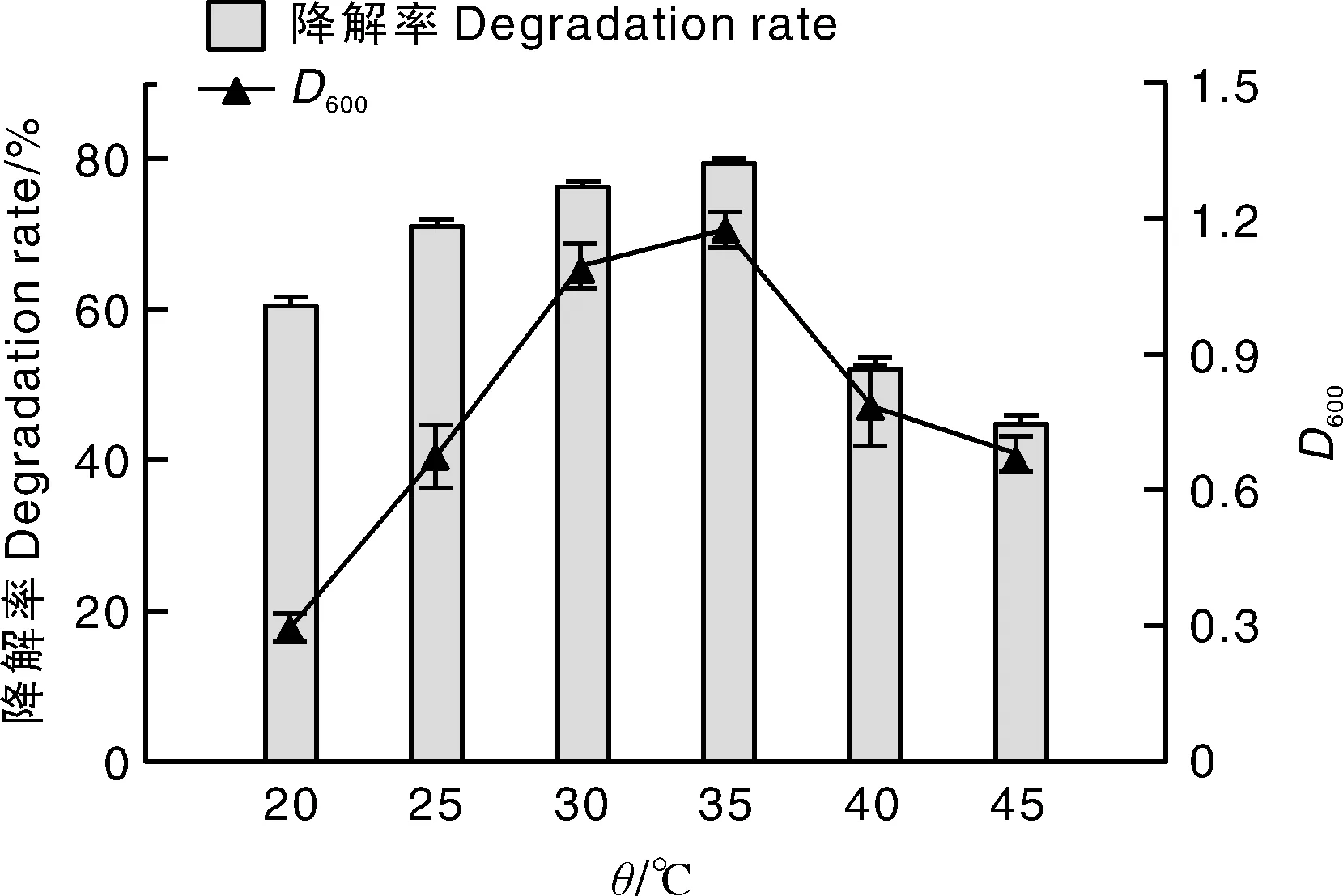
图4 温度对Ery-6菌株降解红霉素的影响Fig.4 Effect of temperature on erythromycin degradation by Ery-6 strain
2.3.3 转速
将Ery-6菌株按照5%(体积分数)的接种量接种于含有100 mg·L-1红霉素的无机盐液体培养基中,在最适温度35 ℃,pH 7.0的条件下按照不同的摇床转速振荡培养48 h。如图5所示,发现红霉素降解率变化与菌株的生长量曲线趋同,各转速下单位菌量对红霉素的去除量相近,说明转速通过影响菌的生长情况而作用于红霉素降解率。当转速为120 r·min-1时,菌液的D600值最大,红霉素降解率最高(79.17%)。
2.3.4 初始pH值
按照5%(体积分数)的接种量将菌株接种到含100 mg·L-1红霉素的无机盐液体培养基中,在最适温度35 ℃和最适转速120 r·min-1的条件下,调节pH值分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5,振荡培养48 h。如图6所示,当初始pH值为5.5~7.5时,该菌株均能有效降解红霉素,且降解效果以中性条件下最佳,降解率达79.91%。此时,菌株的生长量也最大。当初始pH值低于5.5时,菌液的D600值小于0.4,说明菌株生长受到抑制,但此时红霉素仍有一定的降解率。推测是因为红霉素偏碱性,遇酸易分解。Ery-6菌株对碱性环境较敏感,当初始pH值为8.5时,菌株几乎不生长,对红霉素的降解率也仅为7.32%。
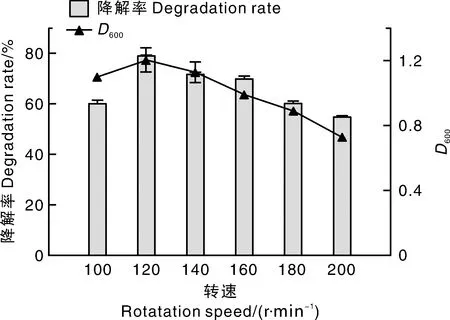
图5 转速对Ery-6菌株降解红霉素的影响Fig.5 Effect of rotation speed on erythromycin degradation by Ery-6 strain
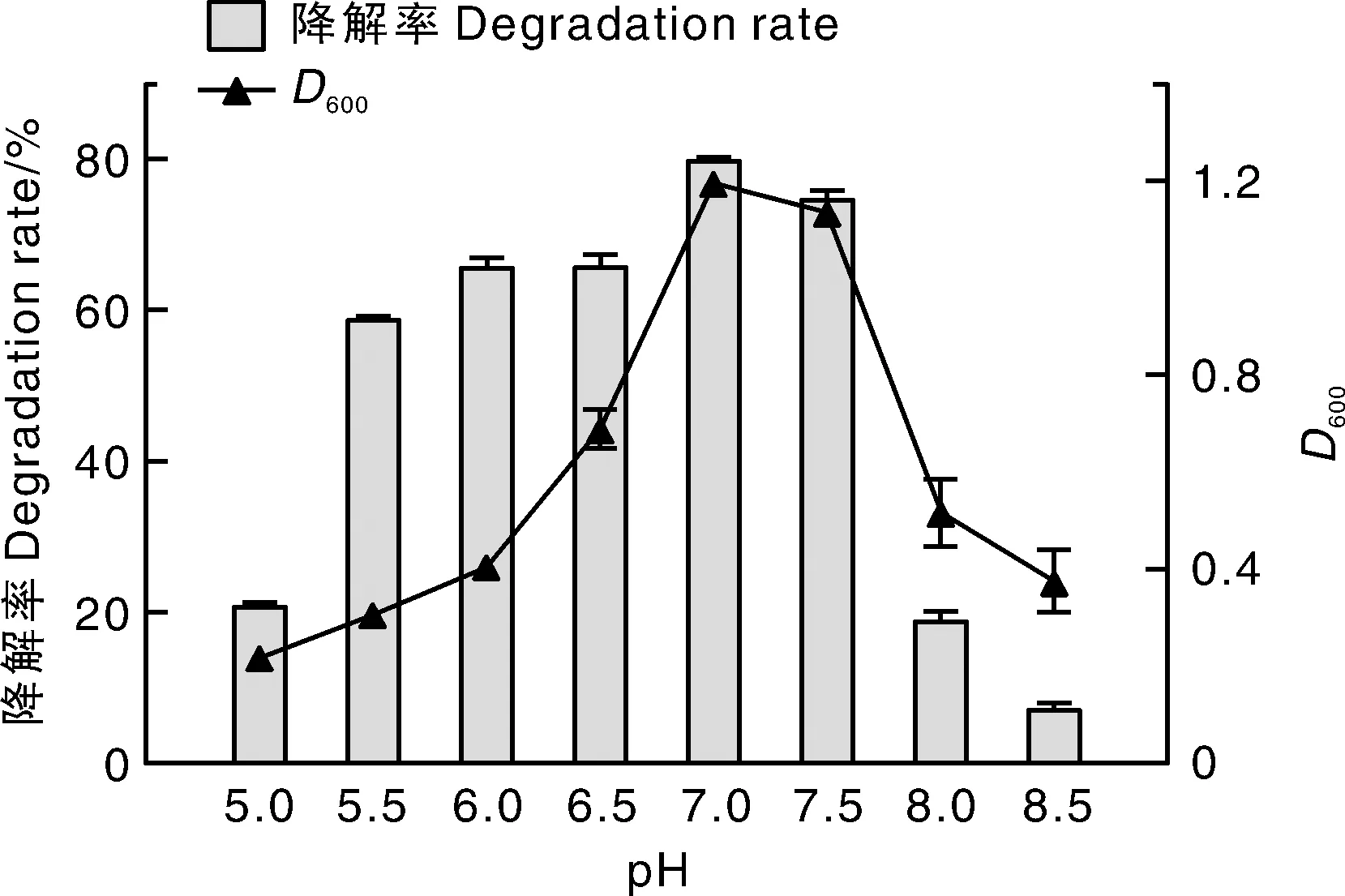
图6 初始pH值对Ery-6菌株降解红霉素的影响Fig.6 Effect of initial pH on erythromycin degradation by Ery-6 strain
2.3.5 外加碳氮源
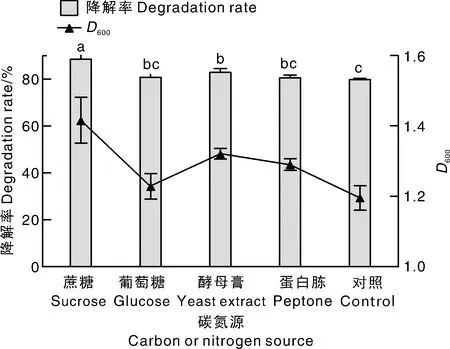
柱上无相同字母的表示处理间差异显著(P<0.05)。下同。对照中不外源添加碳氮源。Bars marked without the same letters indicated significant difference at P<0.05. The same as below. No exogenous carbon or nitrogen source was added in the control.图7 外源添加碳氮源对Ery-6菌株降解红霉素的影响Fig.7 Effect of exogenous carbon or nitrogen source on erythromycin degradation by Ery-6 strain
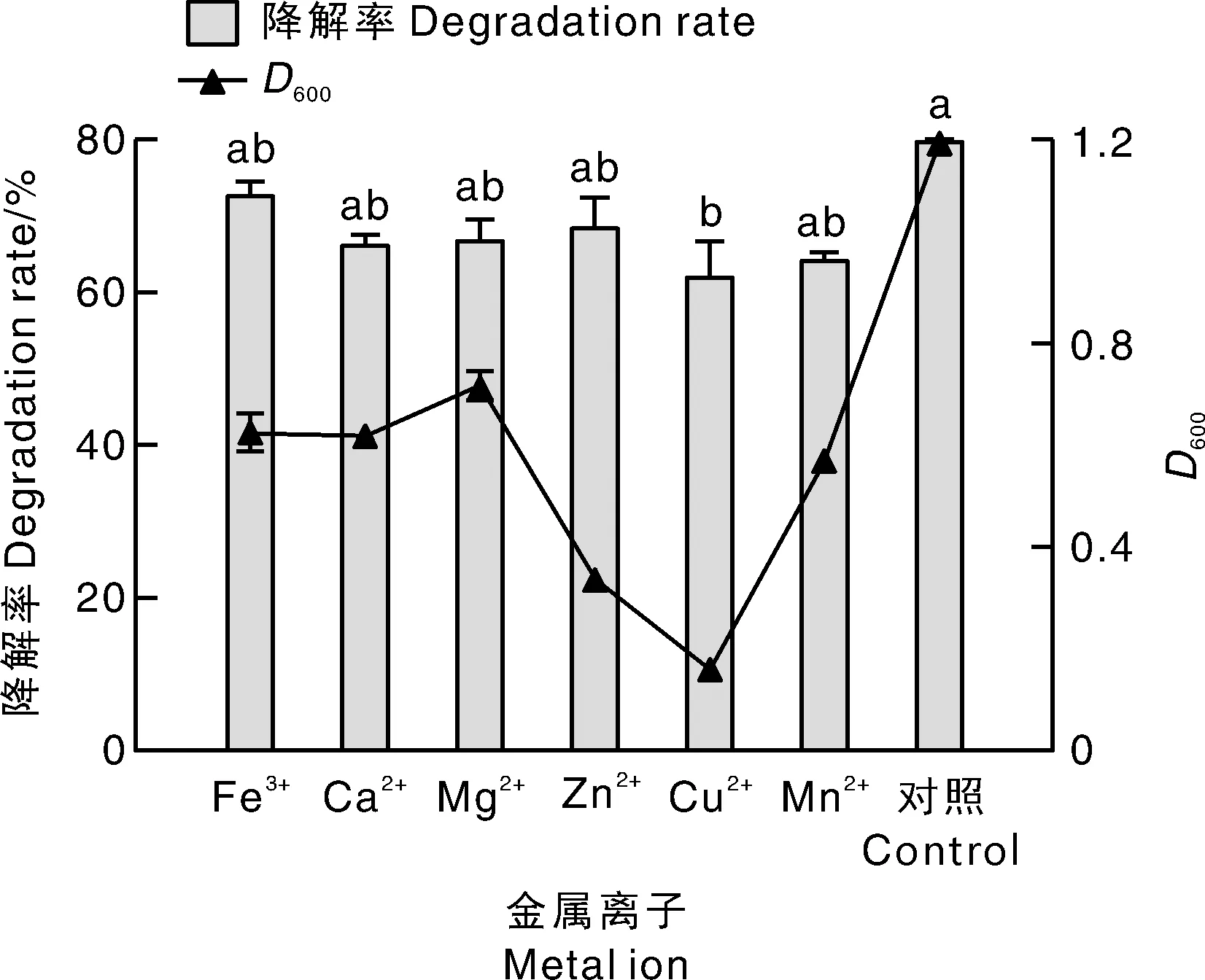
对照中不外源添加金属离子。No exogenous metal ion was added in the control.图8 外加金属离子对Ery-6菌株降解红霉素的影响Fig.8 Effect of exogenous metal ions on erythromycin degradation by Ery-6 strain
按照5%(体积分数)的接种量将菌株接种到含100 mg·L-1红霉素的无机盐液体培养基中,向培养基中分别加入50 mg·L-1的葡萄糖、蔗糖、酵母膏、蛋白胨作为外加碳氮源,在35 ℃、pH 7.0、120 r·min-1的条件下振荡培养,48 h后测定红霉素含量。由图7可知,添加不同碳氮源对红霉素的降解率有显著影响,含有蔗糖或酵母膏的处理的红霉素降解率显著(P<0.05)高于不外源添加碳氮源的对照。当外源添加蔗糖时,红霉素降解率最高,达到88.68%。同时,菌液的D600值达到1.4,高于对照。测算单位菌量的红霉素去除率可知,外源添加适宜的碳氮源不仅有利于Ery-6菌株的生长,还能提高菌株对红霉素的降解率。
2.3.6 外加金属离子
将Ery-6菌株按照5%(体积分数)的接种量接种于含有100 mg·L-1红霉素的无机盐液体培养基中,于35 ℃、pH 7.0、120 r·min-1的条件下振荡培养48 h。如图8所示,除Cu2+外,其他外加金属离子对Ery-6菌株降解红霉素无显著影响,说明该菌株的耐受性较强。测算单位菌量对红霉素的去除量可知,除Zn2+和Cu2+对红霉素降解产生直接影响外,其他金属离子均通过抑制菌的生长从而降低红霉素去除量。同时,Cu2+还能显著抑制Ery-6的生长,从而对该降解菌降解红霉素的效果产生较大影响。
3 讨论
目前,国内外关于微生物降解红霉素的研究较少,已筛选到的红霉素降解菌有红酵母属(Rhodotorulasp.)[28]、假单胞菌属(Pseudomonassp.)[29]、克雷伯氏菌属(Klebsiellasp.)、氨基酸球菌属(Acidaminococcussp.)和变形菌属(Proteussp.)[30]等。本研究首次发现甲基菌属(Methylobacillussp.)菌株有红霉素降解能力。在适宜条件下,Ery-6菌株对于100 mg·L-1的红霉素在48 h内降解率可达88.68%。
目前,关于抗生素在堆肥过程中的降解研究主要集中在抗生素的降解动力学,以及在抗生素污染环境中分离抗生素降解菌等方面[31]。据报道,牛粪堆肥过程中最高温度可达到50 ℃以上[32]。污泥堆肥物料中,氟喹诺酮类抗生素(FQs)在中温期(35 ℃)物料中的去除率为38.43%,但在高温期(50 ℃)物料中的去除率仅为29.97%[33]。温度被普遍认为是影响抗生素降解的主要因素[34]。由此推测,抗生素降解菌能耐受的温度越高,越有利于菌种的投入使用。在已报道的红霉素降解菌中,大多数菌株的适宜温度在20~30 ℃[28-29]。毛菲菲等[29]筛选到的恶臭假单胞菌在30 mg·L-1的初始红霉素浓度下培养5 d,降解率为76.6%,但该菌不能适应高温环境,当温度高于35 ℃时便难以生长。本研究中,Ery-6菌株可在45 ℃的环境中生长,且48 h内对100 mg·L-1红霉素的降解率仍可达到45.11%,推测其在高温堆肥领域颇具应用潜力。
酶促反应,即微生物本身所固有的或经诱导产生的某些酶可使相应的抗生素失活[35],是微生物降解抗生素的主要机理之一。本研究中,外源添加Cu2+的反应体系中,Ery-6菌株的生长受到一定程度的抑制,但红霉素降解率仍达到60%左右,推测Cu2+只是对菌株本身的生长产生了一定的消极影响,但并没有完全抑制菌株固有的或经诱导产生的某种酶的降解作用。Wondrack等[36]发现一株金黄色葡萄球菌产生的酯酶能使14、16元环大环内酯类抗生素失活。Kim等[37]从一株假单胞菌分离纯化到一种相对分子质量为51 200 u的红霉素酯酶。微生物在生长过程中会产生各种酶,在这些酶的作用下,经过一系列的生理生化反应,最终可将抗生素完全降解或分解成分子量较小的无抗菌活性或抗菌活性较小的化合物。周显勇等[38]发现,Zn、Cd、Pb等重金属和大部分抗生素的含量都与土壤细菌、脲酶和磷酸酶活性呈负相关关系,复合污染会抑制土壤的生物活性。但也有研究发现,强力霉素(DOX)和Cu复合污染对脲酶活性表现出促进作用,对蔗糖酶、过氧化氢酶活性则表现出抑制作用[39]。以上结果说明,复合污染可能会对土壤生态系统产生较为复杂的影响。本试验结果显示,多种金属离子对Ery-6菌株降解红霉素的能力无显著影响,该菌株对多种金属离子具有较好的耐受性,可以较好地缓解复合污染给酶活带来的负面效应。鉴于目前环境中大多数抗生素污染发生的同时,也都伴随着重金属污染[38],且重金属种类丰富[40],预计该菌株在此方面的应用颇具优势。
本研究发现,反应体系的温度、初始pH值对该菌降解红霉素的影响较明显。适宜的pH条件下,Ery-6菌株生长迅速,可能与菌体内降解红霉素的酶系活力有关[41]。总体来看,Ery-6菌株对温度、pH和金属离子等都具有较广泛的耐受能力,这可能与该菌的理化性质和结构相关[42]。试验结果表明,当Ery-6菌株以红霉素为唯一碳源生长时,能有效降解红霉素。当红霉素质量浓度为100 mg·L-1时,最佳降解条件为温度35 ℃、转速120 r·min-1、初始pH值7.0,反应48 h的降解率为79.91%。
Fan等[43]研究发现,污水中红霉素的生物降解有赖于外加碳氮源,认为红霉素的生物降解属于共代谢机制。共代谢是指,一些难降解有机物需要在微生物从其他底物获取碳源和能源的过程中被降解[44]。本研究以50 mg·L-1的蔗糖作为外加碳源时,Ery-6菌株48 h对红霉素的降解率可达88.68%,对红霉素的降解效果大幅提高,推测其对红霉素的降解也存在共代谢机制。
本研究采用梯度式压力驯化法,从长期堆放鸡粪的有机肥生产车间土壤中筛选到一株能够有效降解红霉素的菌株Ery-6。该菌株对环境的适应能力优于普通菌株。目前,已报道的红霉素降解菌大多对红霉素的耐受浓度不高,而本研究得到的Ery-6菌株可以在以高浓度红霉素为唯一碳源的环境中生长,在最佳降解条件(35 ℃、pH 7.0、120 r·min-1)下,降解菌对于质量浓度高达1 000 mg·L-1的红霉素,降解率仍可达31.95%。综上,该菌株可望应用于红霉素制药厂等具有高浓度红霉素污染的环境治理当中。
致谢:感谢浙江农林大学环境与资源学院章海波教授提供液相色谱并指导检测,感谢中国农业科学院农业资源与农业区划研究所李兆君研究员对试验的指导。
