秀珍菇S-腺苷甲硫氨酸合成酶基因(PpSAMS)的克隆与表达分析
2021-01-28王伟科宋吉玲袁卫东周祖法
王伟科,陆 娜,闫 静,宋吉玲,袁卫东,周祖法
(杭州市农业科学研究院,浙江 杭州 310024)
秀珍菇(Pleurotuspulmonarius)在分类学上属于担子菌门、伞菌纲、伞菌目、侧耳科、侧耳属的大型真菌[1],其口感极好,味道鲜美,纤维含量少,热量低,肉质脆爽,且营养丰富,蛋白质含量极高,同时还含多醣、纤维素、矿物质素、氨基酸与多种微量元素等,被验证具有抗肿瘤的功能,是一种价值极高的珍稀食用菌[2]。秀珍菇抗逆性较强,生产周期较短,出菇整齐,产量可观,应用工厂化设施进行规模化栽培已成为其生产的主要方式[3]。生产上秀珍菇采用低温诱导调控出菇的方法,了解秀珍菇低温诱导下原基形成的分子机理,对秀珍菇工厂化栽培具有重要的指导意义[4]。
课题组前期对秀珍菇低温诱导后样本与原基形成前期的样本进行了转录组测序,并分析了样本间的差异表达基因,经转录组测序后ID为Cluster-6377.69422的基因在秀珍菇菌丝体经低温刺激后原基形成前期样本中高度表达,经基因注释与Swissprot描述,其编码S-腺苷甲硫氨酸合成酶,将其命名为PpSAMS。
S-腺苷甲硫氨酸合成酶 (S-adenosylmethioninesynthetase, SAMS)是植物代谢过程中的一个关键酶,它催化ATP和甲硫氨酸反应生成的S-腺苷甲硫氨酸(S-adenosyl-methionine, SAM),是重要的甲基供体,也是生物合成多胺和乙烯等的前体,能够参与植物的转氨丙基、转甲基和转硫等多种重要的生化反应过程[5-7]。同时,SAMS还可以与RNA结合参与基因的表达调控[8]。研究表明,SAMS基因与植物对干旱、盐碱和低温的抗性密切相关,并协助植物耐受非生物胁迫,提高植物抗逆性[9-11]。此外,不同植物SAMS基因或同一物种的不同家族成员之间的表达模式具有明显的组织和时间特异性[12-14],表明不同的SAMS基因可能参与了不同的生理代谢过程。因此,分析不同物种的SAMS基因,对深入了解该基因的功能具有重要意义。
目前已经在番茄[15]、拟南芥[13]、松树[16]等多种生物中克隆了SAMS基因,但还未见秀珍菇SAMS基因(PpSAMS)相关报道。本实验利用生物信息学技术分析筛选出该基因的全长序列,设计引物克隆了该基因,并对其进行了相关分析,为进一步深入研究该基因奠定了基础,同时为阐明秀珍菇经低温刺激诱导原基与子实体形成的分子机理提供参考。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株
供试菌株为秀珍菇5766,由临安鼎新农业科技有限公司提供。
1.1.2 基质配方
基质配方为:棉籽壳39%、木屑39%、麸皮18%、石膏1%、石灰1%。
1.1.3 样本处理
菌包接种后于26~28 ℃条件下避光培养,待菌丝满袋后,选取生长状态一致的菌包开展试验。分4组取样,每组10包,分别记为S0、S1、S2、S3。S0,菌丝满袋后,用镊子挑取发菌良好的菌包料面纯菌丝体10 g,置于-80 ℃超低温冰箱保存;S1,菌丝满袋后,发菌良好的菌包置于10 ℃条件下12 h,按S0方法取样保存;S2,菌丝满袋后,发菌良好的菌包置于10 ℃ 条件下12 h,再待其恢复到室温状态后,按S0方法取样保存;S3,原基形成期取原基10 g,保存方法与S0一致。
1.2 试验方法
1.2.1 总RNA的提取
样本总RNA的提取采用Trizol法进行[17],样本经液氮研磨后Trizol裂解,离心弃沉淀,上清加入氯仿/异戊醇抽提,振荡混匀。离心后上清加入体积比1∶1的异丙醇,沉淀总RNA。沉淀经75%乙醇洗涤后溶于40 μL DEPC水中。
1.2.2 cDNA的合成
总RNA经1.2%琼脂糖凝胶电泳与Nanodrop2000c检测纯度和浓度后,参考Biorad公司的iScript cDNA Synthesis Kit合成cDNA。
1.2.3 基因克隆
根据秀珍菇测序结果,选取PpSAMS基因。同时运用引物设计软件Primer 5.0设计相关引物如下:上游引物5′-ATGTTCTCCATCCGCATCTCC-3′;下游引物5′-CGCCCATCAAACTCCTCTAA-3′。
以反转录后cDNA为模板进行PCR扩增,共50 μL反应体系:10×Pfx缓冲液5.0 μL,50 mmol·L-1MgSO41.0 μL,25 mmol·L-1dNTP 2.0 μL,10 mmol·L-1上游引物2.0 μL,10 mmol·L-1下游引物2.0 μL,cDNA模板5.0 μL,PfxDNA Polymerase1.0 μL,ddH2O 32 μL。
反应条件为:94 ℃预变性4 min;94 ℃ 40 s,54 ℃ 40 s,72 ℃延伸1 min,30个循环;72 ℃延伸7 min。扩增产物用PCR产物胶回收试剂盒直接纯化回收。连接T载体后转化大肠埃希菌,提取质粒DNA进行鉴定,阳性克隆送北京擎科生物技术有限公司测序。
1.2.4 基因的生物信息学分析
在http://www.ncbi.nlm.nih.gov/blast、http://amigo.geneontology.org/、http://www.uniprot.org等相关网址进行生物信息学分析。采用软件VectorNTI、MEGA5.0对序列进行多重比对,并构建系统进化树[18]。
1.2.5 基因表达分析
分别提取秀珍菇常温处理菌丝体、低温诱导后菌丝体、低温诱导原基形成前期菌丝体与原基4个不同处理阶段总RNA,参考iScript cDNA Synthesis Kit进行cDNA第一链的合成,同时根据测序后的PpSAMS序列设计引物,按照SYBR Premix ExTaqTM Ⅱ使用说明,检测基因PpSAMS的表达,以Actin作为内参,计算PpSAMS的相对表达量[19]。目的基因和内参基因Actin的退火温度均为53 ℃,样品设3个重复。引物见表1。
2 结果与分析
2.1 PpSAMS基因克隆与生物信息学分析
为研究PpSAMS基因信息并探究其功能,通过利用RT-PCR技术从秀珍菇中克隆得到1 100 bp左右的DNA片段,克隆测序后,通过ORF Finder寻找其开放读码框,显示为1个全长为1 152 bp的ORF框,推断其为编码384个氨基酸的功能蛋白。

表1 实时荧光定量PCR反应引物序列
BLAST显示其与密黏褶菌(Gloeophyllumtrabeum)S-腺苷甲硫氨酸合成酶基因(S-adenosylmethionine adenosyltransferase,GenBank:XM_007864819.1)相似度为83%。
与GenBank中登录的基因进行同源性比较和功能预测分析后,获得序列被验证确认为一个编码384个氨基酸的CDS(Coding sequence,图1)。Vector NTI软件推算该编码蛋白的相对分子质量在41.8 ku左右。
2.2 PpSAMS基因编码蛋白系统进化分析
利用MEGA5.0 软件对秀珍菇PpSAMS基因编码氨基酸序列开展进化树分析,显示秀珍菇PpSAMS编码的蛋白与糙皮侧耳同源蛋白亲缘关系最近,与其他真菌同源蛋白的亲缘关系较远(图2)。
2.3 PpSAMS的GO功能分析
GO功能分析显示,PpSAMS蛋白具有结合ATP、金属离子的功能,同时具有S-腺苷甲硫氨酸合成酶活性。GO功能分析显示,PpSAMS蛋白参与了甲硫氨酸、单碳的代谢过程,同时参与了S-腺苷甲硫氨酸的生物合成。S-腺苷甲硫氨酸在甲基转移中是一个重要的甲基供体,并可以将DNA甲基化,从而调控基因的表达。可见,PpSAMS蛋白在秀珍菇DNA甲基化调控过程中起重要作用。
2.4 PpSAMS的KEGG分析
KEGG pathway分析显示,S-腺苷甲硫氨酸合成酶催化L-甲硫氨酸形成S-腺苷甲硫氨酸,后者参与了生物体内的一系列代谢过程,包括乙烯合成与丙酸的代谢(图3)。
2.5 低温诱导后秀珍菇不同生长阶段PpSAMS的表达研究
PpSAMS在秀珍菇菌丝体常温处理(S0)、低温诱导(S1)、低温诱导后原基形成前期(S2)、原基期4个不同生长阶段均有不同程度的表达。其中S1阶段PpSAMS的相对表达量高于S0阶段,说明菌包受到低温胁迫后,PpSAMS的表达量有一定程度的升高;而S2阶段PpSAMS的相对表达量明显高于S0与S1阶段,说明PpSAMS在一定程度的低温诱导后,启动了体内某些生理生化反应,诱导原基形成(图4)。
图1 PpSAMS基因的ORF读码框与翻译结果Fig.1 ORF and transcription of PpSAMS

图2 PpSAMS基因氨基酸序列系统进化树Fig.2 Phylogenetic tree of amino acid sequence of PpSAMS between Pleurotus pulmonarius and other fungi

图3 PpSAMS基因KEGG代谢通路分析Fig.3 KEGG pathway analysis of PpSAMS
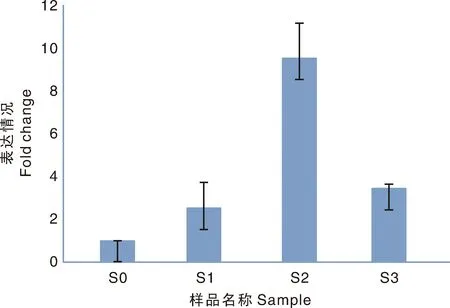
图4 PpSAMS在秀珍菇不同生长阶段的表达情况Fig.4 Expression profile of PpSAMS in Pleurotus pulmonarius at different growth stages
3 讨论
出菇过程是大型食用菌整个生命过程中不可缺少的环节,在秀珍菇栽培研究中,低温诱导刺激相关基因表达的调控能够实现其整齐出菇[20]。因此,研究秀珍菇子实体发育分子机制与发育相关基因可为秀珍菇出菇技术提供指导,也可为发掘优异种质资源和杂交亲本遗传背景筛选提供帮助[21]。
担子菌子实体形成的分子机理研究一直是国内外学者的研究热点,目前已分离鉴定得到多个与食用菌结实有关的基因。香菇priB基因在菌丝体时期不表达,在原基和子实体发育形成的早期大量表达,推测其在香菇子实体形成中起到重要作用[22]。金针菇原基形成相关的HMG-box转录因子基因Fv-hmg在金针菇原基时期的表达量显著高于双核菌丝时期,推测该转录因子参与调控金针菇的原基形成[23]。本实验结果与上述研究结果相似,推测PpSAMS在诱导秀珍菇原基形成过程中起到重要作用。
研究表明,植物与大型食用真菌在遭受低温胁迫时,能够利用自身甲基化程度(甲基化和去甲基化)的改变调控基因表达[24]。S-腺苷甲硫氨酸合成酶催化甲硫氨酸和ATP形成S-腺苷甲硫氨酸,而S-腺苷甲硫氨酸在甲基转移中是一个重要的甲基供体,并可以将DNA甲基化,进而影响基因的表达[25]。本研究中PpSAMS基因在秀珍菇受低温诱导后表达量上升,推测其属于真菌的应激反应,提高了秀珍菇菌丝体抗低温能力;同时PpSAMS的表达诱导了S-腺苷甲硫氨酸的生物合成,将相关基因甲基化,从而影响了秀珍菇的生长发育,尤其在原基形成前期,其表达量显著上升,推测其在秀珍菇菌丝体扭结进而形成原基的过程中发挥了一定的作用,但其具体调控机制有待于进一步研究。
