含锌银锰矿浸出液除锌工艺研究
2021-01-27曾英成何溯结许农琦方广盛李世媛林江平
曾英成,杨 勇,何溯结,许农琦,方广盛,李世媛,林江平
(中信大锰矿业有限责任公司 大新锰矿分公司,广西 崇左 532315)
0 前 言
硫酸锰溶液是生产硫酸锰、电解金属锰和锰氧化物的重要中间物料。硫酸锰溶液主要通过锰矿浸出和除杂净化的方法制备,净化所得溶液中杂质含量决定了后续锰系产品的纯度。Cu2+、Zn2+、Co2+、Ni2+等离子在锰矿的浸出过程中会进入硫酸锰溶液,溶液的净化除杂过程往往需要采用不同的除杂工艺。近年来针对可有效去除锰溶液杂质又不造成锰损失的除杂工艺开展了大量的研究工作[1]。
对于硫酸锰溶液中重金属离子的去除,一般采用硫化物沉淀法。制备高纯硫酸锰,何银晖等[2]提出分步沉淀法净化溶液,有效去除K+、Na+、Ca2+、Mg2+后,采用BaS沉淀除重,适宜条件下Zn2+浓度可降至0.2 mg/L,Cu2+浓度降至1.4 mg/L左右,结晶产品满足指标要求。林清泉等[3]利用低品位碳酸锰矿和硫酸浸出反应,浸出液除铁后用SDD除重金属,Ni的去除达到95.3%,结晶所得硫酸锰产品达到98%以上纯度。甘昌远等[4]通过几种硫化剂的对比研究,发现用SDD作硫化剂,可有效去除硫酸锰溶液中的钴、镍等金属离子,溶液中Mn的损失最小。伍碧等[5]采用硫化铵去除软锰矿浸出液中的重金属,结果表明采用絮凝沉淀方式的重金属去除率可达到98.4%,锰损失率1.39%,但该方法会引入一定量的铵离子等杂质离子。陈飞宇等[6]在高纯硫酸锰溶液的制备过程中,对比研究了MnS、MnS矿、BaS去除硫酸锰溶液中重金属的效果,发现用MnS可将溶液中的重金属离子去除干净,达到高纯硫酸锰的指标要求,同时没有锰的损耗。刘洪刚等[7]研究发现,硫酸锰浸出液在pH值小于2条件下,采用MnS可将浸出液中98%以上的镍、钴去除。田佳瑜等[8]通过对比研究,从有效性和硫酸锰溶液污染综合考虑,硫化物沉淀工艺采用MnS较为适宜。
在实际生产使用的过程中,制备硫酸锰合格液时采用硫化物除重的方法,酸性条件下存在释放硫化氢的风险,且会有一定量S2-残留,影响产品质量。利用锰粉置换法去除锰盐溶液中的金属离子,可有效规避生成硫化氢的风险,又不引入新杂质,清洁高效,工业化推广有实际意义[9]。李军旗等[10]研究表明,采用金属锰粉置换法去除氯化锰溶液中的重金属,溶液中Pb的去除率可达 67.35%,同时不引入新的杂质。硫酸锰溶液中的Cu2+、Zn2+、Co2+、Ni2+等金属杂质离子,采用锰粉置换法可以达到指标要求,适宜条件下铜、锌的脱除率达99%以上,镍、钴脱除率达93%以上[11]。许东东等报道,用锰粉置换法去除硫酸锰溶液中的重金属离子是可行的,结果表明金属锰粉投加量越大,除 Pb2+外重金属杂质离子去除率越高[12]。针对含锌银锰矿浸出后高Zn2+含量的硫酸锰溶液,本研究旨在找到适合的除锌工艺方法,以制备出合格的工业级硫酸锰产品,为工业化生产提供依据和参考。
1 实验部分
1.1 原料与试剂
实验中所用主要原料为含锌银锰矿,综合检测数据如表1所示。
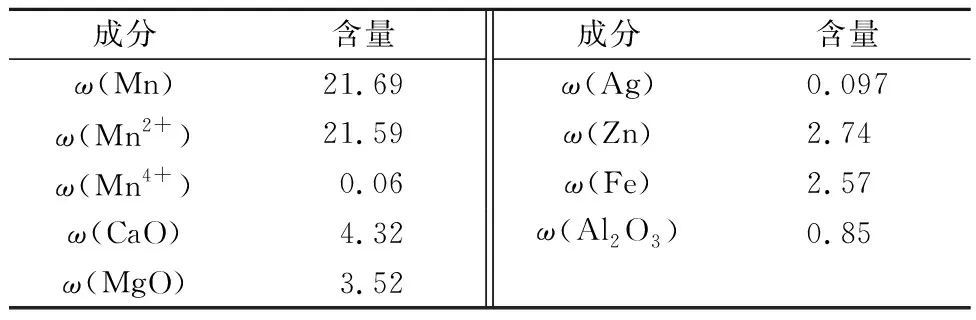
表1 含锌银锰矿综合样检测数据 %
金属锰粉为自制。制备过程:采用Mn含量99.8%电解金属锰合格锰片,磨粉后过0.150 mm(100目)筛,密封袋封装,备用。
主要试剂:硫酸、双氧水、SDD、乙硫氮、硫化钠、硫化铵,主要试剂均为工业级。
1.2 实验过程
1.2.1 含锌银锰矿浸出制备硫酸锰溶液
试验过程采用清水制液工艺,按液固比3∶1投加含锌银锰矿粉,加入硫酸后置于50℃水浴锅搅拌反应2 h,加入一定量的冶金锰粉除铁,除铁后加入一氧化锰粉进行中和至pH=5左右,过滤,制备得到含Zn2+硫酸锰溶液,各元素含量采用ICP-ARCOS进行检测。
1.2.2 硫酸锰溶液中金属锰粉置换除锌
含Zn2+硫酸锰溶液采用金属锰粉除锌,试验过程每次取1 L硫酸锰溶液置于烧杯中,恒定搅拌机转速搅拌,在一定的初始反应条件下加入金属锰粉进行置换反应除锌。试验研究了不同金属锰粉用量、不同反应初始pH、以及不同反应温度的除Zn效果,各元素含量采用ICP-ARCOS进行检测。
1.2.3 硫酸锰溶液的硫化除锌
除锌反应主要采用硫化沉淀法,试验过程每次取1 L硫酸锰溶液置于烧杯中,恒定搅拌机转速搅拌,在一定的初始反应条件下加入不同的硫化剂进行硫化沉淀除锌。硫化剂分别采用SDD、乙硫氮、硫化钠、硫化铵,硫化反应的时间为60 min,反应温度为30℃,综合分析除锌效果。
2 实验结果及讨论
2.1 含锌银锰矿的浸出结果
本实验采用含银硫锰矿制备硫酸锰溶液是通过清水,按照浸出、除铁、中和、过滤等生产工艺进行制液,浸出液结果如表2所示。
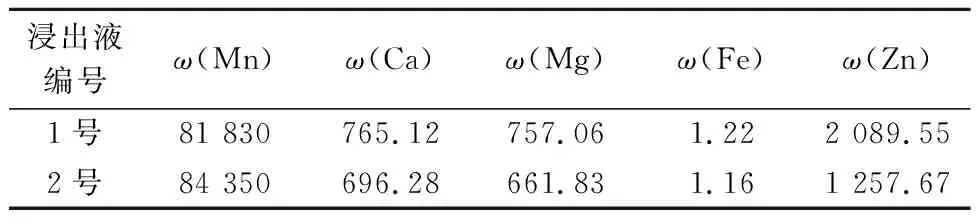
表2 含锌银锰矿浸出液检测结果 mg/L
由表2可知:采用清水制液,浸出液中Mn浓度为80~85 g/L,达到浸出液锰含量要求;1号浸出液中Zn2+含量达到2.089 g/L,属于高锌含量的硫酸锰溶液,需要除Zn2+才符合制备出合格的工业级硫酸锰产品溶液要求。
2.2 不同反应温度的除Zn2+效果
初始溶液的pH值为4.0,采用一定量的金属锰粉进行置换除Zn2+,置换反应时间为60 min,不同反应温度下除Zn2+的效果如图1所示。

图1 不同反应温度对溶液中锌的去除效果影响
由图1可知:溶液的温度为30℃时,溶液中的Zn2+去除率为80.23%,随着温度增加,除锌效果基本不变,试验表明除锌反应在常温即可。
2.3 不同金属锰粉用量的除Zn2+效果
反应温度为30℃,初始溶液的pH值为4.0,置换反应时间为60 min,采用不同理论用量的金属锰粉进行置换除Zn2+,除Zn2+效果如图2所示。

图2 不同金属锰粉用量对溶液中锌的去除效果影响
由图2可知:金属粉除锌效果较好,用量增加到5倍理论量时,可将Zn2+基本去除完全。当金属锰用量为理论量2倍时,溶液中的Zn2+去除率达97.14%,满足硫酸锰指标要求。
2.4 不同初始pH值的除Zn2+效果
反应温度为30℃,采用2倍理论用量的金属锰粉进行置换除Zn2+,置换反应时间为60 min,不同初始pH值的除Zn2+效果如图3所示。
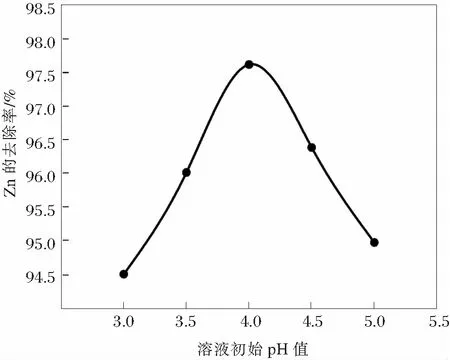
图3 不同溶液初始pH值对溶液中锌的去除效果影响
由图3可知:金属锰粉置换Zn2+,随着溶液初始pH值除锌效果先上升,在溶液的pH值为4.0,溶液中的Zn2+的去除率到达97.62%,为最佳反应初始pH值,随着pH值继续上升,溶液中Zn2+的去除率反而呈现下降的趋势,金属锰粉除锌工艺初始pH值控制在4.0左右为宜。
2.5 不同反应时间的除Zn2+效果
反应温度为30℃,溶液的初始pH值为4.0,采用2倍理论用量的金属锰粉进行置换除Zn2+,不同置换反应时间的Zn2+效果如图4所示。

图4 不同置换反应时间对溶液中锌的去除效果影响
由图4可知:置换反应时间为60 min,溶液中的Zn2+去除率达98.07%,反应时间为75 min,溶液中的Zn2+去除率达98.69%,溶液中的Zn2+含量为15 mg/L,符合制备工业级硫酸的溶液要求。
2.6 不同硫化物的除Zn效果对比
采用硫化工艺进行除锌试验,不同硫化物的除Zn效果如表3所示。

表3 不同硫化物的除锌效果对比
由表3的数据可知:Zn原溶液的Zn2+为1 257.67 mg/L,通过加入过量的乙硫氮、硫化钠、SDD、硫化铵除锌后,可满足硫酸锰溶液中的Zn2+含量要求,但是硫化物的用量非常大,引入的钠和铵根离子过多,不符合工业级硫酸锰的生产要求。
3 除锌后结晶产品的对比
按硫酸锰生产结晶工艺进行结晶,分别取未除锌溶液、乙硫氮除锌溶液和锰粉除锌溶液进行结晶,溶液Mn2+浓度达到240 g/L后,过滤,烘干,得到不同除锌工艺的结晶产品,分析结果如表4所示。

表4 不同除锌工艺的结晶产品分析检测结果
1号为未除锌的溶液结晶后的硫酸锰产品结果,锌的含量为1 708.05×10-6,含量较高。2号为用硫化钠除锌后硫酸锰产品,锌的含量为13.46×10-6,锌的含量比较低,钠的含量为1 920.85×10-6,含量较高。3号为用乙硫氮除锌后硫酸锰产品,锌的含量为67.95×10-6,达到普通级硫酸锰要求,钠的含量为1 034.92×10-6,含量较高。4号为锰粉除锌后的硫酸锰产品,锌的含量为16.67×10-6,锌的含量比较低,达到工业硫酸锰的生产要求。采用金属锰粉除Zn2+后,溶液中没有引入新的杂质离子,结晶后的硫酸锰产品品质好,金属锰粉可做为高Zn硫酸锰溶液的首选除锌剂。
4 结 论
1)采用金属锰粉置换除锌工艺,反应温度为30℃,溶液的初始pH值为4.0,金属锰用量为理论量2.0倍,置换反应时间为60 min,溶液中的Zn2+去除率达98.07%,反应时间为75 min,溶液中的Zn2+去除率达98.69%,溶液中的Zn2+含量为15 mg/L,符合制备工业级硫酸的溶液要求。
2)溶液的Zn2+为1 257.67 mg/L,通过加入过量的乙硫氮、硫化钠、SDD、硫化铵除锌后,可满足硫酸锰溶液中的Zn2+含量要求,但是硫化物的用量非常大,引入的钠和铵根离子过多,不符合工业级硫酸锰的工艺指标要求。
3)结晶产品分析表明:使用未除锌的溶液结晶时,产品的锌含量高,可达1 708.05×10-6,产品质量不符合要求;使用金属锰粉置换除锌溶液结晶后的硫酸锰产品,锌的含量在50×10-6以下,符合工业级硫酸锰产品的要求;采用金属锰粉除Zn2+后,溶液中没有引入新的杂质离子,结晶后的硫酸锰产品品质好,金属锰粉可作为高Zn2+硫酸锰溶液的首选除锌剂。
