尿毒康合剂对缺血再灌注损伤大鼠的肾保护作用及其机制研究
2021-01-27安海文李燕林刘琳娜李锦山杨文钦
安海文,李 李,李燕林,刘琳娜,黄 琳,李锦山,杨文钦
0 引言
急性肾损伤或衰竭的发生多由于肾缺血再灌注损伤(Renal ischemia-reperfusion injury,RIRI)引起,此外,肾移植期间或腹主动脉手术而导致的RIRI亦是多器官衰竭的诱发因素。RIRI的特征是急性肾功能恶化和肾脏炎症,最终导致组织损伤[1]。RIRI的病理生理学很复杂,其特征在于3个组成部分:中性粒细胞浸润,活性氧形成和先天免疫激活,其中关于RIRI中的先天免疫激活,已经确定了补体激活的关键作用,尽管补体抑制被认为是潜在的治疗策略,然而目前仍然没有确切的用于RIRI的疗法[2]。目前普遍认可的RIRI防治原则是调控炎症因子,减少细胞的凋亡,使缺血组织的代谢及损伤得到改善,防止钙超载,调控再灌注条件,使自由基得到清除[3-4],因此,相关的研究多从上述方面入手。
尿毒康合剂是我院自主研发的制剂,主要成分为黄芪、红花、丹参、泽泻、大黄等中药,具有清热解毒、益气生血、化瘀等功效。为我院治疗慢性肾功能衰竭的常用制剂,长期临床研究表明,尿毒康合剂可改善腹膜透析患者的残余肾功能,亦能提高腹膜透析患者的透析效能,延缓肾功能恶化,具有抑制腹膜纤维化和肾脏微炎症的作用[5-7]。目前随访的服用尿毒康合剂的患者中未发现相关的严重副作用。此外,前期研究发现,尿毒康合剂可能通过降低TGF-β1蛋白的表达和减轻相应的氧化应激作用,防止腹膜致密层变厚及其相应间皮细胞发生损伤[8];此外,该制剂亦可使慢性肾功能衰竭大鼠BUN、Scr水平得到控制,减轻靶器官的损伤,提高排毒能力及免疫力[9-10]。银杏叶提取物药理作用主要有抗氧化及血小板聚集、清除自由基、改善血液流变学等,亦可保护再灌注后的器官组织[11]。参考相关研究报道[12],本课题组经由外科手术建立SD大鼠RIRI的模型,以银杏叶提取物作为阳性药,考察尿毒康合剂对改善肾功能的作用及其机制,以期为药物的合理使用提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 73只SPF级的体重210~230 g(7~9周龄)的雄性健康的SD大鼠,购于山东省实验动物中心,实验动物合格证号:SCXK(鲁)20140007,SD大鼠于中山市中医院药理室SPF动物房饲养[使用许可证号SYXK(粤)2015-0109],SD大鼠饲料与垫料均购自广州市实验动物中心[饲养条件:控制适宜的温湿度,温度控制在(23±3)℃,湿度控制在(55%±15%),每12 h进行明暗交替],提供适量清洁的饮用水和饲料,先进行3 d适应性的饲养,然后开始正式实验。
1.1.2 药品与试剂 尿毒康合剂(中山市中医院制剂室研制,批号:20180102,规格:100 ml/瓶);银杏叶提取物(江苏金纳多生物科技有限公司,批号:20171213);大鼠IL-6、IFN-γ、TNF-α ELISA试剂盒(上海晶抗生物工程有限公司,批号:190238672、H3567914、S51384664,规格:96T);水合氯醛(西陇科学试剂有限公司,批号:20180465,AR);FAS/FASL单克隆抗体(一抗)(ThermoFisher,批号:SMFIO-PC2341);甲醛(天津市大茂化学试剂有限公司,批号:20180606,AR);二甲苯(衡阳市凯信化工试剂有限公司,批号:20180712);DAB试剂盒(泉州市睿信生物科技有限公司,批号:PT2397);TUNEL试剂盒(上海如吉生物科技发展有限公司,批号:S9876);Cocktail(Sigma,批号:P2348);磷酸酶抑制剂[赛默飞世尔科技(中国)有限公司,批号:THG382];BCA法检测蛋白定量试剂盒(上海士锋生物科技有限公司,批号:JKHG564);PageRuler Prestained Protein Ladder(Thermo,批号:65496);甲醇(SPECTRUM,批号:3GI21245)、30%丙烯酰胺(衡阳市凯信化工试剂有限公司,批号:21015556);蛋白预染Marker(北京卓悦联合生物科技有限公司,批号:KL89664);一抗稀释液及RIPA裂解液(上海信裕生物科技有限公司,批号:GK1167);中性树胶、30%过氧化氢、过硫酸铵、Tris Base、Skimmed milk powder、Glycine、SDS、亚硫酸钠、β-巯基乙醇、冰乙酸、glycerin、酒精、4%多聚甲醛、硫代硫酸钠、磷酸缓冲盐溶液及枸橼酸缓冲液、Tween-20(天津大茂化学试剂);BPB(博大泰克);1%伊红染液、显影粉、石蜡、10%正常山羊血清、苏木素染液及其分化液。
1.1.3 仪器 PL-25G-I离心机(Anting科学仪器厂);Muitiskan MLB3酶标仪(热电科技有限公司);SK961洗板机(深圳市盛信康科技有限公司);Varioskan LUX全自动生化分析仪(赛默飞世尔);XP205DR分析天平(梅特勒);OGH180-S烘箱(赛默飞世尔);MaxQ2000台式摇床(赛默飞世尔);FR4A荧光显微镜(北京世纪科信科学仪器有限公司);DYCZ-40G型转印电泳仪(上海向帆仪器有限公司);RT-I暗室灯及暗匣(天津铭齐科技有限公司)。
1.2 分组、给药与建模 73只SD大鼠随机分为6组:模型组、尿毒康合剂(低剂量4.95 g/kg、中剂量9.9 g/kg、高剂量19.8 g/kg)组,假手术组、100 mg/kg银杏叶提取物组(阳性药组)[12],每组12只(模型组13只)。其中尿毒康合剂中剂量治疗组给药量相当于人临床等效剂量。取生理盐水配制得到高剂量(9.9 g/ml)的尿毒康合剂适量,分别再将其稀释2倍和4倍,得到中、低剂量的尿毒康合剂。阳性药及各个剂量组的尿毒康合剂均给予2 ml的药量来灌胃,其余组给予2 ml生理盐水代替,每组都持续给药7 d,1次/d。7 d以后,除假手术组外,另外5组大鼠均手术建立RIRI模型,各组大鼠手术前禁食12 h,饮水自由。实验步骤如下:取10%的水合氯醛将各组的SD大鼠通过腹腔注射进行麻醉(3.5 ml/kg),发挥药效后,层层解剖,将腹腔中的肾蒂左右两侧用无损伤微型动脉夹快速阻断,肾脏逐渐由鲜红转变成暗紫色时开始计时,45 min后将动脉夹撤掉,肾脏的颜色又恢复正常,此时提示造模成功,最后将腹腔缝合。假手术组的大鼠除了不进行阻断肾蒂血流的操作外,其余手术操作同其他组的大鼠。注意保证关闭腹腔后2 h内,大鼠能正常活动,且术后24 h大鼠能存活,调整适宜的环境并给予食物和饮水保证其充分的休养[13-14]。
1.3 血液生化指标检测[15-16]各组大鼠建模手术后24 h进行腹主动脉采血,用全自动生化分析仪分析血清中尿素氮值(BUN)及肌酐值(Scr)。应用酶联免疫吸附法(ELISA)检测肿瘤坏死因子(TNF-α)、白介素-6(IL-6)及干扰素-γ(IFN-γ)3个炎症指标。
1.4 石蜡切片处理[17-19]采血后取出大鼠的2个肾脏,其中1个用4%多聚甲醛对其部分组织进行固定,再用不同比例的乙醇、纯化水及磷酸盐缓冲溶液冲洗,最后用石蜡将切取的约0.2 cm厚的组织包埋,二甲苯脱蜡后冲洗,再用枸橼酸buffer(pH值为0)煮沸,放冷后冲洗干净。
1.5 肾小管上皮细胞凋亡率的检测 按照TUNEL试剂盒说明书的方法处理上述石蜡切片,再用荧光显微镜(400×)观察拍照,在荧光显微镜下可见未凋亡的细胞发出蓝色荧光,凋亡的细胞发出绿色荧光,随机分析计算肾小管上皮细胞凋亡率(细胞凋亡率=凋亡细胞数÷总细胞数×100%)[20-21]。
1.6 肾组织FAS、FASL蛋白的表达检测 将以上石蜡切片用10%正常山羊血清封闭30 min,在4 ℃条件下,一抗孵育12 h,用buffer冲洗后将二抗及链霉素卵白素工作液依次加入,转至37 ℃环境继续孵育30 min,用buffer冲洗后经过DAB/H2O2反应,最后用苏木素染色再脱水封片。用显微镜观察记录上述处理的切片,分析计算放大200倍与400倍时的积分光密度值(IOD/area)并绘制统计图比较分析[17-19]。
1.7 细胞凋亡相关蛋白的表达检测(Western blot法) 将上述取出的另一个肾脏的部分组织置于冰上,加适量蛋白质裂解液反应30 min,再低温离心5 min(13 500 r/min),分离出上清液,参照试剂盒说明书采用BCA方法进行定量分析。通过SDS-PAGE电泳对上述分离得到的蛋白进行分析,再将转模后得到的杂交膜用TBST冲洗,并于室温下用5%脱脂奶粉溶液封闭1 h。最后一抗孵育过夜并漂洗后,在37 ℃条件下用二抗孵育1 h,TBST漂洗2遍即得杂交膜,将带有荧光的化学底物添加其中于暗盒中显影。以GAPDH为内参,考察目标蛋白的相对表达[14,22]。

2 结果
2.1 血液生化指标检测结果 由表1及表2可知,与假手术组大鼠对比,模型组大鼠血清中的Scr、BUN、IL-6、TNF-α及IFN-γ水平明显上升,且差异具有统计学意义(P<0.01)。与模型组大鼠比,尿毒康合剂低、中、高剂量组及银杏提取物组大鼠血清中的上述各指标均有下降趋势,且差异均具有统计学意义(P<0.05)。此外,从相对模型组的下降程度来看,尿毒康合剂高剂量组的几个指标相对模型组下降幅度均较中、低剂量组大,部分指标下降幅度甚至超过阳性药。

表1 各组大鼠血清中Scr、BUN水平比较
2.2 肾小管上皮细胞凋亡率对比 用TUNEL法检测的结果见表3。结果显示,模型组大鼠与假手术组大鼠相比,肾小管上皮细胞凋亡率明显上升(P<0.01),此外,尿毒康合剂低、中、高剂量组大鼠与模型组大鼠相比细胞凋亡率均有所下降,且差异均具有统计学意义(P<0.05),并呈现剂量依赖型趋势,随着尿毒康合剂剂量的提高凋亡率也随着下降,尿毒康合剂高剂量组抑制细胞凋亡的效果优于阳性药组。见图1、表3。

表2 各组大鼠血清中IL-6、TNF-α、IFN-γ水平比较

图1 各组大鼠肾小管上皮细胞凋亡结果比较(400×)

表3 各组大鼠肾小管上皮细胞凋亡率比较
2.3 各组大鼠FAS、FASL蛋白表达水平比较 图2为各组大鼠肾组织石蜡切片在放大200倍与400倍视野下测得的FAS和FASL蛋白表达量。模型组大鼠相对于假手术组两种蛋白的表达量均明显升高,且差异均具有统计学意义(P<0.05)。此外,相对于模型组大鼠,随着尿毒康合剂剂量的提高,上述蛋白表达量也相应降低,其程度亦具有剂量依赖性,剂量越大降低的趋势就越明显。
2.4 Western blot法检测肾小管上皮细胞凋亡相关蛋白的表达水平 图3、表4显示,模型组大鼠相对于假手术组,Bcl-2和VEGF蛋白的表达量较低,其余肾小管上皮细胞凋亡相关蛋白的表达均较高,且差异均具有统计学意义(P<0.05)。而尿毒康合剂各剂量组相比,模型组大鼠Bcl-2和VEGF蛋白的表达量较高,其余肾小管上皮细胞凋亡相关蛋白的表达均较低。尿毒康合剂各剂量组的大鼠7种蛋白的表达均有剂量依赖性的变化趋势,其中Bcl-2和VEGF蛋白的表达量随着给药剂量的增加而增加,其余5种蛋白则反之。

图2 各组大鼠肾组织石蜡切片在200×与400×下测得的FAS和FASL蛋白表达量比较注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05
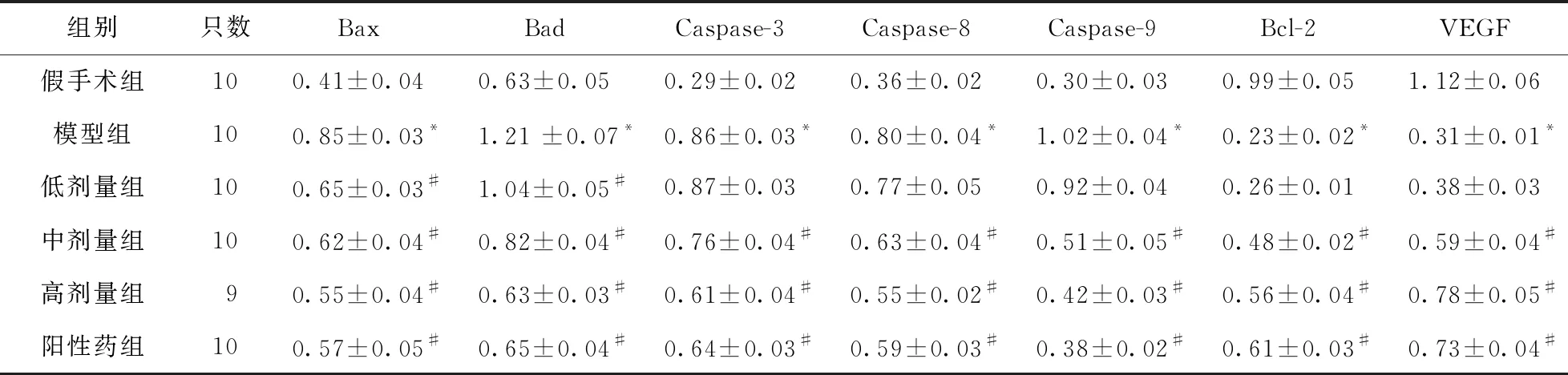
表4 各组大鼠肾组织Bax、Caspase-3、Caspase-8、Caspase-9、Bcl-2、Bad和VEGF蛋白相对表达量比较

图3 各组大鼠肾组织Bax、Caspase-3、Caspase-8、Caspase-9、Bcl-2、Bad和VEGF蛋白表达电泳图
3 讨论
本课题组前期报道了尿毒康合剂的质量标准[23],因此,上述研究的样品质量具有可重复性,从而保证了实验结果的可重复性。
RIRI可致肾功能广泛性损伤,从而致使肾小球的通透性增强而滤过率下降,肾小管上皮细胞受损致重吸收作用减弱,而Scr、BUN升高常预示上述病理现象,因此二者常作为评价肾功能的生化指标。结合本实验结果可知,尿毒康合剂对降低Scr和BUN指标有一定作用,故而一定程度上尿毒康合剂可改善肾功能。
炎症过程始于肾小管上皮损伤,使得肾小管上皮细胞功能障碍及IL-6、TNF-α、IFN-γ等免疫调节因子被释放到血液循环及肾组织中,进而使血管黏附分子表达增加及白细胞之间黏附作用增强。此外,有研究表明,炎症反应在RIRI过程中起重要作用,而IL-6、TNF-α及IFN-γ可间接反映炎症反应的程度[16,24]。本研究结果表明,尿毒康合剂可能通过降低炎症因子水平来减轻炎症反应对组织器官的损伤。
由各组大鼠肾小管上皮细胞凋亡率比较可知,尿毒康合剂剂量越大,对细胞凋亡的抑制作用越强,因此,可通过细胞凋亡相关蛋白的表达水平来评价药效。细胞表面受体蛋白FAS通过与其配体FASL结合来激活细胞凋亡信号通路,进而促使细胞凋亡[25],因此,可通过抑制FAS和FASL来抑制细胞凋亡。Bax及Bad均为常见的促细胞凋亡蛋白,而Bcl-2为抑制细胞凋亡蛋白,Bax与Bcl-2二者高度相关,其比例大小可影响肾小管上皮细胞凋亡[26]。VEGF蛋白为促使内皮细胞增殖的有丝分裂原,具有调控血管通透性及改善新生血管等作用,因此,VEGF蛋白的高表达可促进肾功能的恢复[27]。线粒体及死亡受体两个途径介导的细胞凋亡都有Caspase 家族相关蛋白参与,其中Caspase-3为凋亡执行因子,Caspase-8及Caspase-9均为Caspase-3执行细胞凋亡的辅助因子,三者的综合作用可促进细胞凋亡[28]。综上所述,Bax、Bad、Caspase-3、Caspase-8及Caspase-9这5种蛋白高表达可促进细胞凋亡,而Bcl-2与VEGF蛋白分别具有抑制细胞凋亡与促进细胞增殖的功能。结合实验结果可知,尿毒康合剂可通过降低促细胞凋亡蛋白的表达,增加抑制细胞凋亡蛋白和促细胞增殖蛋白的表达来减轻肾小管上皮细胞凋亡所带来的损伤。
