鸡树突状细胞的间接免疫荧光制片方法比较
2021-01-27何静怡舒鼎铭林楚晓罗成龙
何静怡,舒鼎铭,林楚晓,李 莹,王 艳,罗成龙
(广东省农业科学院动物科学研究所/畜禽育种国家重点实验室/农业农村部家禽遗传育种重点实验室/广东省动物育种与营养公共实验室/广东省畜禽育种与营养研究重点实验室,广东 广州 510640)
【研究意义】树突状细胞因其成熟细胞具有树突状或伪足样的突起而被命名[1]。作为最重要抗原呈递细胞,树突状细胞是机体内启动特异性免疫应答的关键,其免疫荧光定位和功能研究一直是国内外细胞免疫学研究的热点之一。近几年,免疫荧光技术和激光共聚焦扫描显微镜(laser scanning confocal microscopy, LSCM)分别被广泛应用,学者们找到研究树突状细胞的技术突破。免疫荧光技术是目前综合细胞形态、荧光定量、蛋白定位、免疫功能等研究的最强检测工具,通过观察蛋白上激发特异性标记的荧光,可直观显示其在细胞中的位置,有助于揭示病原在抗原定位和蛋白质功能等方面的特征[2]。激光扫描共聚焦显微镜作为近代生物医学图像分析仪器的重要发展之一,是目前应用最广泛和光学图像分辨率最高的分子细胞生物学分析仪器[3],仅检测反射自焦平面的光线部分,大大提高了图像的分辨率和对比度,使细胞形态和结构更精准。两者联合既进一步提高研究树突状细胞生物学的实验技术和方法,又为细胞生物学研究提供更广阔的前景。
【前人研究进展】细胞爬片是根据细胞对玻璃或塑料的黏附力特点建立的,是观察细胞形态结构最常用的一种试验手段,一般把细胞接种在装有盖玻片的孔板中,待在玻片上贴壁生长后再进行后续的普通染色或免疫试验。已有学者利用细胞爬片进行体外试验,对细胞进行各种干预处理,被应用于观察细胞形态和蛋白分布情况[4-5]。而细胞滴片是细胞悬液离心滴片经甲醛固定所成,大多应用于观察胞内不同时期蛋白表达变化的一种试验手段,如常用的血涂片、动物口腔或腹腔洗液滴片[6]等。国内对于两种制片方法的对比研究最早在1979年张蕴芬等[7]观察巨噬细胞吞噬功能的方法比较试验中。近年制片方法的对比研究在不断创新和进步,如李红军等[8]从免疫组化的角度对比分析贴壁细胞不同制片方法。
【本研究切入点】目前实验标本大多为组织切片[9-10]、活细胞培养瓶皿,而本研究针对细胞进行制片。悬浮细胞一般常用细胞滴片,贴壁细胞则用细胞爬片[11-13],而树突状细胞是一种介于悬浮和贴壁状态的半悬浮细胞。普通光学制片无法保持树突状细胞的形态和特点,而且LSCM较少应用于树突状细胞的动态蛋白标记研究中,也很少学者深入探讨更能准确有效地提高实验效率的制片方法。【拟解决的关键问题】本研究以鸡胚为素材,经原代分离定向诱导分化培养获得骨髓源鸡树突状细胞,分别制作细胞爬片和细胞滴片,选取具体表性的内源性蛋白ROBO2(Roundabout)和外源性蛋白NDV(newcastle disease virus),利用细胞免疫荧光技术和LSCM检测分析技术,多方位对比分析两种制片方法,为后续深入解析鸡胚细胞中免疫荧光定位以及蛋白功能研究提供依据。
1 材料与方法
1.1 试验材料
30枚鸡胚(19日胚龄),由广东省农业科学院动物科学研究所提供。
主要试剂:chicken GM-CSF和chicken IL-4(KINGFISHER BIOTECH,美国),澳洲血源胎牛血清(FBS)、RPMI1640、胰酶和青链霉素抗生素(GIBCO,美国),4%多聚甲醛、TritonX-100、胎牛血清蛋白(上海生物工程股份有限公司),抗荧光淬灭封片液(上海碧云天生物技术有限公司)。新城疫病毒lasota株(广东永顺生物制药股份有限公司),小鼠抗人ROBO2单克隆抗体(08253-4G5)(SIGMA-ALORICH),鸡源NDV单克隆抗体(北京天之泰生物科技有限公司),羊抗小鼠IgGⅡ抗926-68070(LI-COR,美国),羊抗鸡IgYⅡ抗SA5-10070(THERMO,美国),DAPI染液(ROCHE,瑞士)。
主要仪器和耗材:倒置荧光显微镜(OLYMPUS,日本),LSM7100激光共聚焦扫描显微镜(CARL-ZEISS,德国),无菌直径14 mm细胞玻片(上海卧宏生物公司),免疫荧光笔(CIRISC,日本),细胞培养相关耗材(THERMO,美国)。
1.2 试验方法
种蛋孵化及试验操作均在畜禽育种国家重点实验室内进行,孵化温度37(±0.5)℃,湿度45(±1)%。所有操作符合动物科学实验伦理要求。
1.2.1 鸡胚骨髓源细胞原代分离 取出30枚胚蛋,分离鸡胚胫骨、股骨,冲洗骨髓,收集组织液,1 000 r/min离心5 min;用含GM-CSF和IL-4 的10%FBS RPMI1640完全培养基重悬沉淀。
1.2.2 鸡树突状细胞滴片制作 将细胞悬液接种到24孔板中,于39 ℃、5 %CO2培养箱中培养。继代培养6 d后,胰酶消化,收集原代鸡骨髓源树突状细胞,以5×105个/mL分装4管,100MOI NDV接毒15 min,设阴性对照,3个重复,1 000 r/min离心5 min,弃上清。用免疫荧光笔在24孔圆形玻片边沿画密封圈,面朝上放入24孔板。细胞悬液滴入盖玻片圈内,静置10 min,使其粘附完成制片。
1.2.3 鸡树突状细胞爬片制作 将细胞悬液接种到24孔板圆形玻片,让其在玻片表面贴壁生长,于39 ℃、5% CO2培养箱中培养。分化6 d后将原代鸡骨髓源树突状细胞分成3组,每组设3孔100MOI NDV(接毒15 min)、1孔阴性对照。PBS洗板3次完成制片。
1.2.4 两种方法制片效果的比较 利用细胞免疫荧光技术和LSCM检测对比分析两种制片方法。
(1)免疫荧光试验程序:用预冷的4%多聚甲醛固定20 min,PBS漂洗3次;再经预冷的0.2%TritonX-100透化10 min,PBS漂洗3次;加入现配的5%BSA室温封闭1 h。
(2)双抗体孵育:取10 cm细胞培养皿依次放入标记纸、封口膜、抗体24孔玻片,制作孵育板。鸡源NDV抗体与ROBO2抗体按1∶2混合配制,小鼠源ROBO2单克隆抗体稀释度为1∶50,鸡源NDV抗体稀释度为1∶25,混合抗体,将细胞面与抗体充分接触,4 ℃ 孵育过夜;PBS漂洗3次;羊抗小鼠Ⅱ抗标记ROBO2、羊抗鸡Ⅱ抗标记NDV,稀释度为1∶200。小鼠Ⅱ抗和鸡Ⅱ抗以1∶1混合避光室温放置1 h;避光清洗3次;DAPI(1 μg/mL)染液室温下避光标记细胞核5 min,PBS漂洗3次;将抗荧光淬灭封片液(3 μL/片)滴至载玻片,取滴片/爬片倒扣封片,4 ℃避光保存,24 h内观察。
(3)激光共聚焦扫描法:以波长340、488、680 nm激发检测,NDV、ROBO2、DAPI依次显示为绿光、红光、蓝光。用63倍油浸物镜(数值孔径1.25)观察两种类型玻片,用LSM7100 ZEN2010软件捕捉和分析图像数据后进行对比分析。
(4)免疫荧光定量分析:根据捕捉的图像数据,按照抗体免疫荧光强度和显色特点,将免疫反应性分级为单阳性、阴性,以及两抗体荧光叠加时的双阳性。用Excel统计每个视野下各指标的百分比,结果用平均值±标准差表示。所有数据均用 SPSS 19.0和GraphPad Prism 5软件处理,多组间比较使用单因素方差分析,两组间比较采用独立样本t检验。
2 结果与分析
2.1 成熟鸡树突状细胞
根据鸡树突状细胞的鉴定标准[14],对培养获得的细胞进行细胞形态学观察。如图1所示,原代分离的细胞经定向诱导培养,接种NDV后所得细胞体积增大,伸出呈树突状的突起或伪足,说明获得了成熟的树突状细胞。

图1 树突状细胞显微镜检结果 (×10 )Fig. 1 Microscopy of dendritic cells (×10)
2.2 两种玻片ROBO2抗体共聚焦扫描结果比较
通过荧光标记ROBO2,统计免疫反应分级百分比,对滴片法与爬片法的抗体免疫反应性进行定量差异性分析,结果(图2)显示,滴片法与爬片法的ROBO2单阳性率分别为93.73%和0.00%,阴性率分别为4.97%和72.22%,均存在极显著差异。
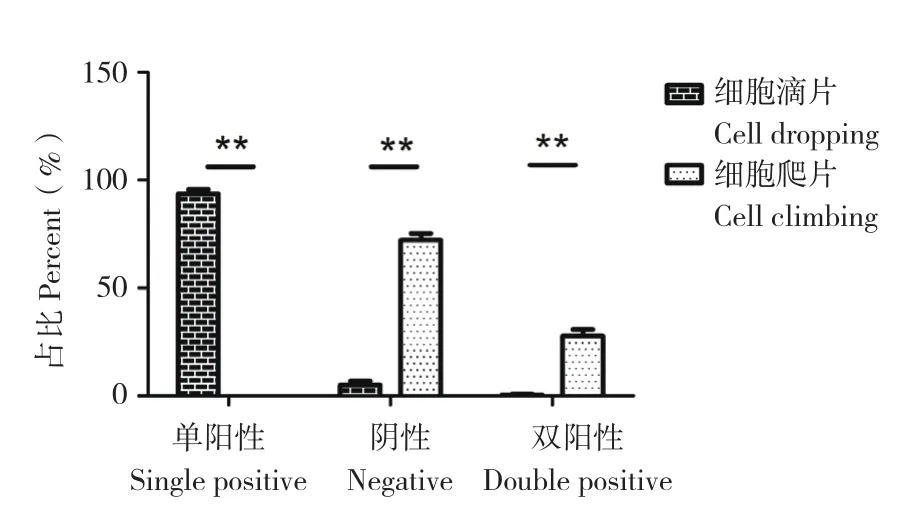
图2 ROBO2免疫反应性结果Fig. 2 Immunoreactivity result of ROBO2
双抗体共孵育时,滴片法的ROBO2单阳性率比爬片法高,而阴性率爬片法较高,比较发现滴片法树突状细胞的ROBO2显色性更强。根据激光共聚焦扫描结果(图3),对比两种制片法已标记的ROBO2,均有明亮的红色荧光。说明滴片法比爬片法更有利于ROBO2抗体标记。

图3 ROBO2激光共聚焦显微镜检结果(×63)Fig. 3 LSCM result of ROBO2(×63)
2.3 两种玻片NDV抗体共聚焦扫描结果比较
通过荧光标记NDV,统计免疫反应分级百分比,对滴片法与爬片法的抗体免疫反应性进行差异性分析,结果(图4)显示,滴片法与爬片法的NDV单阳性率分别为61.50%和1.51%,阴性率分别为32.60%和70.70%,均存在显著差异。
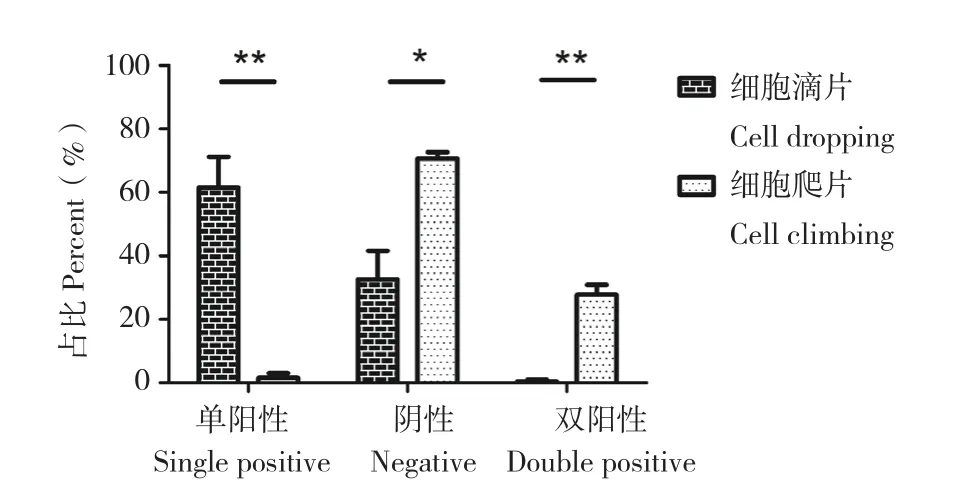
图4 NDV免疫反应性结果Fig. 4 Immunoreactivity result of NDV
双抗体共孵育时,滴片法的NDV单阳性率比爬片法高,而阴性率爬片法略高,比较发现滴片法树突状细胞的NDV显色性更强。根据激光共聚焦扫描结果(图5),对比两种制片法已标记的NDV,均有明亮的绿色荧光。说明滴片法比爬片法更有利于NDV抗体标记。
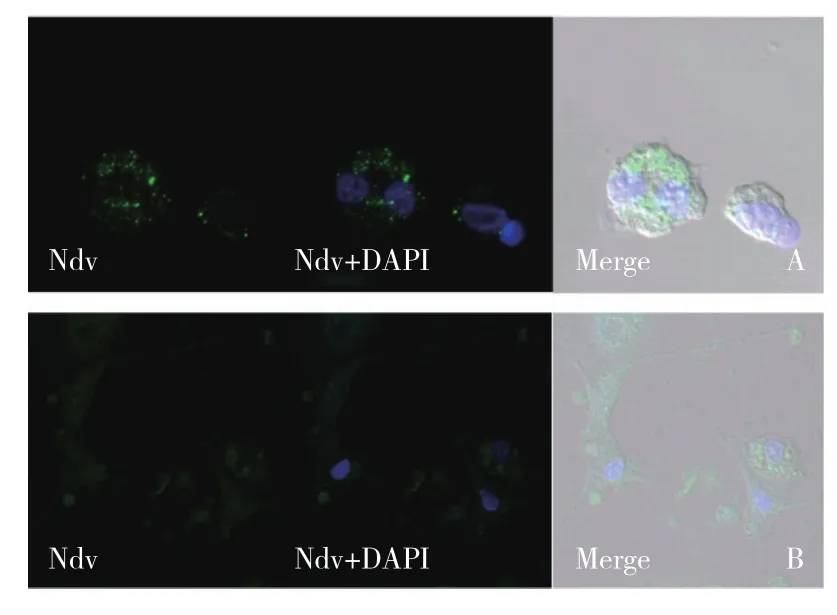
图5 NDV激光共聚焦显微镜检结果(×63 )Fig. 5 LSCM result of NDV (×63)
2.4 两种玻片双抗体共聚焦扫描结果比较
从荧光反应性差异性分析结果(图2和图4)可知,滴片法与爬片法双阳性率分别为0.46%和27.78%,差异显著。爬片法双阳性率比滴片法高,说明爬片法利于双抗体的孵育。如图6所示,滴片显示出ROBO2和NDV相对应的红色和绿色荧光,而爬片两蛋白显色重叠,显示出明亮的黄色荧光。

图6 双抗体激光共聚焦显微镜检结果(×63)Fig. 6 LSCM result of two antibodies (×63)
3 讨论
目前,细胞培养应用广泛,而免疫组织化学是显示抗原定位的良好手段,两种技术结合为医药卫生研究[15]以及畜禽病致病机理研究提供了有效的研究手段。制作良好的荧光玻片,各个环节都非常重要。细胞滴片制作过程,细胞消化和计数等繁琐且耗时长;细胞爬片制作则直接接种于玻片上,无需消化,操作简单,始终保持细胞原有的细胞生物学形态,这对细胞蛋白定位的研究尤为重要。此外,细胞滴片是细胞粘附玻片,其附着力不及直接贴壁生长的爬片细胞,间接免疫荧光程序的加样和清洗玻片,导致细胞碎片和细胞数目损耗增多。本研究稍改进试验方法,使树突状细胞更高效地标记上抗体,滴片孵育试剂直接滴入所画免疫圈内,使玻片细胞面充分接触试剂;细胞爬片需制作简易孵育膜倒扣孵育,要求技术操作熟练,以减少玻片破碎的可能。
本试验探索制片方法对蛋白免疫荧光显示的影响,为树突状细胞蛋白研究提供标本制作的选择依据。荧光定量分析发现,细胞滴片和细胞爬片的NDV和ROBO2单阳性率及阴性率分别存在极显著差异;对于单一蛋白,细胞滴片免疫反应性优于细胞爬片;两种制片法双阳性存在荧光反应性差异显著。结合激光共聚焦扫描结果分析,细胞滴片树突状细胞显示出NDV和ROBO2蛋白对应红色和绿色荧光,而细胞爬片显示两蛋白荧光重叠的黄光,提示进行两种蛋白研究时,爬片法优于滴片法。滴片法利于抗体荧光显色,而爬片法利于两抗体荧光重叠。激光扫描共聚焦显微镜具有高分辨率、高清晰度成像,三维重建及动态观察的特点,在进行高效细胞计数的同时进行图像处理,并对黏附生长的单个细胞或细胞群胞内外的荧光作定量、定性、及时动态分析[16]。动态研究必须依赖于活细胞基础[17]。现今中外已普遍应用激光共聚焦扫描动态观察细胞内不同的化学组分[18-21],但目前较少应用于树突状细胞的动态蛋白标记研究中。细胞滴片和细胞爬片的制作有利于树突状细胞动态蛋白标记研究,结合激光共聚焦扫描的激光显微外科手术光子刀技术、笼锁化合物技术,可深入到树突状细胞的呈递机制和免疫应答和细胞间通讯、膜流动性的研究。
4 结论
对单一蛋白研究时,细胞滴片阳性细胞比例更高,蛋白免疫反应性更优,利于标记目的蛋白,研究胞内蛋白表达变化以及进行亚细胞定位。细胞爬片的制作方法简便,可缩短试验时间,易于维持细胞形态学特征和保持ROBO2蛋白特性,综合显色性更强,更有利于在体外研究骨髓源鸡树突状细胞的ROBO2与新城疫病毒NDV的关系,为开展家禽抗病育种研究提供技术基础和方法。激光共聚焦扫描作为一种分子细胞生物学分析仪器,与细胞免疫荧光技术相结合,应用于检测细胞内外源蛋白表达情况,有助于进一步提高细胞生物学实验技术,利于深入研究树突状细胞等各种细胞的免疫功能、迁移作用和疫苗生产。
