瑞舒伐他汀抑制JNK1/2的活化对急性心力衰竭大鼠心脏血流动力学、氧化应激及免疫应答的调节①
2021-01-26韦迎娜韩圣娜周祥群刘尚军
韦迎娜 韩圣娜 周祥群 王 芳 刘尚军 阳 飞
(海南省第三人民医院,三亚 572000)
心力衰竭(heart failure,HF)是各种心血管疾病的终末阶段,同时也是死亡的最主要原因[1]。随着老龄化加重,HF的发生率和死亡率不断增加,但目前还没有找到完全有效的避免和预测方式[2]。GARDNER等[3]研究表明,HF是一个复杂的、连锁的动态过程,在HF过程中,神经激素和细胞因子在HF的病理生理机制中起重要作用,这些分子能对心脏和循环产生直接毒害作用,心肌损伤后细胞因子的连锁激动能对心脏血流动力学及后期的心室重塑产生重要影响。HF患者体内炎症细胞因子发生紊乱,其表达水平的增高及抗炎症细胞因子的不足可诱发心功能不全[4]。目前治疗HF的药物较多,瑞舒伐他汀(rosuvastatin,RST)是其中较为有效的药物之一[5]。RST可通过降低炎症细胞因子水平并诱导特异性抗炎症细胞因子升高保护心肌功能,促进心肌重构[6]。但目前对RST通过抑制c-Jun氨基末端激酶1/2(c-jun N-terminal Kinase1/2,JNK1/2)的活化来调控心脏血流动力学、氧化应激及免疫应答的调节机制的研究较少。本文旨在研究RST抑制JNK1/2的活化对急性HF大鼠心脏血流动力学、氧化应激及免疫应答的影响,以期了解RST抑制JNK1/2的活化对急性HF大鼠心脏血流动力学、氧化应激及免疫应答的调节机制,从而为急性HF的治疗提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级3周龄大鼠100只,体重(200±30)g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2017-0022,分20个笼子饲养,每个笼子5只。饲养于我院动物中心实验室。
1.1.2药物与试剂 瑞舒伐他汀片(国药准字H20080670)购自南京正大天晴制药有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)检测试剂盒均自上海恒远生物科技有限公司;IL-1β试剂盒购自上海纪宁酶联科技有限公司;肌红蛋白(myoglobin,Mb) 试剂盒购自上海基免实业有限公司;诱生型一氧化氮合酶(inducible nitric oxide species,iNOS)试剂盒购自安徽大千生物;IL-6免疫组化试剂盒购自美国贝克曼库尔特有限公司;Caspase-3、Caspase-9抗体均购自武汉华联科有限公司;JNK1/2抗体购自南京建成生物工程研究所;苏木素、伊红购自武汉博士德生物有限公司;中性福尔马林、酒精、二甲苯购自天津科密欧有限公司。
1.1.3仪器 BS-124s 型电子天平购自北京赛多斯仪器系统有限公司;TDL-5 型台式离心机购自上海安亭科学仪器厂;光学显微镜购自东莞市同创仪器有限公司;切片机购自德国Leica公司;低温离心机购自湖南恒诺离心机有限公司;蛋白电泳及转膜仪购自美国Bio-Rad公司;彩色多普勒超声诊断仪购自飞利浦公司。
1.2方法
1.2.1建立模型 制作急性HF模型及判断造模是否成功参考周彦希等[7]研究结果。具体操作如下:麻醉大鼠后,分离右颈总动脉 1.5 cm,动脉夹夹住近心端,经颈动脉朝近心端方向注入肝素钠生理盐水,使用镊子夹住颈总动脉及导管,将导管插入左室腔。当大鼠血压波变成下沿达0 mmHg 附近,表明导管已经通过主动脉瓣进入左室腔内,所有信号均同步记录于生理记录仪,记录一段正常值后,各组于股静脉注射盐酸普罗帕酮注射液,注射剂量为16.5 mg/kg,当左心室内压最大上升速率和内压最大下降速率降到正常值的 2/3 以下并维持 5 min 以上且无上升倾向时,可认定造模成功。
1.2.2分组及药物干预 将100只大鼠分为5组,每组20只,分别为健康对照组(Control)、模型组(Cardiac failure)、低浓度RST组(2.5 mg/kg)、中浓度RST组(5 mg/kg)、高浓度RST组(10 mg/kg);RST用研钵研磨成粉末后按比例用生理盐水配制成混悬液,每日早晨7:00按剂量灌胃,持续14 d;对照组灌胃给予等量生理盐水。
1.2.3血流动力学检测 RST治疗结束 24 h 后使用10%水合氯醛麻醉大鼠,彩色多普勒超声仪检测各组大鼠平均动脉压(mean artery pressure,MAP)、左室收缩压(left ventricular systolic pressure,LVSP)以及心率(heart rate,HR)。
1.2.4ELISA检测大鼠血清内相关酶水平 从颈总动脉插管接取2 ml大鼠血液,按照肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(CK-MB)、Mb、iNOS和IL-1β试剂盒说明书的操作方法,使用ELISA法检测大鼠血清中各成分水平。
1.2.5HE染色观察大鼠心肌损伤 HE染色观察大鼠心肌损伤,常规脱水、染色、切片厚度为4~6 μm,×400倍光学显微镜下观察大鼠心肌损伤情况。
1.2.6免疫组化检测IL-6表达 取各组大鼠心肌组织样本经多聚甲醛固定后,做成组织切片,按照试剂盒说明书操作进行IL-6免疫组化染色,步骤如下:将组织切片用二甲苯溶液以5 min/次浸泡2次后,梯度浓度乙醇水合,即依次在无水乙醇、95%、85%、70%乙醇中各浸泡5 min;PBS浸洗3次,加2滴3% H2O2-甲醇溶液孵育10 min,PBS清洗3次;加入血清封闭20 min,用一抗、二抗依次室温孵育30 min,PBS清洗3次,DAB显色、复染、脱水、封片,显微镜下观察组织中蛋白表达。
1.2.7Western blot 检测蛋白表达水平 10%SDS-PAGE提取总蛋白,半干法将蛋白转移至PVDF膜,置于5%脱脂奶粉室温封闭2 h后加入各需要检测蛋白的一抗孵育过夜、二抗孵育2 h,TBS洗净,以GAPDH为内参蛋白,显色液显色后行吸光度分析,计算各蛋白相对表达量。
1.3统计学分析 采用SPSS20.0软件和GraphPda Prism5软件对数据进行处理和分析作图,方差分析使用单因素方差分析(ANOVA),当组间差异有统计学意义时,进一步采用SNK方法进行比较;使用ANOVA时,P<0.05表示差异有统计学意义,本研究所有检验均为双侧检验。
2 结果
2.1大鼠心脏功能检测结果 由图1可知,相比于健康对照组,模型组大鼠MAP、LVSP、HR显著降低(P<0.05);相比于模型组,RST各组大鼠MAP、LVSP、HR水平呈剂量依赖性升高(P<0.05)。
2.2大鼠血清相关酶检测结果 如图2,相比于健康对照组,模型组大鼠CK、Mb、CK-MB水平显著升高(P<0.05);相比于模型组,RST各组大鼠CK、Mb、CK-MB水平呈剂量依赖性降低(P<0.05)。
2.3大鼠体内氧化应激反应检测结果 由图3可知,相比于健康对照组,模型组大鼠ROS、MDA水平显著升高,SOD水平显著降低(P<0.05);相比于模型组,RST组大鼠ROS、MDA水平呈剂量依赖性降低(P<0.05),SOD水平呈剂量依赖性升高(P<0.05)。
2.4大鼠急性HF病理检测结果 HE染色显示,相比于健康对照组,模型组大鼠心肌细胞排列混乱,且死亡细胞较多;相比于模型组,RST组有较少的心肌细胞死亡,细胞排列较为整齐;RST组基本无死亡心肌细胞且排列较为整齐;高浓度RST组大鼠心肌细胞排列整齐且较为完整(图4A)。相比于健康对照组,模型组大鼠IL-6阳性率、IL-1β、iNOS水平显著升高(P<0.05);相比于模型组,RST组IL-6阳性率、IL-1β、iNOS水平呈剂量依赖性降低(P<0.05,图4B、C)。

图1 大鼠心脏功能检测结果Fig.1 Test results of rat cardiac functionNote:Compared with Control,*.P<0.05;compared with Cardiac failure group,#.P<0.05.
2.5大鼠心肌组织内相关凋亡因子水平检测结果

图2 大鼠血清相关酶检测结果Fig.2 Test results of serum related enzymes in ratsNote:Compared with Control,*.P<0.05;compared with Cardiac failure group,#.P<0.05.

图3 大鼠体内氧化应激反应检测结果Fig.3 Test results of oxidative stress response in ratsNote:Compared with Control,*.P<0.05;compared with Cardiac failure group,#.P<0.05.


图4 大鼠急性HF病理检测结果Fig.4 Pathological test results of acute HF in ratsNote:Compared with Control,*.P<0.05;compared with Cardiac failure group,#.P<0.05.

图5 大鼠心肌组织内相关凋亡因子水平检测结果Fig.5 Test results of related apoptotic factors levels in rat myocardial tissuesNote:1.Control;2.Cardiac failure;3.RST(2.5 mg/kg);4.RST(5 mg/kg);5.RST(10 mg/kg).Compared with Control,*.P<0.05;compared with Cardiac failure group,#.P<0.05.
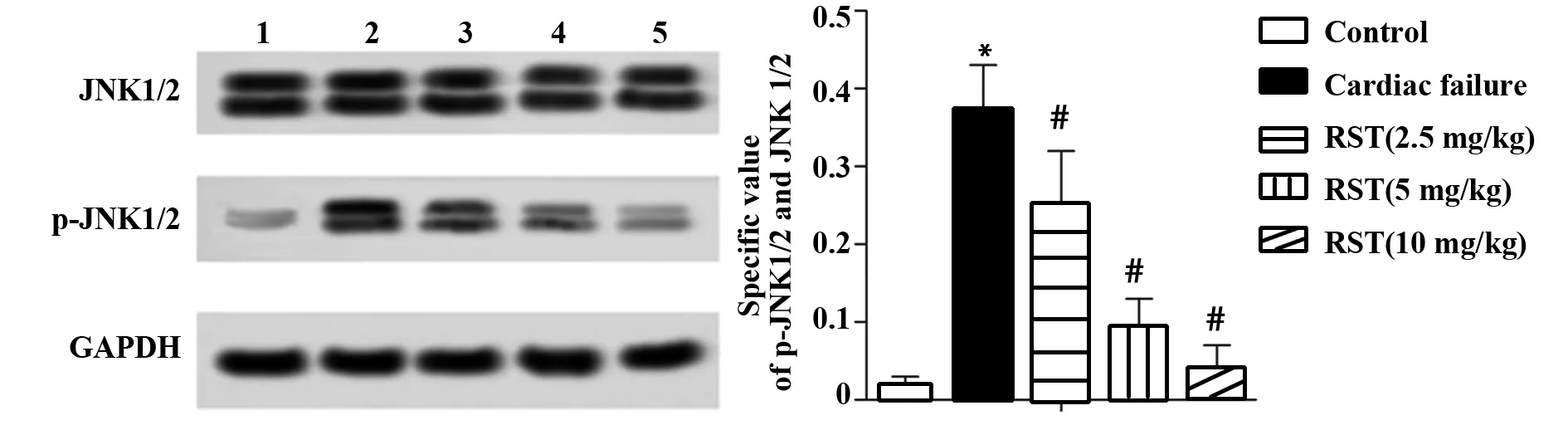
图6 大鼠心肌组织内JNK1/2磷酸化水平检测Fig.6 Phosphorylation level detection of JNK1/2 activation in rat myocardial tissuesNote:1.Control;2.Cardiac failure;3.RST(2.5 mg/kg);4.RST(5 mg/kg);5.RST(10 mg/kg).Compared with Control,*.P<0.05;compared with Cardiac failure group,#.P<0.05.
由图5可知,相比于健康对照组,模型组大鼠心肌组织内Caspase-3、Caspase-9蛋白表达显著升高(P<0.05);相比于模型组,RST各组大鼠心肌组织内Caspase-3、Caspase-9蛋白表达呈剂量依赖性降低(P<0.05)。
2.6大鼠心肌组织内JNK1/2磷酸化水平检测 相比健康对照组,模型组大鼠JNK1/2磷酸化水平显著升高(P<0.05);与模型组相比,低、中、高剂量RST组大鼠 JNK1/2磷酸化水平显著降低(P<0.05),见图6。
3 讨论
LVSP是心脏向动脉射血的主要动力,在心脏舒张时内压降低,腔静脉血压回流入心脏,心脏每收缩和舒张1次构成1个心动周期[8]。1个心动周期中动脉血压的平均值称为MAP。心脏功能检测结果显示,RST处理后MAP、LVSP、HR显著升高,说明RST可有效调节大鼠心脏的收缩和舒张,使大鼠HF得到有效缓解。闫志琳等[9]研究表明,他汀类药物可有效调节心脏功能,与本研究结论一致。
氧化应激是加重急性HF的重要原因之一[10]。抗氧化体系主要包括酶系和非酶系两类,酶体系中, 最主要的是 SOD, 其含量可直接反映氧化应激的程度[11]。本实验中发现,模型组大鼠体内SOD含量显著减少,说明大鼠心肌组织中氧化应激反应显著增强。RST处理后,SOD含量显著增加,提示其氧化应激受到了抑制,且随着RST处理浓度增加,SOD含量显著升高,说明RST可呈剂量依赖性降低大鼠体内氧化应激反应。赵高远等[12]研究表明,SOD可反映体内氧化应激能力的强弱,提高SOD浓度可有效抑制氧化应激反应,与本研究结论一致。李博萍等[13]研究表明,急性HF患者体内过氧化产物如MAD含量增加,且会导致患者机体的抗氧化能力减弱,促使心肌细胞和线粒体膜受损,引起血清丙氨酸转氨酶升高,同时也会使心肌组织游离脂肪酸(FFAs)水平明显升高,诱发细胞功能障碍[14]。MAD含量可反映机体内脂质过氧化程度,使自由基与生物膜中的多不饱和脂肪酸发生反应并使氧化产物分解,提示MAD含量可间接反映细胞损伤程度[15]。血清中IL-6、iNOS水平与心肌炎症呈正相关,心肌细胞炎症越严重,则IL-6、iNOS水平越高,心肌细胞损伤的程度越高[16]。本研究表明,RST处理后IL-6、iNOS、IL-1β、iNOS水平显著降低,说明RST可以有效降低大鼠心肌组织中的氧化应激反应和炎症反应,缓解大鼠急性HF症状。高好考等[17]研究表明,他汀类药物可调节心肌组织中的氧化应激反应和炎症反应,与本研究结论一致。
细胞凋亡是一种在形态学上和坏死完全不同的细胞死亡类型[18]。Caspase-3和Caspase-9是细胞中重要的凋亡因子。Caspase 家族中主要执行凋亡的基因为Caspase-3,这种有活性的 Caspase-3可通过剪切另外的 Caspase底物达到引起级联反应的目的最终导致细胞凋亡[19]。本研究表明,RST处理后心肌组织中Caspase-3和Caspase-9蛋白表达显著降低,说明RST可有效降低Caspase-3和Caspase-9蛋白表达。谢亚芹等[20]研究表明,RST可降低细胞内凋亡因子表达,缓解细胞凋亡,与本研究结论一致。
JNK信号通路属于 MAPK(mitogenactivated protein kinase)信号通路[21]。WANG等[22]研究表明,JNK 信号通路在调控急性HF中发挥重要作用。目前关于JNK 信号通路在调控急性HF的中主要存在以下方式:①通过炎症因子激活JNK 信号通路。目前主要可以激活JNK信号通路的炎症因子为IL-1和TGF-β,这些炎症因子可以直接激活 TGF-β激酶 1,同时也可以通过激活Toll样受体(包括TLR-3、TLR-4 和 TLR-9和 B 细胞、T 细胞受体)激活TGF-β,使JNK通路被激活;②王慧莲等[23]研究表明,活性氧ROS可通过抑制 MAPK 磷酸酶获得持续性的 JNK 通路激活。本研究发现,RST处理后心肌组织中p-JNK1/2和JNK1/2比值显著降低,说明JNK1/2蛋白的磷酸化和JNK1/2的活化被抑制。提示RST可通过抑制JNK1/2的活化抑制大鼠心肌组织内的氧化应激反应和炎症反应,缓解大鼠心肌细胞损伤。黄宏超等[24]研究表明,RST可通过抑制JNK通路缓解大鼠心肌细胞损伤,与本研究结论一致。
综上所述,RST可抑制JNK1/2的活化,调节急性HF大鼠心脏血流动力学及免疫应答并抑制氧化应激反应,且在一定浓度范围内呈浓度依赖性,其作用机制可能与抑制JNK1/2磷酸化和促进凋亡因子表达有关。但本研究设置的浓度梯度较少,在后续的实验中将进一步增加浓度梯度进行实验,研究不同浓度RST对急性HF大鼠心脏血流动力学及免疫应答并抑制氧化应激反应。