胃肠道间质瘤诊疗进展
2021-01-26陈天文王利利刘牧林
陈天文, 王利利, 刘牧林
(蚌埠医学院第一附属医院胃肠外科, 安徽 蚌埠233004)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST) 是最常见的胃肠、 肠系膜、 网膜和腹膜间质性肿瘤, 起源于胃肠道的Cajal 细胞, 免疫组化显示酪氨酸激酶受体KIT 蛋白(CD117 抗原) 几乎普遍表达[1]。 胃肠道原发肿瘤中仅有1%为GIST, 年发病率约为1.5/10 万[2-3]。 来自美国的一项研究报告了诊断的中位年龄为64 岁[4]。 GIST主要发生部位为胃(60%~70%) 和小肠(20%~25%), 其次为十二指肠 (4% ~5%)、 结直肠(4%)、 食管(1%) 等部位[5]。 常见的临床表现为消化道出血、 腹部可触及肿块及腹部不适或疼痛[6]。 但有相当比例的GIST 是在调查过程中因其他原因偶然发现的。 因此, GIST 的发生率可能高于报道。 在其肿瘤分子发生机制中, KIT 或血小板衍生生长因子受体α (platelet derived growth factor receptor alpha, PDGFRA) 基因的功能突变与GIST密切相关, 而酪氨酸激酶抑制剂(TKIs) 可以通过抑制相关信号通路来治疗GIST[7]。 其中, 约10%~15%的GIST 患者无KIT 和PDGFRA 基因突变, 称为野生型GIST, 主要见于青年及儿童。
1 GIST 发病机制
1983 年, Mazur 等[8]通过回顾性研究以往的消化道间叶肿瘤, 发现是一种无平滑肌分化和神经源性分化的起源不明的胃肠道梭形细胞肿瘤,首次将其命名为GIST。 随着分子生物学的发展,1998 年, Kindblon 等[9]研究结果显示, GIST 与胃肠道Cajal 细胞具有相似的KIT 基因、 CD117、CD34 阳性表达。 同年日本学者Hirota 等[10]发现大部分GIST 存在KIT 原癌基因功能突变, 其编码的KIT 蛋白(CD117) 组织高表达, 并指出在肿瘤的发生和增殖过程中, 这种获得性功能基因突变起到关键性作用。 这一历史性发现, 跨越式的推进了GIST 基础研究和临床诊治的进程。
目前认为GIST 的发病与获得性功能基因突变相关, 80%~85%由原癌基因KIT 突变, 5%~10%由PDGFRA 基因突变。 约10%~15%的GIST 患者无KIT 和PDGFRA 基因突变, 称为野生型GIST,其发病机制主要包括以下几种: BRAF 基因突变型、 SDH (琥珀酸脱氢酶) 缺陷型、 NF1 (1 型神经纤维 瘤病) 基因型、 ETV1 基因 突 变等[11]。GIST 其中KIT 突变最常见于11 号外显子(66%~71%), 其次是9 号外显子(10%~13%), 罕见位于13、 14、 17 号外显子; PDGFRA 基因突变最常见于18 号外显子(5%~6%), 少部分位于12、 14外显子[12-13]。 近年来发现一个新的特异性标志物DOG-1, 为C 蛋白激酶, 在95%的GIST 中免疫组化染色阳性[14]。 由于DOG-1的敏感性和特异性均比较好, 在GIST 的诊断及鉴别诊断中, 以DOG-1为代表的免疫蛋白阳性表达具有决定性的作用[15]。
2 GIST 恶性倾向评估
GIST 是消化道最常见的间叶源性肿瘤, 在临床表现和生物学行为上可以从良性发展至恶性,GIST 的危险度分级评估对患者的预后、 诊治、 提高患者生活质量及延长生存期至关重要。 参照改良后2008 版的美国国立卫生院 (NIH) 分级标准[16](表1) 以及2013 版中国胃肠道间质瘤病理诊断共识[17], 根据肿瘤大小以及位置、 核分裂象数及瘤体是否破裂, 将肿瘤分为极低危、 低危、中危、 高危4 组。
3 GIST 的诊断
3.1 螺旋CT 多层螺旋CT 在诊断GIST 以及鉴别肿瘤良恶性方面比传统的X 线造影更加便捷[18]。 螺旋CT 检查可明确肿瘤位置、 肿瘤直径、组织密度、 有无淋巴结转移, 为GIST 危险度分级、 制定诊治方案、 预后评估提供依据[18]。 CT 还具有简便、 高效、 安全无损伤等优点。 Vasconcelos等[19]对111 例小肠GIST 进行了增强CT 检查, 发现肿瘤的生长主要是外生的、 管腔内的和混合的,中等程度的不均匀增强, (3.5±2.4) cm 为低到中等危险度, (7.5±4.9) cm 为高危险度, (9.2±7.6) cm 为恶性; 肿瘤边界不规则 (OR =5.8,95%CI: 1.49~20.69, P =0.011) 与GIST 的恶性程度相关。
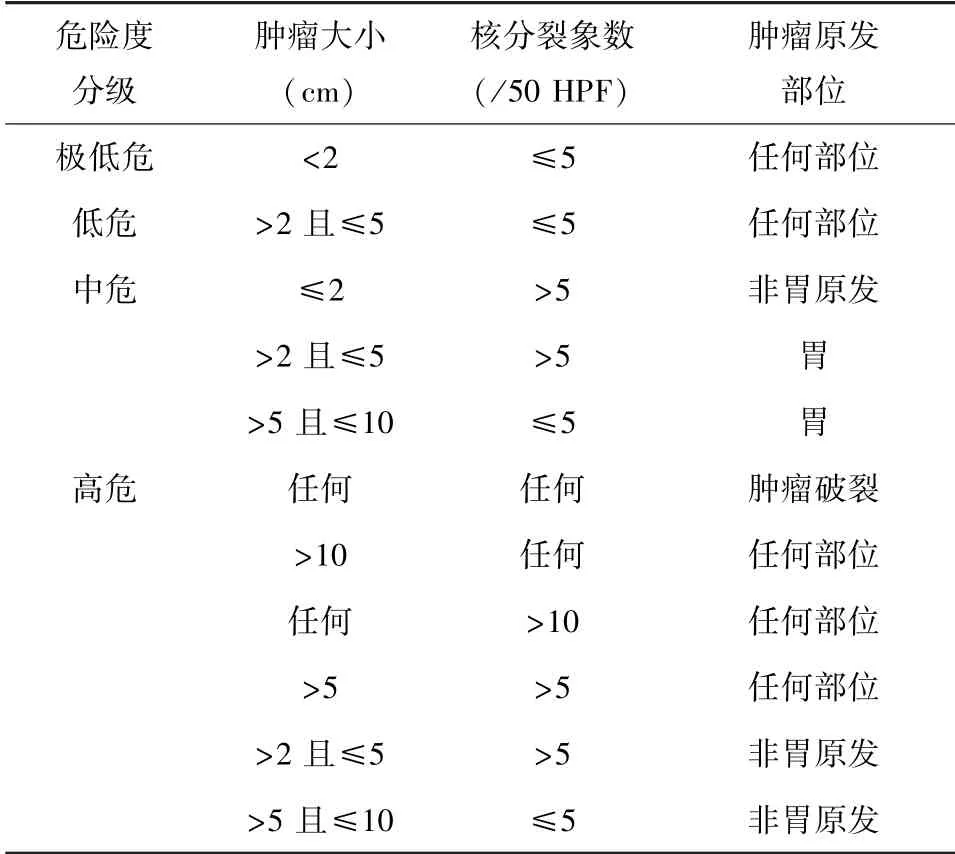
表1 GIST 危险度分级标准(NIH)[16]
3.2 PET-CT PET-CT 是当今最先进的影像成像技术, 对GIST 诊断有着极高的敏感性, 通过分析最大标准摄取值(SUVmax) 亦可判断GIST 的侵袭危险性, 在肿瘤的分期及早期疗效评估中优势明显, 在临床诊疗过程中被广泛认可, 并被写入美国国立综合癌症网络 (NCCN) 指南2018版[20]。 李生栩等[21]对31 例GIST 的PET-CT 检查结果提示, 在SUVmax 阈值为3.75, 其诊断恶性GIST 的特异度和敏感度分别为100%和84.6%。但PET-CT 费用较高, 不推荐作为常规的检查手段。
3.3 腹部超声 腹部超声可以从不同角度实时动态观察肿瘤的大小和组织形态, 可观测肿瘤组织血供以及与周围脏器的联系, 具有便捷无创等优点, 对评估GIST 危险度分级亦有一定程度的参考价值, 较大的肿瘤、 粗糙的表面、 不均匀的纹理回声、 液化坏死和钙化通常表明存在高浸润的风险[22]。 但是腹部超声容易受到胃肠道气体的干扰,与超声员的操作水平和临床经验密切相关, 因此很难做出准确的诊断。
3.4 超声内镜(endoscopic ultrasound, EUS ) EUS 检查可反映出黏膜下病变的肿瘤大小、 肿瘤壁层的来源、 血供、 回声以及肿瘤边缘形态等,对黏膜下隆起性病变诊断符合率可达98.21%[23]。EUS 还可以评估胃间质瘤的侵袭危险性, 一定程度上可指导临床治疗方案[24]。 Kim 等[25]对胃间质瘤内镜超声图像亮度值和异质性的数字定量分析,其诊断胃间质肿瘤的敏感性(94.0%) 和特异性(80%), 可以帮助将胃间质肿瘤与其他间质肿瘤区分开。 Yamashita 等[26]报道, 应用造影增强超声内镜(CE-EUS) 来评估GIST 内新生大血管的侵袭危险性, 提示这些血管与血管内皮生长因子(VEGF) 表达及高度侵袭危险性相关。
3.5 超声内镜下细针穿刺活检(EUS-guided fine-needle aspiration, EUS-FNA ) EUS-FNA 是对黏膜下肿瘤组织取样的最可靠方法, 可取出一定量的活检组织, 提供给免疫组织化学诊断。 Sekine等[27]研究发现, EUS-FNA 对诊断GIST<20 mm 的敏感性和阳性预测值分别为81.3%和100%。 随着肿瘤直径的减小, EUS-FNA 的诊断率也逐渐下降, 小于1 cm 的黏膜下肿瘤的诊断存在桎梏。 新开发的前瞻性和弯曲线性阵列回波内窥镜[28]及钻针[29]有望改善GIST 的诊断率。 其不足之处是取材较少, 无法计算有丝分裂数以评估GIST 恶性倾向。 也有部分专家表示对于可完整切除的GIST,不推荐常规活检, 以免肿瘤播散。
3.6 超声内镜下中心穿刺活检(EUS-guided core needle biopsy, EUS-CNB) EUS-CNB 是用一根带芯细针穿刺活检获得整块组织, 而非EUS-FNA获取的一簇细胞, 可获得更多的组织供免疫组化染色和计算有丝核分裂数以评估危险度, 其诊断的准确度高于EUS-FNA。 然而, 一项对17 项研究的Meta 分析显示, EUS-CNB 和EUS-FNA 在GIST诊断率方面差异无统计学意义[30]。
3.7 病理及免疫学诊断 GIST 的诊断取决于组织病理学和免疫组织化学。 病理类型分为梭形细胞类型、 上皮样细胞类型和混合细胞类型(梭形细胞和上皮样细胞类型混合), 其中梭形细胞类型是最常见的[31]。 免疫组织化学检测指标包括酪氨酸激酶受体CD117 (94% ~98%)、 C 蛋白激酶DOG-1 (80% ~90%)、 造血干细胞抗原CD34 的阳性表达。 其中CD117 是GIST 最重要的免疫组织化学检测指标, 有良好的敏感性和特异性, 而在腹腔其他肿瘤中此蛋白很少表达[32]。
4 治疗方法
4.1 手术治疗 根治性手术切除是治疗GIST 的首选方案。 对于肿瘤直径<2 cm 的无症状小间质瘤, 2018 版NCCN 指南建议可暂不手术, EUS 随访观察, 并未限制随访周期[33]。 若EUS 检查发现肿瘤边界不规则、 囊性、 溃疡型及异质性等高危因素, 即使肿瘤直径<2 cm, 也应考虑手术; 当GIST 肿瘤直径>2 cm 时, 则必须进行手术治疗[33]。 中国胃肠道间质瘤诊断治疗共识(2017 年版) 指出, 生长于胃以外的GIST, 由于恶性程度较高, 一旦发现应考虑手术切除[34]。 手术治疗的原则是R0 切除(切缘无肿瘤细胞) 和保留器官功能, 同时应避免术中肿瘤破裂, 以免播散转移,肿瘤是否完全切除以及手术过程中肿瘤是否破裂与患者的预后密切相关[34]。 如果考虑保留器官功能及提高术后生活质量等, 则R1 切除是可行的(切缘有肿瘤细胞), 对于此种情况, 目前的共识支持在手术后进行分子靶向药物治疗, 并且一般不主张进行额外的手术[34]。 有研究表明, GIST 淋巴结转移相对较少, 一般不建议全身淋巴结清扫,但在SDH 缺陷型GIST 中, 必须切除可疑的肿大淋巴结[35]。 也有部分学者认为<2 cm 的GIST 具有较高有丝分裂数, 且患者的随访依从性差, 肿瘤在随访期间会迅速增加, 具有较高的恶性风险[36]。
由于GIST 有破裂后扩散的可能, 不建议对较大的肿瘤进行腹腔镜切除, NCCN 指南认为, 对于肿瘤直径≤5 cm 的GIST 可实施腹腔镜切除, 但对肿瘤直径>5 cm 的GIST 进行腹腔镜切除, 其安全性尚不明确[33]。 Pelletier 等[37]和Piessen 等[38]研究表明, 腹腔镜下行GIST 切除与传统开放手术相比, 患者在术后疼痛、 平均住院时间、 胃肠功能恢复、 手术有效性及安全性等方面具有一定优势。也有学者分析了>5 cm 的GIST 行腹腔镜切除也是安全可行的[39]。
4.2 内镜下治疗 GIST 具有潜在的恶性, 肿瘤的根治性切除是最重要和有效的治疗方法。 内镜微创技术的进展和广泛普及以及普通人群普查认识的提高, 为GIST 的早期发现提供了可能, 为彻底切除肿瘤提供了机会。 内窥镜微创切除术具有减少创伤, 减少术中失血量, 减少手术时间和缩短住院时间方面等优势, 并且不会增加围手术期并发症。 因此, 内窥镜手术被广泛用于切除GIST,尤其是小的胃间质瘤。 现有的内窥镜方法包括内窥镜皮下结扎术(EBL)、 内窥镜黏膜下剥离术(endoscopic submucosal dissection, ESD)、 内窥镜全层切除术 (endoscopic full-thickness resection,EFTR)、 内窥镜黏膜下隧道切除术(submucosal tunneling endoscopic resection, STER) 以及腹腔镜和内窥镜联合辅助手术 (laparoscopic and endoscopic cooperative surgery, LECS)。
4.2.1 EBL EBL 首先用于治疗食道静脉曲张,随后用于治疗浅表性胃肠道疾病。 EBL 手术方式是将肿瘤吸入透明帽内, 并在基底周围释放皮圈套扎, 之后瘤体便会由于缺血、 坏死而自行脱落。Sun 等[40]进行了针对GIST 的EBL 的首次可行性和安全性研究, 结果表明96.6%的患者已完全切除肿瘤, 并发症发生率3.4%和复发率3.4%均较低,建议EBL 可以应用在<1.2 cm 并且核分裂象数<5个/50 HPF 的间质瘤中。 Meng 等[41]对EBL 与腹腔镜切除术治疗<1.5 cm 的胃间质瘤比较表明, EBL虽然具有手术时间短、 住院费用低、 住院时间短等短期优势, 但复发率较高。
4.2.2 ESD ESD 已经广泛用于黏膜下肿瘤的治疗[42], 主要适应证为: 肿瘤直径<2 cm; 辅助检查提示肿瘤质地均匀, 与周围组织边界清晰, 无消化道浸润转移的迹象; 超声内窥镜检查可清楚显示胃间质瘤后有完整的浆膜层[43]。 Li 等[44]研究结果显示, 对贲门附近黏膜下肿瘤在ESD 治疗下,R0 切除率为90.2%, 平均随访时间为 (26.7±18.4) 个月, 没有肿瘤复发和狭窄, 表明ESD 在切除贲门附近的黏膜下肿瘤的安全性及有效性值得肯定。
4.2.3 EFTR 对于固有肌层深层的病变, ESD 无法将肿瘤完整切除, EFTR 将肿瘤连同消化道管壁整层切除。 EFTR 伴有主动活动性穿孔和壁间缺损, 对该手术, 正确地闭合人工穿孔是很重要的一环[45]。 Shi 等[46]应用EFTR 成功切除68 例固有肌层胃间质瘤, 总切除率为100%, 平均病灶大小为2.6 cm (2.0~3.5 cm), 术后出现1 例Mallory-Weiss 综合征和1 例迟发性出血。
4.2.4 STER STER 是指通过内窥镜及相关附件在消化道黏膜下层建立一空间通道, 并通过该通道进行固有肌层肿瘤切除术。 与其他内窥镜方法相比, STER 具有保持黏膜完整性, 伤口小, 愈合快, 视野清楚, 减少胸膜和腹部感染风险的优势。Ye 等[47]采用STER 成功切除19 例来源于胃固有肌层的GIST, R0 切除率为100%, 平均随访8 个月, 无肿瘤复发, 证实STER 对治疗直径≤3 cm的固有肌层GIST 安全性及可行性。 STER 的并发症主要是气体相关的并发症, 穿孔出血和胸腔积液等。 一项涉及290 个样本的临床研究显示, 在较高的并发症总发生率(23.4%) 中只有10.0%的并发症需要治疗干预[48]。
4.2.5 LECS LECS 与单一腹腔镜治疗相比较,具有手术时间较短, 定位精准, 可保留更多正常组织, 并发症发生率低等优势。 Balde 等[49]发现,与ESD 相比, LECS 的术中并发症和术中出血发生率更低, 在57.9 (平均28.9) 个月的随访中, 2组的复发率差异无统计学意义 (分别为0.0 和6.7%, P =0.256 )。 另外, Ojima 等[50]也发现,与内镜胃内手术相比, LECS 具有更低的围手术期并发症发生率, 且患者更早恢复流质饮食。
4.3 药物治疗
4.3.1 分子靶向药物治疗 伊马替尼是KIT 和PDGFRA 的分子靶向抑制剂, 可以选择性抑制酪氨酸激酶的活性, 从而阻断细胞信号转导并诱导肿瘤细胞凋亡, 在GIST 治疗中取得了良好的疗效。 NCCN 及ESMO (欧洲肿瘤内科协会) GIST诊疗指南推荐伊马替尼(400 mg/d) 作为局部进展期、 复发及转移性GIST 治疗的一线标准治疗方案[51]。 建议进行基因检测以排除对伊马替尼治疗有抵抗的基因型(例如PDGFRA 外显子18 D842V突变的GIST 和与NF1 相关的GIST)。 具有KIT 外显子9 突变的患者, 在患者能耐受的情况下, 推荐伊马替尼的初始剂量为800 mg/d[18,51]。
伊马替尼耐药性: 可分为原发性和继发性耐药。 原发性耐药可能与KIT 基因外显子9 突变,野生型基因和PDGFRA 外显子18 D842V 突变有关。 继发性耐药的原因可能是KIT 或PDGFRA 基因的二次突变, 这是伊马替尼治疗失败的最常见原因。 当发生耐药性或疾病进展时, 治疗剂量可增加至600 mg/d, 最高可达800 mg/d[18,51]。 那些在增加剂量后仍进展或不能耐受伊马替尼的人可以改用二线分子靶向药物舒尼替尼, 其抑制KIT、PDGFRα 和PDGFRβ 的活性, 阻断VEGFR (血管内皮生长因子受体) 和Flt3 (Fms 相关的酪氨酸激酶3 受体)[52]。 舒尼替尼可使晚期GIST 患者获益, 其中位无进展生存期达8 个月, 并使KIT 外显子9 突变型及野生型GIST 患者明显受益[18]。 推荐行4/2 给药方案(连续口服37.5 mg/d, 或者50 mg/d, 连用4 周, 休息2 周)。 对一线和二线药物均耐药的GIST 患者可以使用三线药物从中获益,例如瑞伐非尼、 氟马替尼或帕唑帕尼[18,51-52]。
4.3.2 免疫治疗 目前还有针对GIST 的免疫治疗, 如IFN-α 联合伊马替尼、 抗KIT 单克隆抗体、抗KIT 抗原的专门设计T 细胞(designer T cell,dTc)、 阻断细胞毒性T 淋巴细胞相关蛋白4(cytotoxic T lymphocyte-associated protein 4, CTLA-4)、 PD1/PD-L1 阻断、 半乳凝素9 (galectin9)及其受体T 细胞免疫球蛋白黏蛋白3 (T cell immunoglobulin and mucin protein 3, Tim3) 即Tim3/galectin9 通路阻断等在动物模型中取得了不错的临床实验结果, 这些免疫治疗具有良好的发展前景, 为GIST 耐药问题开辟了新思路[53-55]。
5 小结与展望
多学科协作的综合治疗对GIST 患者尤为重要, 早期诊断和早期完整手术切除配合分子靶向药物是其最佳治疗方法。 随着腹腔镜和内窥镜技术的发展, 微创治疗为GIST 患者提供了更多的思路。 在制定个性化治疗方案以及预测GIST 分子靶向治疗的疗效和预后方面, 基因检测的作用越来越重要。 其耐药机制有待进一步探索, 并应加快新药的研发。 相信在不久的以后可以有更精湛的医疗技术及新型靶向药物以改善GIST 患者的预后。
