基于网络药理学与分子对接技术的莪术抗肝癌作用机制研究
2021-01-26干泓侠
李 婧,干泓侠
(1.西南民族大学药学院,四川 成都 610041;2.四川大学生物治疗国家重点实验室,四川 成都 610041)
肝癌是常见的消化系统恶性肿瘤之一,由肝细胞癌、肝内胆管细胞癌及混合型肝癌等组成,约90%是肝细胞癌(hepatocellular carcinoma,HCC).近年来,肝癌发病率正在逐年增加,全世界每年新增患者近80万例[1].我国是肝癌高发国家且呈明显的上升趋势,每年新增患者约40万[2].肝癌的临床治疗主要以手术为主,放射介入、局部消融、靶向治疗及生物基因治疗等新的治疗技术也为患者提供了多种治疗途径[3],然而以上方法并不能用于所有患者,都有各自局限的适应症.因此,寻找靶向清晰、高效低毒的新型抗肝癌药物成为肝癌药物研究的重要任务.
莪术(Curcumae Rhizoma)是姜科植物蓬莪术、广西莪术及温郁金的干燥根茎,味辛、苦、温,归肝、脾经,具有消积止痛、行气破血的功效,中医用于治疗瘀血经闭、癥瘕痞块、食积胀痛及胸痹心痛等病症[4].现代医学实验证实莪术对乳腺癌、胃癌、卵巢癌、鼻咽癌、结肠癌、肝癌等多种癌症具有一定的抗癌活性[5-7].莪术中的多种成分如β-榄香烯、吉马酮、姜黄素等物质被证实对肝癌细胞具有较好抑制的作用[8-10],然而莪术治疗肝癌的整体作用机制尚不清楚.中药治疗肿瘤可作用于肿瘤发生发展的多个环节,具有多成分、多途径、多靶点协同作用的特点.网络药理学通过检索网络数据库,构建“疾病-靶点-药物”的网络关系,能从整体上预测药物作用靶点及作用机制[11],符合中药多成分、多途径、多靶点的研究思路.本研究采用网络药理学的角度研究莪术抗肝癌的物质基础及作用机制,为进一步实验研究莪术抗肝癌的作用提供参考.
1 材料与方法
1.1 莪术化学成分的获取及筛选
利用中药系统药理学分析平台数据库TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)搜莪术的主要化学成分.本研究为尽可能多的筛选到有效化合物,以药物相似性(drug-likeness,DL)≥0.10,口服生物利用度(oral bioavailability,OB)≥30%为参考评估候选化合物.同时,查阅CNKI及PubMed等数据库与莪术成分相关的文献,收集莪术化学成分,结合本课实验室前期研究,挖掘并整理莪术抗癌活性成分,对在TCMSP数据库筛选到的活性物质进行确证和补充,建立“莪术化学成分数据库”.
1.2 活性成分作用靶点筛选
对1.1中得到的潜在活性化物进行作用靶点筛选,相应靶点从两条途径获得:(1)在TCMSP数据库以化合物名检索并整理其靶点;(2)将TCMSP数据库筛选得到的化合物链接到PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载化合物结构以及分子信息.PharmMapper(http://lilab-ecust.cn/pharmmapper/)是一个可以通过反向分子对接方法预测化合物靶点的服务平台[12],将化合物的3D结构SDF格式上传到PharmMapper平台,选择人类数据库,预测每种化合物的可能作用靶点.将(1)、(2)两种途径预测得到的化合物靶点进行整合,对应到Uniprot(http://www.uniprot.org/)蛋白数据库统一为靶基因名,建立“化合物-靶点数据库”.
1.3 肝癌相关靶点的搜集及筛选
在OMIM(http://www.ncbi.nlm.nih.gov/omim)及GeneCards(https://www.genecards.org/)数据库中输入关键词“hepatocellular carcinoma”检索已报道的与肝癌相关的基因,去除假阳性基因和重复基因,与“1.2”中得到的莪术活性成分作用靶点进行匹配,采用R语言加载“VennDiagram”数据包,画出韦恩图并取交集,获取各数据集共有差异表达基因,得到莪术中活性成分抗肝癌的潜在作用靶基因.
1.4 莪术活性“成分-疾病-作用靶点”网络构建与分
Cytoscape软件能将药物治疗疾病的活性成分及作用机制进行可视化分析[13].将莪术化学成分及抗肝癌作用靶点信息导入Cytoscape(Version 3.7.1)软件,构建“成分-疾病-作用靶点”网络图.在关系网络图中,其中的节点(node)表示化合物、疾病或靶蛋白.其中边(edge)表示节点分子之间的互关系.网络中每个节点的重要性都通过度数(Degree)和接近中心度(Betweenness Centrality)进行评估[14].节点的Degree表示与其相连的边的个数,Degree越大表示参与的生物功能越多,提示该节点在作用网络中越重要.
1.5 蛋白相互作用网络(PPI)的构建与分析
String数据库(https://string-db.org/)是一个收集了大量的蛋白相互作用关系的数据库,可以预测靶蛋白之间相互作用关系的数据库[15].将莪术抗肝癌的潜在作用靶点信息导入String数据库,物种设置为人,得到蛋白互作关系,保存TSV格式结果及蛋白互作图片,用R语言计算核心基因并画图.
1.6 生物过程分析
“ClusterProfiler”是Bioconductor的一个软件包,可以对基因cluster或基因集合进行功能聚类的统计及可视化分析.在R语言中加载“clusterProfiler”包,对莪术活性成分潜在作用靶点进行Gene Ontology(GO)和Kyoto Encyclopedia of genes and Genomes(KEGG)通路富集分析,阈值设定为P≤0.05,统计筛选出具有显著性差异的生物过程及作用通路.并绘制柱状图、点状图及作用通路图.
1.7 分子对接
利用UniProt检索“1.5”中得到的关键靶蛋白的PDB ID,从RSCB PBD数据库(http://www.rcsb.org/pdb/home/home.do)下载PBD格式的3D结构文件,利用AutoDock Tools及PyMOL软件对下载的靶蛋白进行去水、加氢、加电子等前处理,并根据文献报道的靶蛋白活性位点或靶蛋白中配体的坐标初步确定分子对接的活性位点.采用AutoDock Vina进行分子对接,根据靶蛋白与配体的结合自由能判断其亲和力.
2 结果
2.1 莪术活性成分筛选
通过TCMSP数据库搜集莪术化学成分共81个,以OB≥30%,DL≥0.1为标准筛选化合物得到17个化合物.同时,对大量已报道文献进行挖掘与整理,结合本实验室前期研究,筛选具有抗癌活性的化合物,将TCSMP数据库与文献整理得到的化合物进行综合,补充包括beta-elemene、curcumol、curdione、daucosterol、demethoxycurcumin、curcumadiol及germacrone等7种化合物,这几种化合物中curcumin、beta-elemene、germacrone及curdione虽然OB或DL值较低,但是文献报道具有抗癌活性的重要化合物[7-9],因此我们也作为莪术抗癌活性成分进行研究.综上研究,最终得到24个莪术活性成分,见表1.

表1 莪术中的主要活性成分Table 1 Main active ingredients in Curcumae Rhizoma
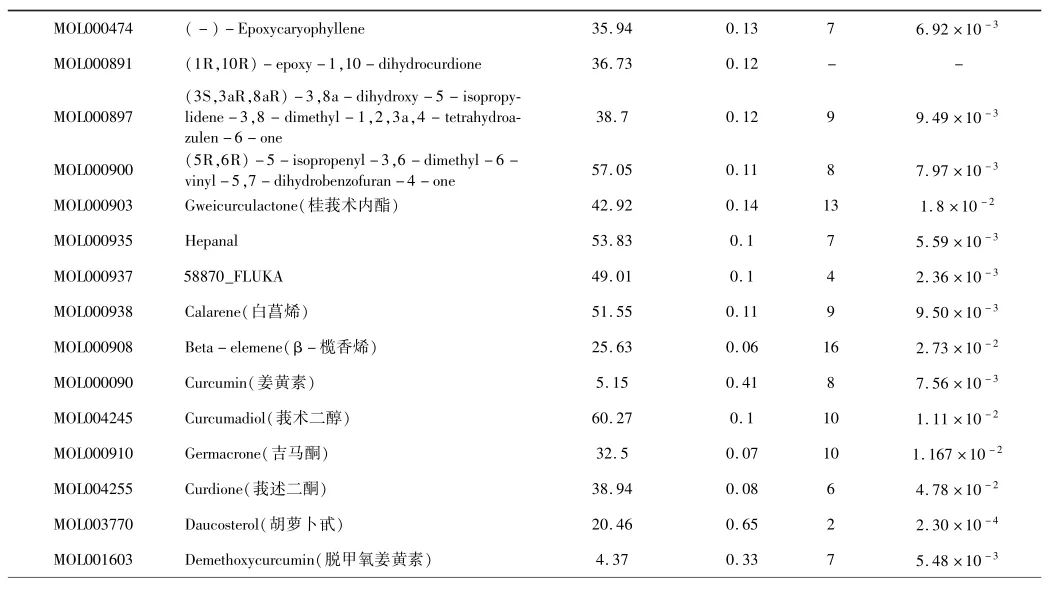
OB,oral bioavailability;DL,drug-likeness
2.2 莪术抗肝癌靶点预测
将以上24种化合物在TCMSP中检索,收集蛋白靶点.同时,将以上24种化合物在PubChem数据库种获得的3D结构上传至PharmMapper,预测每种化合物的作用靶点,将以上两种方式获得的化合物作用靶点进行整合,映射到Uniprot数据库中统一为基因名,去除重复靶点,共得到276个蛋白靶点.采用R语言将上述基因与在GeneCards及OMIM数据库检索到已报道的与肝癌相关的基因取交集,获取各数据集共有差异表达基因,得到莪术活性成分抗肝癌的潜在作用靶蛋白共73个,见表2.
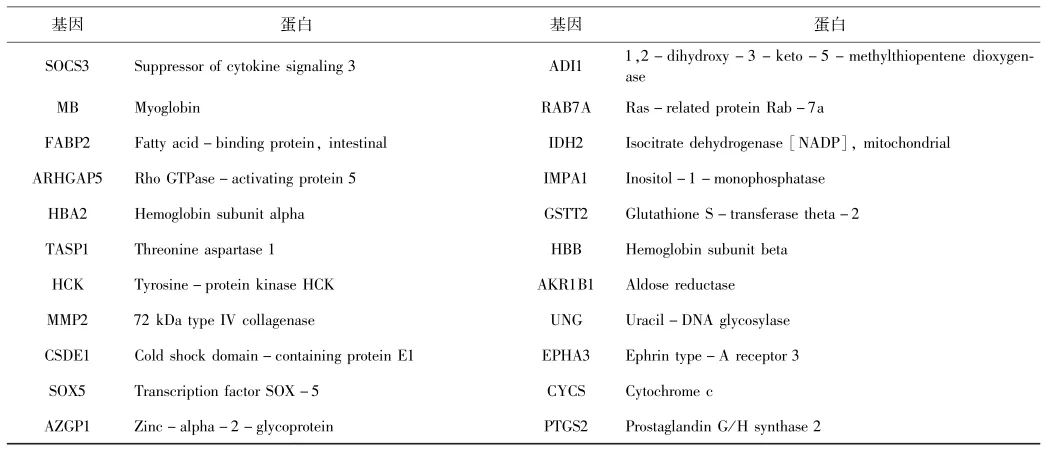
表2 莪术抗肝癌潜在靶蛋白信息Table 2 Information of potential anti-HCC targets from Curcumae Rhizoma

GOT1 Aspartate aminotransferase,cytoplasmic RXRA Retinoic acid receptor RXR-alpha MAPK9 Mitogen-activated protein kinase 9 SLC6A2 Sodium-dependent noradrenaline transporter IDH1 Isocitrate dehydrogenase[NADP] PTGS1 Prostaglandin G/H synthase 1 C1QBP Complement component 1 Q subcomponentbinding protein,mitochondrial NCOA2 Nuclear receptor coactivator 2 HSP90AA1 Heat shock protein HSP 90-alpha BCL2 Apoptosis regulator Bcl-2 GPI Glucose-6-phosphate isomerase CDKN1A Cyclin-dependent kinase inhibitor 1 GLYCTK Glycerate kinase EIF6 Eukaryotic translation initiation factor 6 S100A11 Protein S100-A11 RB1 Retinoblastoma-associated protein CAT Catalase TP63 Cellular tumor antigen p53 COG2 Conserved oligomeric Golgi complex subunit 2 TEP1 Telomerase protein component 1 FBP1 Fructose-1,6-bisphosphatase 1 CCNB1 G2/mitotic-specific cyclin-B1 PARP1 Poly[ADP-ribose]polymerase 1 RHOA Transforming protein RhoA MAGEA4 Melanoma-associated antigen 4 KCNH2 Potassium voltage-gated channel subfamily H member 2 VDR Vitamin D3 receptor ADH1C Alcohol dehydrogenase 1C MAP3K3 Mitogen-activated protein kinase kinase kinase 3 PGR Progesterone receptor ALOX12 Arachidonate 12-lipoxygenase,12S-type ADRA1B Alpha-1B adrenergic receptor FLNB Filamin-B ADH1B Alcohol dehydrogenase 1B BTK Tyrosine-protein kinase BTK ACHE Acetylcholinesterase UAP1 UDP-N-acetylhexosamine pyrophosphorylase NR3C1 Glucocorticoid receptor CAPN2 Calpain-2 catalytic subunit NR3C2 Mineralocorticoid receptor AMY1A Alpha-amylase 1 CTSD Cathepsin D MAOA Amine oxidase[flavin-containing]A BCHE Cholinesterase H3F3B Histone H3 PRSS1 Trypsin-1 SDHA Succinate dehydrogenase[ubiquinone]flavoprotein subunit,mitochondrial ESR1 Estrogen receptor HPD 4-hydroxyphenylpyruvate dioxygenase AR Androgen receptor ROCK2 Rho-associated protein kinase 2
2.3 莪术“成分-疾病-作用靶点”网络构建
将疾病、莪术活性成分及和作用靶点的信息导入Cytoscape软件,构建“成分-疾病-作用靶点”网络,见图1.如图可见,网络中共涉及98个节点和242条边.其中绿色代表靶点蛋白,蓝色代表活性化合物,红色代表疾病(HCC),黄色代表莪术(ezhu),边代表相互关系.采用Network Analyzer插件分析网络中所有节点的拓扑参数,得到化合物的平均degree为7.2,得到度数越大,说明每个活性成分可作用于多个靶点,因此莪术抗肝癌作用具有多靶点特性.其中度数较大(degree>10)的化合物为beta-elemene,hederagenin,germacrone,gweicurculactone,curcumadiol,每个节点的相对位置由其接近中心度(Betweenness Centrality)决定,接近中心度越大表示越接近其他所有节点.分析显示以上几种成分接近中心度较高,位于网络的中心,是莪术抗肝癌重要的活性化合物.化合物拓扑学参数见表1.
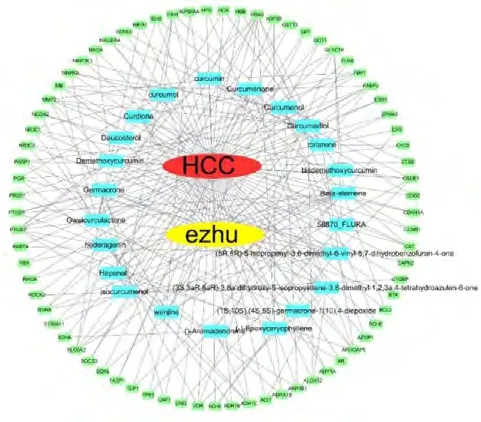
图1 莪术化合物-靶点网络绿色代表靶点蛋白,蓝色代表活性化合物,红色代表疾病(HCC),黄色代表莪术(ezhu)Fig.1 Components-targets network of Curcumae RhizomaThe green is the targets,the blue is the main active ingredients,the red is disease(HCC),yellow is Curcumae Rhizoma(ezhu)
2.4 蛋白相互作用网络(PPI)构建及分析
采用STRING在线工具对73个潜在靶点基因进行编码蛋白相互作用网络(PPI)构建,限定物种为人,获取蛋白相互作用关系,保存其TSV格式文件及PPI图,见图2(a).图中的节点表示靶蛋白,边表示靶蛋白之间的关联,共包括73个节点及199个边.采用R语言计算关键基因,对排名前30基因作图,结果见图2(b),如图可见CAT,CYCS,HSP90AA1,ESR1,PTGS2,PGR,AR,CDKN1A,RHOA等基因在PPI中处于较中心位置,为莪术抗肝癌重要靶基因,可进一步研究.

图2 莪术蛋白相互作用网络图及关键基因(a.蛋白互作网络,b.关键基因)Fig.2 Protein interaction network and key gene of Curcumae Rhizoma(a.Protein interaction network,b.Key gene)
2.5 靶点生物学功能分析
2.5.1 莪术抗肝癌的潜在靶点GO基因功能分析
为了进一步研究莪术抗肝癌作用的分子机制,我们将73个潜在靶点采用R语言中的“clusterProfiler”包进行富集,设定阈值P≤0.05,进行生物学功能富集,共富集到34条生物过程,对前20条过程作图,颜色越红表明富集程度越高,GO分析结果见图3.结果显示,这些靶点主要涉及类固醇激素受体活性(steroid hormone receptor activity)、核受体活性(nuclear receptor activity)、转录因子活性(transcription factor activity)、过氧化物酶活性(peroxidase activity)、氧化还原酶活性(oxidoreductase activity)、与类固醇的结合(steroid binding)、抗氧化活性(antioxidant activity)、核激素受体结合(nuclear hormone receptor binding)、激素受体结合(hormone receptor binding)等生物学功能.这些生物学过程表明网络中莪术作用的肝癌相关靶点主要与激素调节、细胞转录调节、氧化还原等能量代谢过程有关,莪术可能是通过调节这些生物过程发挥其抗肝癌作用.

图3 莪术抗肝癌的潜在靶点GO基因功能分析(A.柱状图;B.点状图)Fig.3 GO analysis of potential targets for Curcumae Rhizoma in treating hepatocellular carcinoma(A.Barplot;B.Dotplot)
2.5.2 莪术抗肝癌的潜在靶点KEGG通路富集分析
采用R语言中的“clusterProfiler”包共富集得到38条信号通路,对前20条通路作图,按照P判断其可靠性,颜色红表明富集程度越高,KEGG分析柱状图和点状图见图4.结果显示,碳代谢通路(Carbon metabolism)、酪氨酸代谢通路(Tyrosine metabolism)、小细胞肺癌(Small cell lung cancer)、雌激素信号通路(Estrogen signaling pathway)、激素抵抗(Endocrine resistance)等信号通路与莪术抗肝癌作用相关性较大.提示莪术抗肝癌靶点分散于这些通路中,其中多个靶点能在多条通路中发挥作用,如:CYCS、HSP90AA1、PTGS2等.

图4 莪术抗肝癌的潜在作用靶点KEGG通路富集分析(A.柱状图;B.点状图)Fig.4 KEGG pathway analysis of potential targets for Curcumae Rhizoma in treating hepatocellular carcinoma(A.Barplot;B.Dotplot)
2.6 分子对接
选择CAT、CYCS、HSP90AA1、ESR1等4个关键靶蛋白,将2.1项中得到的有效成分中22个结构确证的成分与上述4个靶点蛋白进行分子对接,以结合能判断其亲和力,结合能为负值说明受体与配体具有亲和力,结合能小于-5.0 kcal·mol-1说明亲和力较好.对 接 结 果 见 表3,由 表 可 见CAT、CYCS、HSP90AA1、ESR1等关键靶蛋白与莪术有效成分结合能均小于-5.0 kcal·mol-1,分子对接结果说明关键靶蛋白莪术活性成分具有较好的亲和力.

表3 莪术中22个化合物与部分靶点的结合能值(kcal·mol-1)Table 3 The binding energy value of the 22 compounds in Curcumae Rhizoma with part of targets(kcal·mol-1)
3 讨论
大量文献报道莪术中有效成分具有抗肝癌作用,然而莪术中成分复杂,具有中药多成分多靶点的特性.本研究首先对莪术抗肝癌的物质基础进行了挖掘,纳入的24中化合物中包括从TCMSP数据库中得到的17个满足要求的化合物以及从文献报道中搜集到7种具有抗癌活性的化合物.中药成分理想的筛选条件为OB≥30%,DL≥0.18,为了更多的纳入潜在化合物,我们将DL≥0.1做为筛选标准.我们纳入的24种化合中curcumin、beta-elemene、germacrone等化合物OB或DL值较低,但是文献报道具有抗肝癌活性的重要化合物.例如,有研究报道注射Beta-elemene能有效抑制肝癌HepG2细胞的增殖,促进细胞凋亡[7];curcumin可以通过降低VEGF表达在体内外抑制肝癌的增殖[8];germacrone可以诱导G2/M细胞周期阻滞促进细胞凋亡,从而对肝癌细胞系产生抑制作用[9].因此,我们将这些潜在活性化合物也纳入我们的研究中.结果表明beta-elemene、germacron、curcumin等化合物位于化合物-靶点网络中心,是莪术抗肝癌的重要活性物质,与已有文献报道相符.
莪术的化合物-靶点网络图显示了莪术多成分、多靶点的抗肝癌作用特点.其中CAT、CYCS、HSP90AA1、ESR1、PTGS2、PGR、AR、CDKN1A、RHOA、PARP1、CCNB1、CTSD等靶基因处于网络中心,可作为莪术抗肝癌的重要靶基因,这些靶基因涉及激素的调节、细胞转录调节、氧化还原调节等能量代谢过程.激素被证实与多种癌症相关,研究报道激素与肝癌的发生相关,固醇类激素可作为肝癌检测的标志物[16],雌雄激素的失调可能是肝癌发生的诱因.以上重要靶基因中ESR1、PARP1、PGR、AR等基因是莪术参与激素调节以及细胞转录调节的基因.有研究证实ESR1(雌激素受体1)可以通过与SP1蛋白结合介导肝癌细胞的凋亡[17];PARP1(多聚ADP-核糖聚合酶1)在肝癌细胞中高表达,PARP1缺陷可抑制肝癌细胞生长和迁移;AR(雄激素受体)可以通过抑制环状RNA的表达对肝癌产生调控[18].此外,本研究提示氧化还原等能量代谢调控也是莪术肝癌的重要调控方式,以上重要基因中CAT、PTGS2等基因是氧化还原调控的基因.CAT的表达或降低会导致细胞内活性氧(ROS)的浓度增加,可形成氧化压力,引起蛋白质大分子物质的不稳定性增加,诱发肿瘤.研究报道活性成分germacrone可以使ROS浓度增加及p53表达上调,诱导G2/M细胞周期阻滞,促进肝癌细胞凋亡[19].同时,CAT基因也可通过下调金属蛋白酶(MMPs)和NF-κB的表达等功能,抑制肝癌细胞的转移[20].研究证实活性成分curcumin可以通过抑制肿瘤NF-κB通路抑制肝癌[21].前列腺素合成酶2(PTGS2)又称环氧化酶(COX-2),实验证明PTGS2的过表达能降低TET1诱导启动子高甲基化从而诱导肝癌[22],因此莪术对CAT、PTGS2等基因的调控也可能是其抗肝癌的原因.碳代谢能为肝癌细胞提供能量,促进肝癌的发生,对碳代谢的调控也成为治疗肝癌的一种途径[23].对莪术抗肝癌KEGG通路富集结果提示,莪术可能通过碳代谢通路影响肝癌.莪术对肝癌氧化还原代谢以及碳代谢的影响也提示可能通过线粒体途径诱导肝癌凋亡.本研究还提示莪术抗肝癌还与酪氨酸代谢通路及激素调控的信号通路相关,这些通路都被证实在肝癌的发生发展中起到了一定的作用.因此,本研究的预测结果与现代药理学研究也是相互验证的.此外,本研究对预测得到的重要作用靶蛋白进行了分子对接验证,结果靶蛋白与莪术有效成分亲和力较好,验证本研究靶点预测的可靠性,同时也为后续进一步研究提供了参考.
综上,本研究采用网络药理学及分子对接的方法对莪术抗肝癌潜在活性成分、作用靶点以及作用机制进行了初步研究,结果提示莪术有24个重要潜在活性成分可能作用于73个靶基因,涉及多个生物过程、靶基因及相关通路,体现了莪术抗肝癌“多成分-多靶点-多途径”的特点,本研究为进一步深入探讨其作用机制提供了参考,相关靶点和通路的验证也正在实验进行中.本研究也存在一定局限性,如数据库信息不全面、化合物筛选的主观性等使研究结果存在一定的片面性.
