丹参川芎嗪联合尤瑞克林治疗对老年急性缺血性脑卒中患者脑血流动力学及TLR4/NF-κB信号通路的影响
2021-01-26杨云鹏郭刚张璐璐
杨云鹏,郭刚,张璐璐
西安市第四医院神经内科,陕西 西安 710004
急性缺血性脑卒中(acute cerebral infarction,ACI)好发于老年人群,致残率、致死率较高,严重危害患者生命健康[1]。溶栓是治疗ACI 的重要策略,能促进血栓溶解,恢复脑部血流供应,减轻神经功能缺损,但由于治疗时间窗的限制,部分患者可能会错失溶栓机会,且长期工作经验及既往研究发现,即使接受溶栓治疗,部分患者仍难以获得满意疗效[2]。尤瑞克林为国家一类新药,具有扩张血管、改善局部脑血流量、神经修复、抗氧化等药理作用[3]。丹参川芎嗪是一种复方制剂,具有活血化瘀的功效,在心血管疾病、ACI 等方面应用广泛,具有较高的安全性。既往资料显示,丹参制剂联合尤瑞克林无明显不良反应,并能增加疗效,但丹参川芎嗪与尤瑞克林联合的报道较少[4]。研究表明,ACI 后的缺血缺氧可引起脑部炎症反应[5]。Toll 样受体4 (Toll like receptor 4,TLR4)/核 因 子 -κ B (nuclear factor kappa B,NF-κB)信号通路是调控炎症反应的重要通路,在脑缺血动物模型中TLR4/NF-κB 被激活,并参与脑损伤[6]。鉴于此,本研究从脑血流动力学、TLR4/NF-κB信号通路等角度,探讨丹参川芎嗪联合尤瑞克林在老年ACI 患者中的应用价值及分子水平的作用机制。
1 资料与方法
1.1 一般资料 选取2017 年10 月至2019 年12月西安市第四医院神经内科收治的126例老年ACI患者为研究对象,以随机数表法分为观察组、对照A 组和对照B组,每组42例。三组患者的性别、年龄、发病至入院时间、体质量指数、饮酒史、吸烟史、梗死部位、合并疾病等资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经我院医学伦理委员会审核通过,患者或家属均知晓本研究,自愿签署知情同意书。
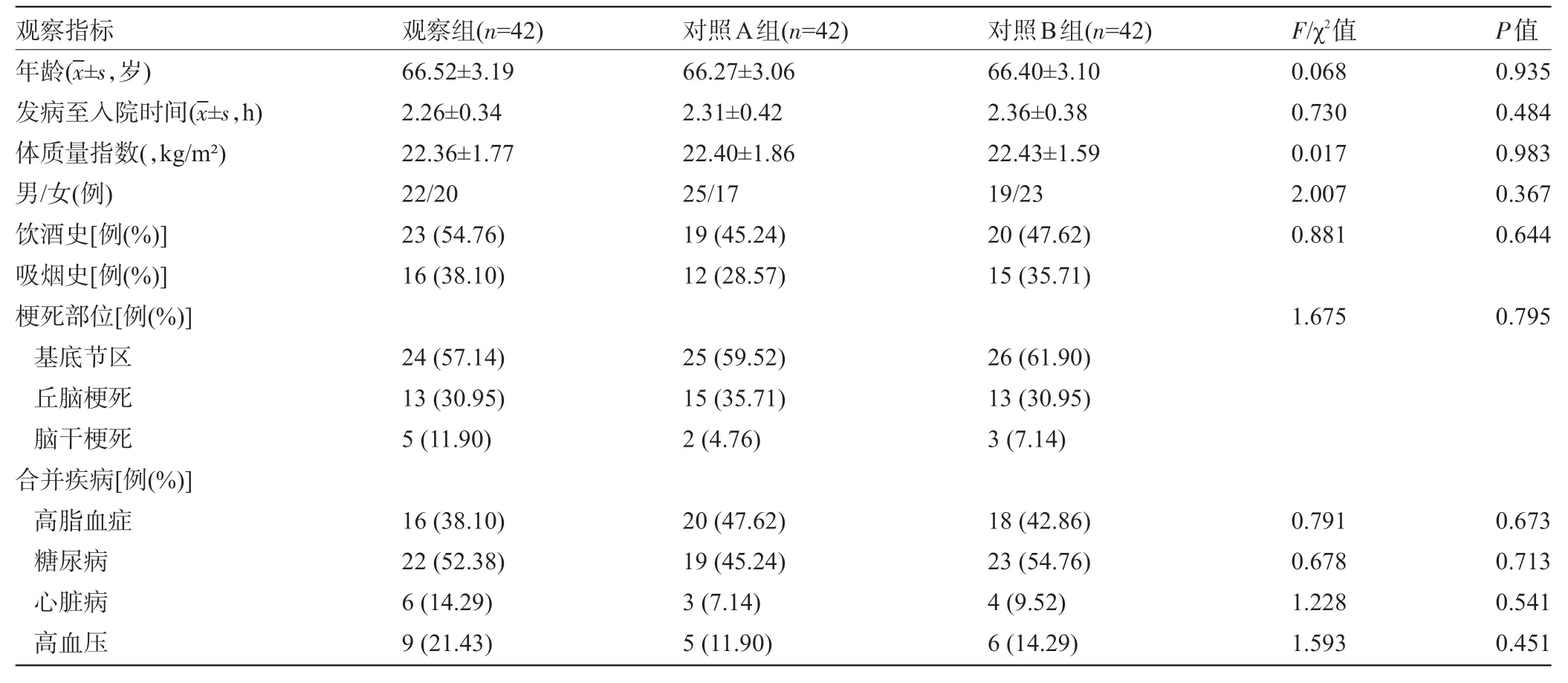
表1 三组患者的临床资料比较
1.2 病例选取 (1)纳入标准:符合ACI 诊断标准[7];年龄≥60岁;无急性感染类疾病;入组前无相关治疗史;首次发病;无先天或后天肢体残疾。(2)排除标准:存在相关药物过敏史者;同时合并急性心肌梗死者;合并颅内占位性病变者;脑出血患者;有严重的凝血功能障碍者;有出血倾向者;主动放弃治疗者。
1.3 治疗方法 三组患者根据病情给予吸氧、溶栓、抗凝、纠正水电解质平衡治疗,并给予降脂、降糖等对症治疗。三组均治疗两周。
1.3.1 对照A 组 在常规治疗的基础上给予丹参川芎嗪(贵州拜特制药有限公司,国药准字H52020959)5 mL,与250 mL 生理盐水混合后静滴,1次/d。
1.3.2 对照B组 在常规治疗的基础上给予尤瑞克林(广东天普生化医药股份有限公司,国药准字H20052065) 0.15 PNA,与250 mL 生理盐水混合后静滴,1次/d。
1.3.3 观察组 在常规治疗的基础上予以丹参川芎嗪联合尤瑞克林,丹参川芎嗪给药方法参考对照A组,尤瑞克林给药方法参照对照B组。
1.4 标本采集与检测 (1)主要试剂:超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(南京诺尔曼生物);丙二醛(malondialdehyde,MDA)试剂盒(上海仁捷生物);B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)试剂盒(艾美捷生物科技有限公司);Livin试剂盒[研域(上海)化学试剂有限公司];可溶性细胞凋亡因子(soluble Fas,sFas)试剂盒(上海远慕生物科技);可溶性细胞凋亡因子配体(soluble FasL,sFasL)试剂盒(上海远慕生物科技);TLR4 试剂盒(上海康朗生物科技有限公司);NF-κB 试剂盒(上海赛默生物科技发展有限公司)。(2)检测方法:治疗前后分别采集肘部静脉血5 mL,以3 000 r/min、15 cm半径离心10 min,采用比色法检测血清SOD,采用酶联免疫吸附法检测血清MDA、Bcl-2、Livin、sFas、sFasL、TLR4、NF-κB表达。
1.5 观察指标 (1)临床治疗效果。(2)NIHSS评分、日常生活能力评分量表(ability of daily living scale,ADL)评分:NIHSS评分0~42分,分值与神经缺损呈正相关;ADL评分0~100分,分值与日常生活能力呈正相关。(3)血清氧化应激指标:SOD、MDA。(4)血清细胞凋亡有关因子:Bcl-2、Livin、sFas、sFasL 水平。(5)脑血流动力学指标:平均血流速度(Vmean)、平均血流量(Qmean)、脑血管特征性阻抗(ZCV)、动态阻抗(DR),采用脑血管血液动力学分析仪(CBACV-300)检测。(6)TLR4/NF-κB信号通路:TLR4、NF-κB表达。
1.6 疗效评估[8]根据治疗前后美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分变化评估,NIHSS 评分减少91%~100%、46%~90%、18%~45%、<18%依次为基本治愈、显效、有效、无效,总有效率=(基本治愈+显效+有效)/总例数×100%。
1.7 统计学方法 应用SPSS22.0 统计学软件分析数据,计量资料符合正态分布,以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验,计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组患者的治疗效果比较 观察组患者的治疗总有效率为92.86%,明显高于对照A组的71.43%和对照B 组的73.81%,差异有统计学意义(χ2=7.476,P=0.024<0.05),见表2。
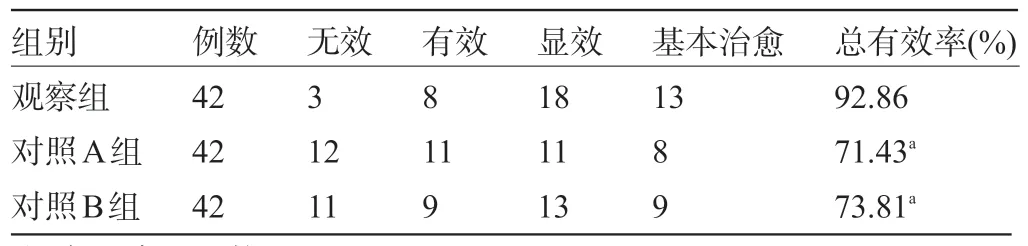
表2 三组患者的治疗效果比较(例)
2.2 三组患者治疗前后的NIHSS、ADL 评分比较 三组患者治疗前的NIHSS、ADL评分比较差异均无统计学意义(P>0.05);三组患者治疗后的NIHSS评分较治疗前下降,且观察组明显低于对照A组、对照B组,ADL评分较治疗前提高,且观察组明显高于对照A组、对照B组,差异均有统计学意义(P<0.05),见表3。
表3 三组患者治疗前后的NIHSS、ADL评分比较
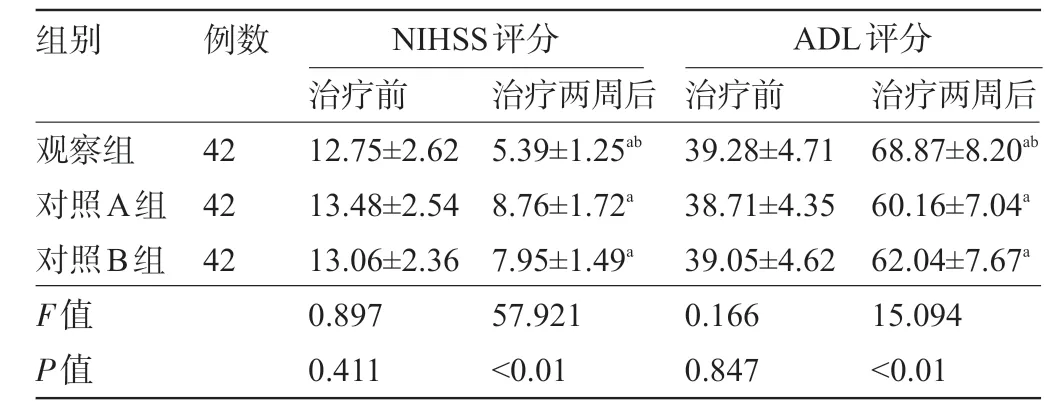
表3 三组患者治疗前后的NIHSS、ADL评分比较
注:与本组治疗前比较,aP<0.05;与对照A组和对照B组比较,bP<0.05。
组别 例数NIHSS评分 ADL评分42 42 42观察组对照A组对照B组F值P值治疗前12.75±2.62 13.48±2.54 13.06±2.36 0.897 0.411治疗两周后5.39±1.25ab 8.76±1.72a 7.95±1.49a 57.921<0.01治疗前39.28±4.71 38.71±4.35 39.05±4.62 0.166 0.847治疗两周后68.87±8.20ab 60.16±7.04a 62.04±7.67a 15.094<0.01
2.3 三组患者治疗前后的血清氧化应激指标水平比较 三组患者治疗前的血清SOD、MDA 水平间比较差异均无统计学意义(P>0.05);三组患者治疗后的血清SOD水平较治疗前提高,且观察组明显高于对照A 组、对照B 组,血清MDA 水平较治疗前降低,且观察组明显低于对照A组、对照B组,差异均有统计学意义(P<0.05),见表4。
表4 三组患者治疗前后的血清氧化应激指标水平比较
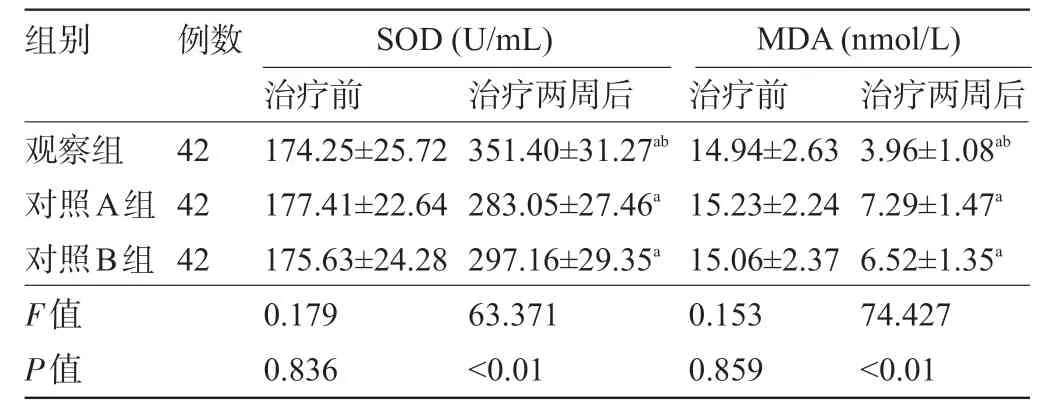
表4 三组患者治疗前后的血清氧化应激指标水平比较
注:与本组治疗前比较,aP<0.05;与对照A组的对照B组比较,bP<0.05。
组别 例数SOD(U/mL) MDA(nmol/L)42 42 42观察组对照A组对照B组F值P值治疗前174.25±25.72 177.41±22.64 175.63±24.28 0.179 0.836治疗两周后351.40±31.27ab 283.05±27.46a 297.16±29.35a 63.371<0.01治疗前14.94±2.63 15.23±2.24 15.06±2.37 0.153 0.859治疗两周后3.96±1.08ab 7.29±1.47a 6.52±1.35a 74.427<0.01
2.4 三组患者治疗前后的血清细胞凋亡有关因子水平比较 三组患者治疗前的血清Bcl-2、Livin、sFas、sFasL水平比较差异均无统计学意义(P>0.05);三组患者治疗后的血清Bcl-2、Livin水平较治疗前提高,且观察组明显高于对照A 组、对照B 组,血清sFas、sFasL 水平较治疗前降低,且观察组明显低于对照A组、对照B组,差异均有统计学意义(P<0.05),见表5。
2.5 三组患者治疗前后的脑血流动力学指标比较 三组患者治疗前的Vmean、Qmean、ZCV、DR水平比较差异均无统计学意义(P>0.05);三组患者治疗后的Vmean、Qmean水平较治疗前提高,且观察组明显高于对照A 组、对照B 组,ZCV、DR 水平较治疗前降低,且观察组明显低于对照A组、对照B组,差异均有统计学意义(P<0.05),见表6。
表5 三组患者治疗前后的血清细胞凋亡有关因子水平比较
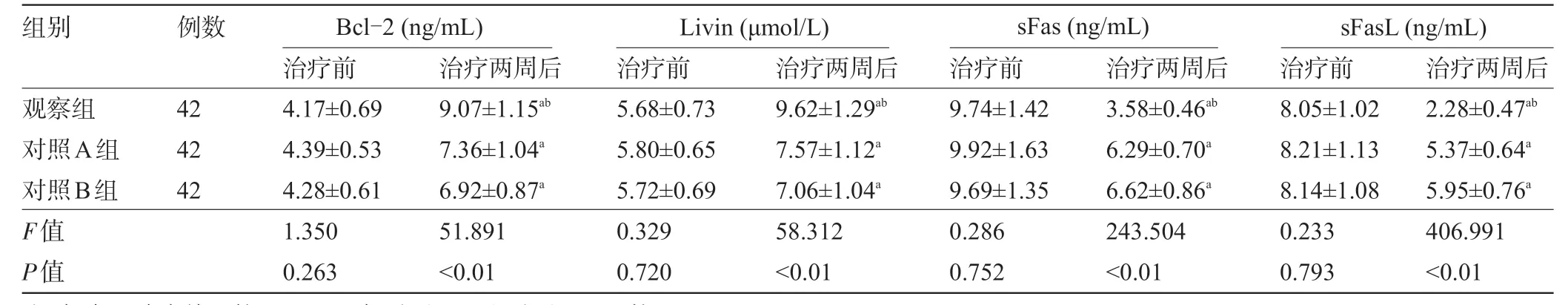
表5 三组患者治疗前后的血清细胞凋亡有关因子水平比较
注:与本组治疗前比较,aP<0.05;与对照A组和对照B组比较,bP<0.05。
组别 例数Bcl-2(ng/mL) Livin(μmol/L)sFas(ng/mL)sFasL(ng/mL)42 42 42观察组对照A组对照B组F值P值治疗前4.17±0.69 4.39±0.53 4.28±0.61 1.350 0.263治疗两周后9.07±1.15ab 7.36±1.04a 6.92±0.87a 51.891<0.01治疗前5.68±0.73 5.80±0.65 5.72±0.69 0.329 0.720治疗两周后9.62±1.29ab 7.57±1.12a 7.06±1.04a 58.312<0.01治疗前9.74±1.42 9.92±1.63 9.69±1.35 0.286 0.752治疗两周后3.58±0.46ab 6.29±0.70a 6.62±0.86a 243.504<0.01治疗前8.05±1.02 8.21±1.13 8.14±1.08 0.233 0.793治疗两周后2.28±0.47ab 5.37±0.64a 5.95±0.76a 406.991<0.01
表6 三组患者治疗前后的脑血流动力学指标比较
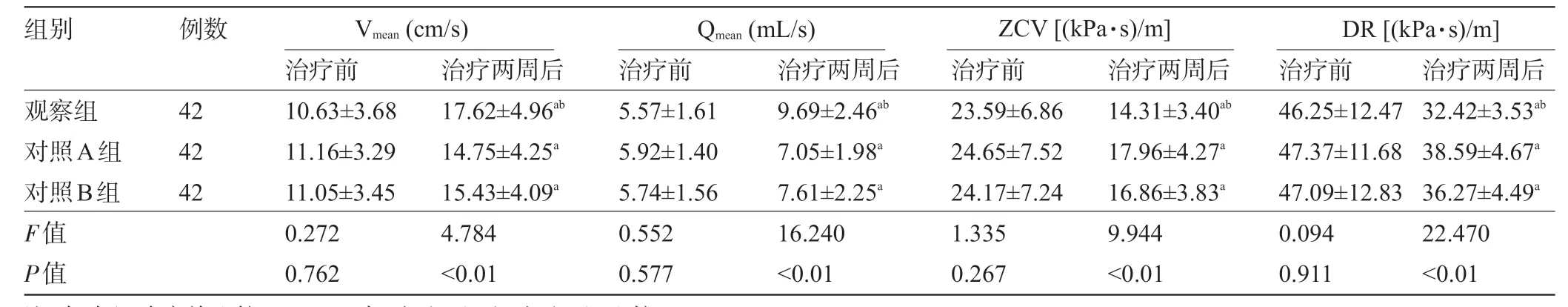
表6 三组患者治疗前后的脑血流动力学指标比较
注:与本组治疗前比较,aP<0.05;与对照A组和对照B组比较,bP<0.05。
组别 例数Vmean(cm/s) Qmean(mL/s)ZCV[(kPa·s)/m]DR[(kPa·s)/m]42 42 42观察组对照A组对照B组F值P值治疗前10.63±3.68 11.16±3.29 11.05±3.45 0.272 0.762治疗两周后17.62±4.96ab 14.75±4.25a 15.43±4.09a 4.784<0.01治疗前5.57±1.61 5.92±1.40 5.74±1.56 0.552 0.577治疗两周后9.69±2.46ab 7.05±1.98a 7.61±2.25a 16.240<0.01治疗前23.59±6.86 24.65±7.52 24.17±7.24 1.335 0.267治疗两周后14.31±3.40ab 17.96±4.27a 16.86±3.83a 9.944<0.01治疗前46.25±12.47 47.37±11.68 47.09±12.83 0.094 0.911治疗两周后32.42±3.53ab 38.59±4.67a 36.27±4.49a 22.470<0.01
2.6 三组患者治疗前后的TLR4/NF-κB 水平比较 三组患者治疗前的TLR4、NF-κB 水平比较差异均无统计学意义(P>0.05);三组患者治疗后的TLR4、NF-κB 水平较治疗前降低,且观察组明显低于对照A组、对照B组,差异均有统计学意义(P<0.05),见表7。
表7 三组患者治疗前后的TLR4、NF-κB水平比较
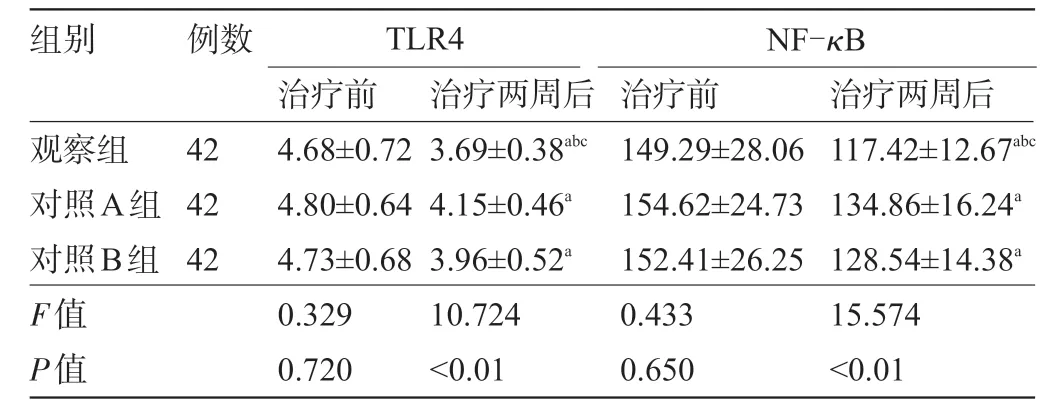
表7 三组患者治疗前后的TLR4、NF-κB水平比较
注:与本组治疗前比较,aP<0.05;与同期对照B组比较,bP<0.05;与同期对照A组比较,cP<0.05。
组别 例数TLR4 NF-κB 42 42 42观察组对照A组对照B组F值P值治疗前4.68±0.72 4.80±0.64 4.73±0.68 0.329 0.720治疗两周后3.69±0.38abc 4.15±0.46a 3.96±0.52a 10.724<0.01治疗前149.29±28.06 154.62±24.73 152.41±26.25 0.433 0.650治疗两周后117.42±12.67abc 134.86±16.24a 128.54±14.38a 15.574<0.01
3 讨论
目前ACI 治疗原则是改善缺血脑组织血液和氧气供给,控制脑水肿,减少梗死面积的扩大,防止神经功能缺损,最大程度改善患者预后。本研究结果显示,观察组治疗两周后总有效率、ADL评分、Vmean、Qmean较对照 A 组、对照 B 组高,NIHSS 评分、ZCV、DR 低于对照A组、对照B组,表明丹参川芎嗪联合尤瑞克林治疗老年ACI,能改善患者脑血流动力学,减少神经功能缺损,疗效显著。尤瑞克林系组织型激肽释放酶1,可促使激肽原向激肽的转化,并与受体结合,刺激舒张血管物质一氧化氮、前列腺素E2 等的合成和释放,从而起到降低血管外周阻力、扩张血管、增加脑部血流量的作用[9]。且尤瑞克林可诱导产生九肽类物质,靶向作用于ACI患者缺血部位,选择性提高患侧脑半球的脑血流调节功能,避免梗死灶的扩大[10]。丹参川芎嗪主要成分为丹参素及川芎嗪,能抑制血小板聚集、抗氧化应激、清除自由基、扩张小动脉、改善微循环、加快红细胞流速等,可从多靶点、多途径发挥抗ACI 的效果[11-12]。因此丹参川芎嗪联合尤瑞克林疗效良好。
ACI 发生后,脑部缺血缺氧可造成线粒体损伤,介导自由基、活性氧迅速、大量分泌,作用于细胞膜及亚细胞器膜上的多不饱和脂肪酸使其发生脂质过氧化反应,破坏细胞膜完整性、流动性等,引起细胞内外或细胞器内外物质和信息交换障碍,加重神经功能缺损[13-14]。MDA 是脂质过氧化反应产物,具有细胞毒性,可反映氧化应激程度[15]。SOD可清除对机体有害的超氧阴离子自由基,保护神经细胞免受氧化应激损伤[16]。在ACI动物模型中,靶向Nrf2信号通路,提高SOD,降低MDA,抑制氧化应激反应,能改善ACI诱导的神经功能障碍[17]。本研究显示,丹参川芎嗪联合尤瑞克林能降低ACI 患者血清MDA 水平,提高血清SOD 水平,起到抗氧化应激的作用,有利于保护神经细胞,减轻神经缺损程度。Bcl-2、Livin具有抑制细胞凋亡的作用,前者可通过减少细胞色素C的释放抑制细胞凋亡,后者能直接结合caspase,阻碍凋亡反应的进程[18]。sFas、sFasL是神经元凋亡途径中关键调控分子,两者结合后,可通过级联放大反应促进神经细胞凋亡[19]。在缺血性脑血管疾病中,sFas、sFasL 合成增多,并以可溶性形式释放入血[20]。本研究发现,丹参川芎嗪联合尤瑞克林能提高Bcl-2、Livin,降低sFas、sFasL,提示两种药物能拮抗脑缺血后神经细胞的凋亡,这可能是两者一个分子水平的作用机制。
ACI后,白细胞在血管内聚集,并向周围脑组织浸润,造成缺血脑组织明显的炎症反应,且脑缺血再灌注后,被激活的炎性细胞在短时间内穿出血管壁,浸润脑实质,又可引起缺血脑组织的炎症损伤[21-22]。TLR4可识别纤连蛋白、热休克蛋白、透明质酸等内源性分子,这些分子作为配体结合TLR4 后,逐步活化NF-κB,从而参与机体炎症反应、细胞凋亡等。抑制TLR4/NF-κB 信号通路传导,可减轻脑梗塞后脑组织炎症损伤,保护神经功能[23-24]。本研究显示,丹参川芎嗪联合尤瑞克林能降低TLR4、NF-κB,改善脑缺血与脑缺血再灌注后炎症损伤,有利于减轻患者神经缺损,这可能是两者联合的另一作用机制。本研究发现,ACI后,采用丹参川芎嗪联合尤瑞克林治疗可获得满意效果,并推测抑制炎症反应、调控凋亡分子可能是两种药物联合的作用机制,但不足之处在于,受限于伦理学要求,未能提供丹参川芎嗪联合尤瑞克林靶向凋亡分子、炎症反应的直接证据,仍有待后续基础研究的进一步印证。
综上所述,丹参川芎嗪联合尤瑞克林治疗老年ACI能改善患者脑血流动力学,抑制氧化应激,减少神经功能缺损,提高日常生活能力,疗效显著,而抑制TLR4/NF-κB 信号通路激活、调控凋亡分子可能是两者发挥疗效的一个作用机制。
