法匹拉韦治疗新冠病毒肺炎的开放性对照临床研究
2021-01-25蔡庆贤杨明辉刘东京陈军舒丹夏俊霞廖雪娇顾元博蔡秋娥杨扬沈晨光李晓鹤彭凌黄德良张晶张舒荣王福祥刘甲野陈莉陈淑彦王召钦张政曹瑞源钟武刘映霞刘磊
蔡庆贤,杨明辉,刘东京,陈军,舒丹,夏俊霞,廖雪娇,顾元博,蔡秋娥,杨扬,沈晨光,李晓鹤,彭凌,黄德良,张晶,张舒荣,王福祥,刘甲野,陈莉,陈淑彦,王召钦,张政,曹瑞源,钟武,*,刘映霞,*,刘磊,*
a National Clinical Research Center for Infectious Diseases, The Third People’s Hospital of Shenzhen, The Second Affiliated Hospital of Southern University of Science and Technology, Shenzhen 518100, China
b National Engineering Research Center for the Emergence Drugs, Beijing Institute of Pharmacology and Toxicology, Beijing 100850, China
1. 引言
2019年年末,由严重急性呼吸综合征冠状病毒 2(SARS-CoV-2)引起的新冠病毒肺炎(COVID-19)在武汉暴发。COVID-19的临床特征包括呼吸系统症状、发热、咳嗽、呼吸困难、肺炎等[1–4]。截至2020年2月25日,中国和其他国家已确认的COVID-19患者超过77 785例,死亡2666例[5],特别是,韩国和日本分别发现了977例和861例感染者,疫情的暴发引起了全球恐慌。2020年1月30日,世界卫生组织(WHO)宣布SARS-CoV-2的暴发成为国际关注的突发公共卫生事件(PHEIC),并根据《国际卫生条例》(IHR)以临时建议的形式提出建议。
研究人员发现,SARS-CoV-2的基因组序列与严重急性呼吸综合征冠状病毒(SARS-CoV)的基因组序列的相似度为75%~80%,而且SARS-CoV-2的基因组序列与几种蝙蝠冠状病毒的基因组序列有更高的相似度[6]。SARS-CoV-2是被报道的第7种人类感染的冠状病毒科成员,该科还包括SARS-CoV和中东呼吸系统综合征冠状病毒(MERS-CoV)。SARS-CoV-2已被确定为COVID-19的病原体。COVID-19患者的临床和流行病学特征均表明,SARS-CoV-2感染可导致患者进入重症监护病房(ICU)进行治疗以及具有高死亡率。中国有16%~21%的病情严重的感染者,死亡率为2%~3% [1,4]。然而,目前尚未有针对这种新病毒的特效治疗方案。因此,我们迫切需要寻找有效的抗病毒药物来对抗疾病,同时探索抗病毒药物的临床疗效。
发现抗病毒药物的一个有效途径是筛选现有的抗病毒药物是否对其他相关病毒感染有效。尽管一些药物的疗效仍存在争议,但如利巴韦林、干扰素(IFN)、法匹拉韦(FPV)和洛匹那韦(LPV)/利托那韦(RTV)等药物已被用于治疗SARS或MERS患者。最近研究表明,作为一种前药,FPV的最大半数效应浓度(EC50)= 61.88 μmol·L–1、最大半数细胞毒性浓度(CC50)> 400 μmol·L-1、选择性指数(SI)> 6.46。FPV有效抑制了SARS-CoV-2对Vero E6细胞(ATCC-1586)[7]的感染。此外,其他报道显示,尽管FPV在Vero E6细胞中的EC50值高达67 μmol·L–1,但FPV对小鼠的埃博拉病毒感染亦有保护作用[8]。因此,临床研究迫切需要评估这种抗病毒核苷对COVID-19治疗的疗效和安全性。
在本研究中,我们对深圳市第三人民医院收治的COVID-19患者的临床疗效进行了综合评价,目的是通过对比接受FPV治疗的患者和接受LPV/RTV治疗的患者之间的临床结果,为感染SARS-CoV-2的患者的治疗提供有价值的信息。
2. 研究方法
2.1. 研究设计
2.2. 入组标准
所有纳入FPV治疗组和LPV/RTV对照组的患者均需符合入组标准。入组标准包括:①年龄为16~75 岁(包含16岁和75岁);②鼻咽拭子样本检测新冠病毒RNA呈阳性;③发病至入院时间小于7天;④愿意在研究期间和治疗后7天内采取避孕措施;⑤吞咽药物无困难。不符合入组标准的条件包括:①严重的临床症状[符合下列标准之一:呼吸频率每分钟大于30次,静息状态下血氧饱和度低于93%,氧合指数(OI)< 300 mmHg(1 mmHg =133.3 Pa),呼吸衰竭、休克或其他需要ICU监护的合并器官衰竭];②终末期慢性肝肾疾病;③既往对FPV或LPV/RTV药物有过敏史;④孕妇或哺乳期妇女;⑤妊娠试验呈阳性、哺乳、流产或产后两周内的育龄妇女;⑥参与过其他抗COVID-19的临床试验或过去28天内接受过抗SARS-CoV-2治疗。
2.3. 干预措施
治疗组:口服FPV片(浙江海正药业股份有限公司生产,每片200 mg)。第1天:给药两次,每次1600 mg;第2~14天:每天两次,每次600 mg。用药至病毒清除,疗程不超过14天。
对照组:口服LPV/RTV片(艾伯维公司生产,每片200 mg/50 mg)。每天两次,每次LPV 400 mg /RTV 100 mg。用药至病毒清除,疗程不超过14天。
其他治疗:两组均接受干扰素IFN-α1b(北京三元基因制药有限公司生产,每瓶30 μg)雾化吸入,每天两次,每次60 μg。除此之外,住院患者的基本治疗还包括吸氧、口服或静脉补液、退热药、止痛药和止吐药等对症支持治疗。
2.4. 有效性评价
本研究通过患者治疗后第14天的病毒清除时间和胸部CT扫描的改善率来评估治疗的有效性。在治疗后第4、9和14天对患者进行胸部CT扫描,所有胸部CT影像学结果由两位资深放射诊断医师按照评分标准[9,10]进行双盲阅片。CT影像学结果可分为三级:1为CT正常、2为磨玻璃密度影、3为固实变影。将两肺各分为上、中、下三部分,上部为气管隆突以上区域、中部为气管隆突与下肺静脉之间区域、下部为下肺静脉以下区域,共6个区域。对每个区域内渗出性病变所占范围进行5级法评分[10]:0级:0分,正常肺组织;1级:1分,病变面积<该区域面积25%;2级:2分,病变面积占该区域面积的25%~50%:3级:3分,病变面积占该区域面积的50%~75%;4级:4分,病变面积>该区域面积的75%。总得分为全肺各区域得分之和,数值范围为0~72,如图1所示。胸部CT“改善”的变化被定义为总得分低于用药前,“较差”的变化被定义为总得分高于用药前;“无明显变化”的变化被定义为总得分与治疗前相同(图1)。
SARS-CoV-2的检测采用实时定量聚合酶链反应(qPCR)方法进行,如文献[5]所述。我们使用QIAamp RNA病毒试剂盒(凯杰,德国)从样本中提取病毒核糖核酸(RNA),并且使用商业试剂盒进行定量逆转录聚合酶链反应(qRT-PCR),用于SARS-CoV-2检测。病毒清除的概念定义为在24 h内连续出现两个qPCR检测阴性结果。
汉江流域纳入《全国重要江河湖泊水功能区划(2011—2030年)》名录内的水功能区共110个,其中保护区15个、保留区 38个、缓冲区9个、开发利用区20个。
2.5. 安全性分析
使用问卷调查不良事件发生情况并综合分析实验室检测结果。
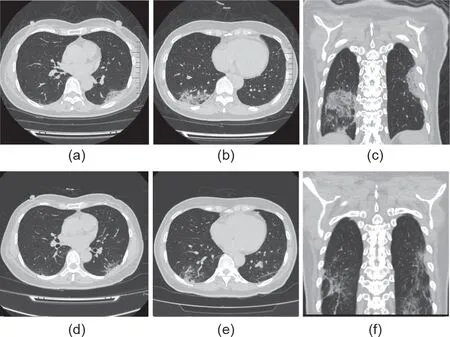
图1. 一位接受FPV治疗的56岁的女性COVID-19患者的胸部CT扫描评分。(a~c)FPV治疗前的部分胸部CT图像,评分为15分;(d~f)FPV治疗后第12天的部分胸部CT图像,评分为6分。
2.6. 统计学分析
两组患者基线数据比较:定量数据被描述为平均值±标准差,或中位数[四分位间距(IQR)];定性数据用病例数(比例,%)描述;分类数据采用χ2检验或Fisher精确检验;连续数据采用Wilcoxon秩和检验或t检验。主要疗效指标及安全性指标的比较:两组患者病毒清除时间的比较采用Kaplan-Meier法计算,以及不同治疗条件下病毒清除时间的差异性分析采用log-rank检验计算。多因素分析评价干预对结果的影响:单因素和多因素Cox回归模型分析病毒清除率的潜在影响因素。统计显著性要求P值小于0.05。所有的分析都采用SPSS Version 22.0和GraphPad Prism 7.0完成。
3. 结论
3.1. 患者与基线分析
从2020年1月30日起,对56例实验室确诊的COVID-19患者进行筛选,其中35例患者符合FPV治疗组的入组标准。对2020年1月24日至1月30日期间开始接受LPV/RTV治疗的91例经实验室确诊的COVID-19患者进行筛选,其中45例患者符合本研究中对照组的入组条件。所有入组患者均完成了治疗,并于治疗开始后的14天内对其进行随访,具体流程如图2所示。比较FPV治疗组和LPV/RTV对照组的所有基线特征,结果如表1所示,两组的基线特征无显著差异。所有患者均为国家卫生健康委员会确定的轻症病例。
3.2. 抗病毒治疗效果比较
两组患者抗病毒治疗直至病毒清除时的Kaplan-Meier生存曲线如图3所示。接受FPV治疗的患者的病毒清除中位时间约为4天(IQR:2.5~9),与对照组患者的病毒清除中位时间11天(IQR:8~13)相比显著减少(P< 0.001)。第18天和第21天,FPV治疗组中的两名患者的鼻咽拭子病毒RNA检测结果分别转为阴性。对照组患者27天内病毒RNA检测结果全部转阴。
3.3. COVID-19 患者胸部CT 变化
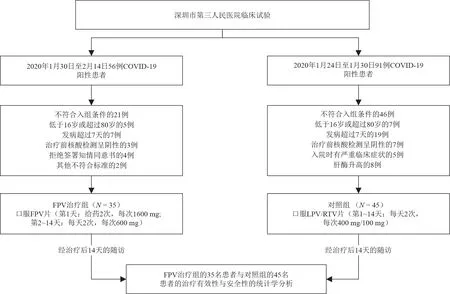
图2. 深圳市第三人民医院FPV及LPV/RTV治疗COVID-19患者临床试验流程图。
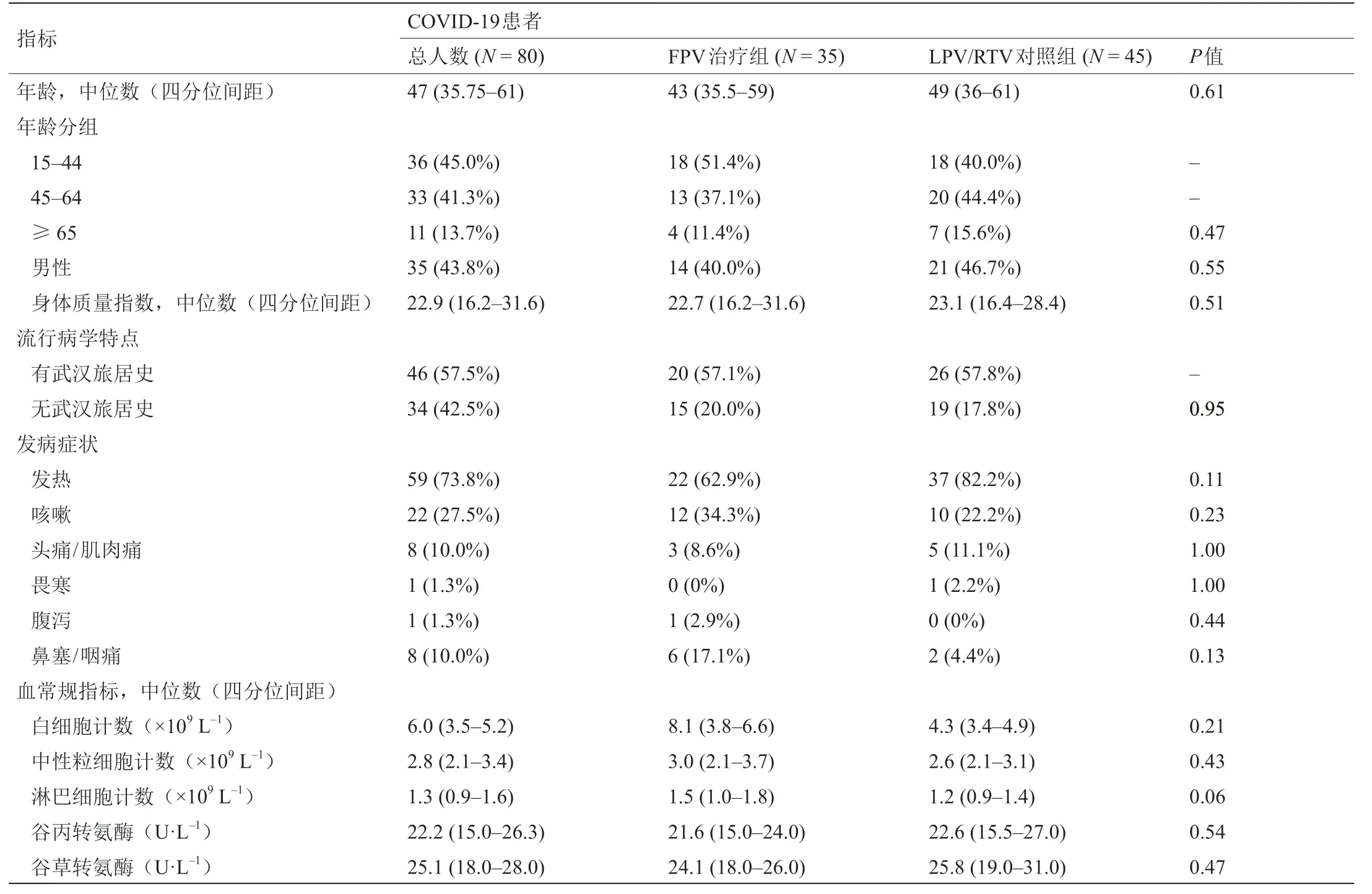
表1 两组患者的基线特征
采用非参数Mann-WhitneyU检验,确定两组患者的胸部CT变化差异的显著性(表2)。采用χ2检验对两组患者治疗后第4、9和14天的胸部CT变化的改善率进行比较。两组患者的胸部CT变化的改善率在第4天和第9天没有显著差异(P> 0.05)。在治疗后的第14天,FPV治疗组患者的胸部CT变化的改善率显著高于对照组(P= 0.004)。
根据病毒清除时间将患者分为两组。病毒清除时间低于7天(包括7天)的患者在治疗后第14天的胸部CT变化的改善率要高于病毒清除时间大于7天的患者胸部CT变化的改善率(图4)。
(续表)
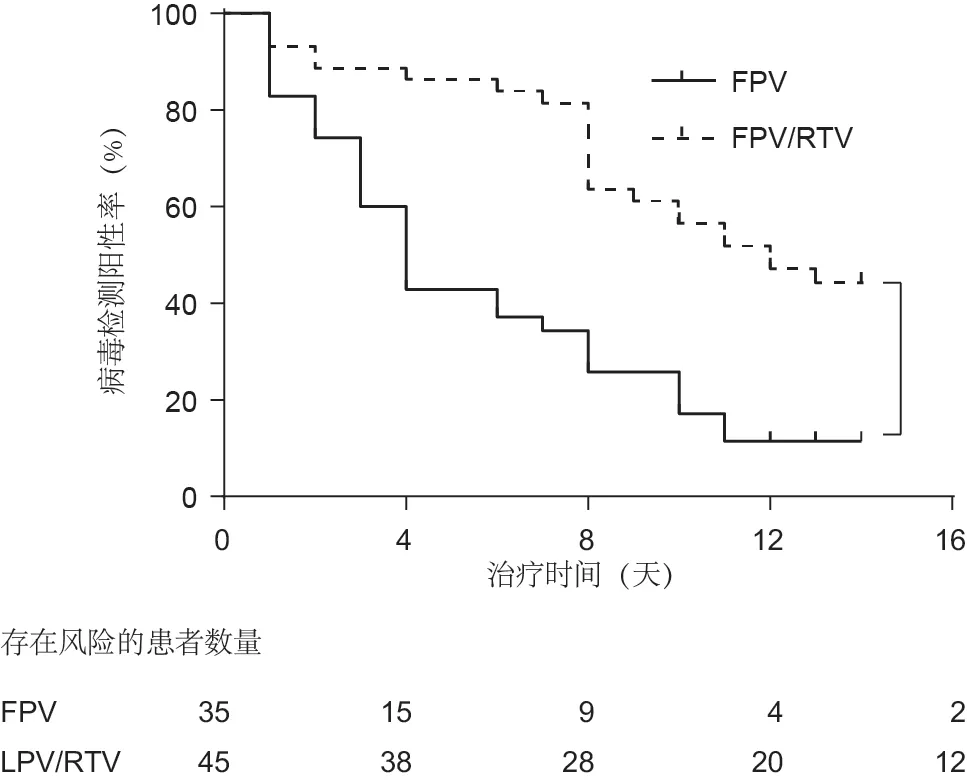
图3. 两组患者抗病毒治疗直至病毒清除时的Kaplan-Meier生存曲线。
3.4. 多因素分析评价FPV 对胸部CT 变化的影响
在进行多因素分析之前,使用χ2检验、t检验或Wilcoxon秩和检验进行单因素分析。单因素分析中的显著变量(P< 0.10)为抗病毒治疗以及是否发热。多因素logistic回归分析采用胸部CT变化(0 =无变化或恶化、1 =改善)作为因变量,单因素分析选择显著变量(包括年龄、基础疾病和疾病严重程度)作为自变量。结果表明,模型中有两个具有统计学意义的因素,即抗病毒治疗[优势比(OR)= 3.190,95%置信区间(CI)= 1.041~9.78]和发热(OR = 3.622,95% CI =1.054~12.442)。这表明在控制了混杂因素之后,抗病毒治疗和发热是影响胸部CT变化的独立因素。经FPV治疗后的患者胸部CT改善更明显(表3)。
3.5. 多因素分析评价FPV 对病毒清除时间的影响
同样地,在进行多因素分析之前,使用log-rank检验和Cox回归进行单因素分析。单因素分析中的显著变量(P< 0.10)包括抗病毒治疗、血小板、T淋巴细胞计数和发病至治疗时间间隔。使用多因素Cox回归模型研究影响病毒清除的独立因素。将病毒清除时间设置为TIME变量,将病毒清除(0 =否、1 =是)设置为状态,并且将单因素Cox分析中的显著变量(P< 0.10),如年龄以及是否有基础性疾病设置为自变量。结果表明该模型是有意义的(P= 0.003)。关键因素如下:T淋巴细胞计数[风险比(HR)= 1.002、95% CI = 1.000~1.005]和抗病毒治疗(HR = 3.434、95% CI = 1.162~10.148)。在控制其他混杂因素之后,不同药物处理和T淋巴细胞计数是影响病毒清除的独立因素。研究结果表明,与LPV/RTV对照组相比,FPV治疗对病毒清除效果更好(表4)。
3.6. 用药后的不良反应统计
FPV治疗组的患者用药后的不良反应总数为4例(11.43%),明显少于对照组患者中的25例(55.56%)不良反应数(P< 0.001)。FPV治疗组中有2例腹泻、1例肝损伤和1例无食欲患者。同时,LPV/RTV对照组中出现5例腹泻、5例呕吐、6例恶心、4例皮疹、3例肝损伤和2例胸闷患者(表5)。
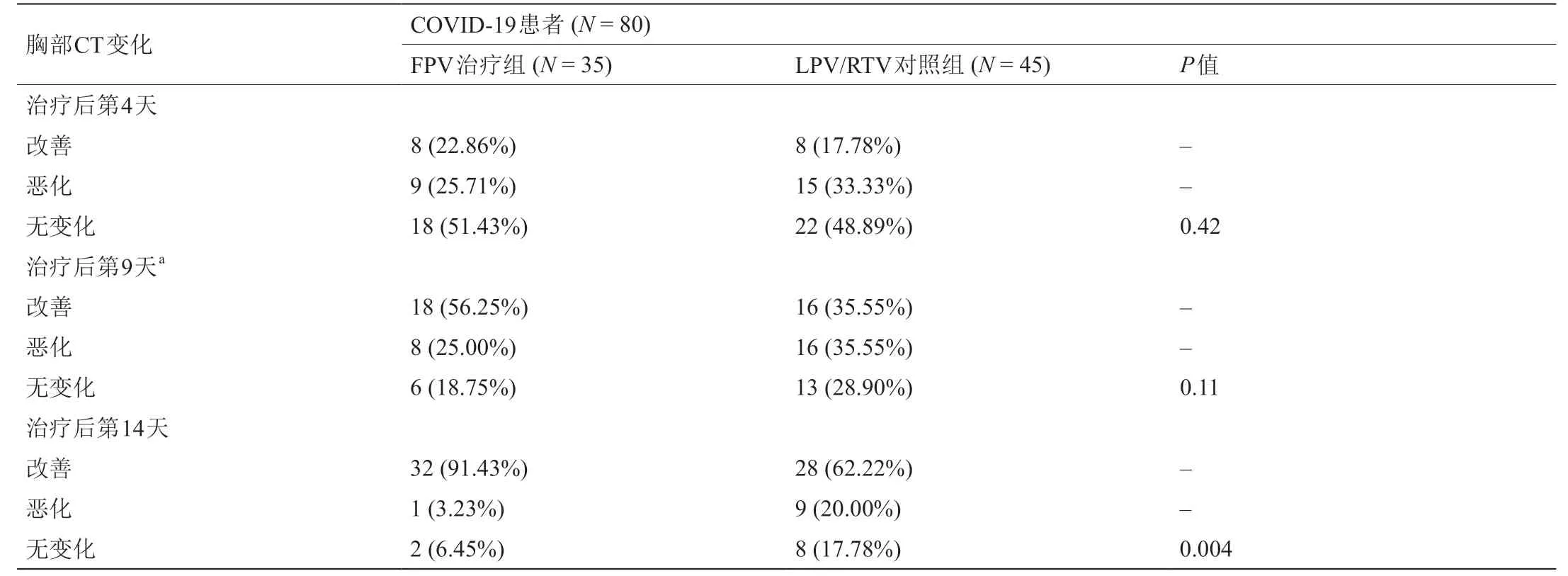
表2 COVID-19患者治疗后的胸部CT变化
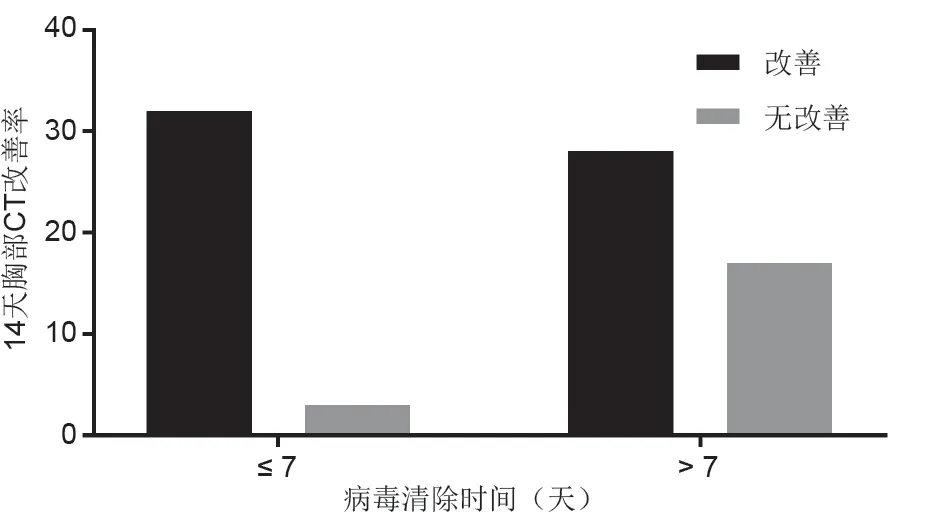
图4. 病毒清除时间及治疗后第14天患者胸部CT变化的改善情况。
4. 讨论
在这项针对COVID-19患者的开放性对照研究中,接受FPV治疗的患者比接受LPV/RTV治疗的患者具有更快的病毒清除速度和更好的胸部影像学改变。由于这不是一项随机、双盲、平行的试验,因此,进行大规模的、精心设计的验证性试验是非常必要的。然而,鉴于COVID-19在全球范围内的传播所造成的重大影响,我们的研究结果可为这种新发疾病的治疗提供有用的信息。
FPV作为一种前药,是一种新型的RNA依赖性RNA聚合酶(RdRp)抑制剂,FPV已被证明在治疗流感和埃博拉病毒方面是有效的[8,11–15]。最近,Wang等[7]的研究报告显示,FPV和瑞德西韦均可在体外有效抑制SARS-CoV-2感染(EC50= 61.88 μmol·L–1、CC50> 400 μmol·L–1、SI > 6.46)。本研究表明FPV是一种潜在的COVID-19临床干预手段。
本研究的准试验设计可能在患者招募中存在选择偏差。然而,考虑同时出现的患者数量众多,且疾病的传染性极高,从伦理上讲,分配患者接受不同的试验药物是不可接受的,并且随机分配过程是不可行的。此外,在某些不真实的信息来源和对医院隔离不信任的背景下,在初始状态使用随机设计可能会导致更多患者拒绝隔离。因此,我们选择进行一项前后设计的试验,该试验将两个不同时期连续入院的患者分别分为两个治疗组。由于两个治疗组的基线特征具有可比性,并且在对潜在的混杂因素进行调整后,结果仍保持不变,因此,由混杂偏差产生的影响(如果有的话)并非主要问题。
本研究还发现,早期的病毒清除有助于改善患者第14天的胸部成像。这一发现提示该病的改善可能取决于SARS-CoV-2的抑制作用,而FPV通过抑制SARS-CoV-2来控制COVID-19的病情进展。直到目前,COVID-19的发病机理还不清楚。由于SARS-CoV-2感染被认为是自限性的、以全身炎症反应为特征,因此,对症支持治疗是WHO和国家卫生健康委员会主要推荐的方法。这种特征类似于MERS-CoV,针对这种情况,研究人员通常采用非特异性的治疗措施来降低危重症率和死亡率 [16]。抗病毒药物是如何帮助控制这种疾病的发生是有争议的。虽然已经有许多针对COVID-19的抗病毒药物的临床试验获批,但是其使用时机、治疗时间和研究终点尚未统一。本研究将病毒清除时间作为主要终点,用于评价FPV对SARS-CoV-2的抗病毒作用,并成功确定了FPV的优先级。病毒清除时间与胸部CT改善之间的关系表明,病毒清除是临床终点的理想替代方案。本研究的局限性在于病毒滴度与临床预后之间的关系尚不清楚。未来的研究可能会更多地关注这一点。
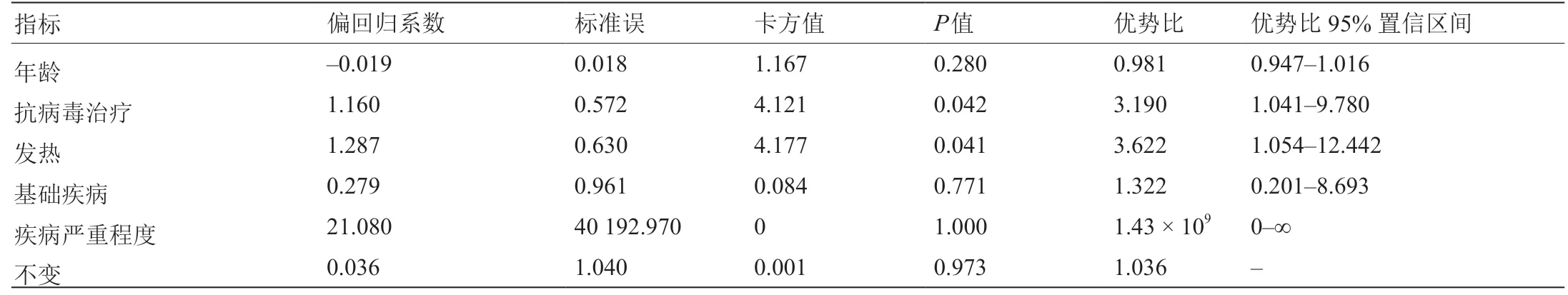
表3 FPV治疗后患者胸部CT变化的logistic回归分析
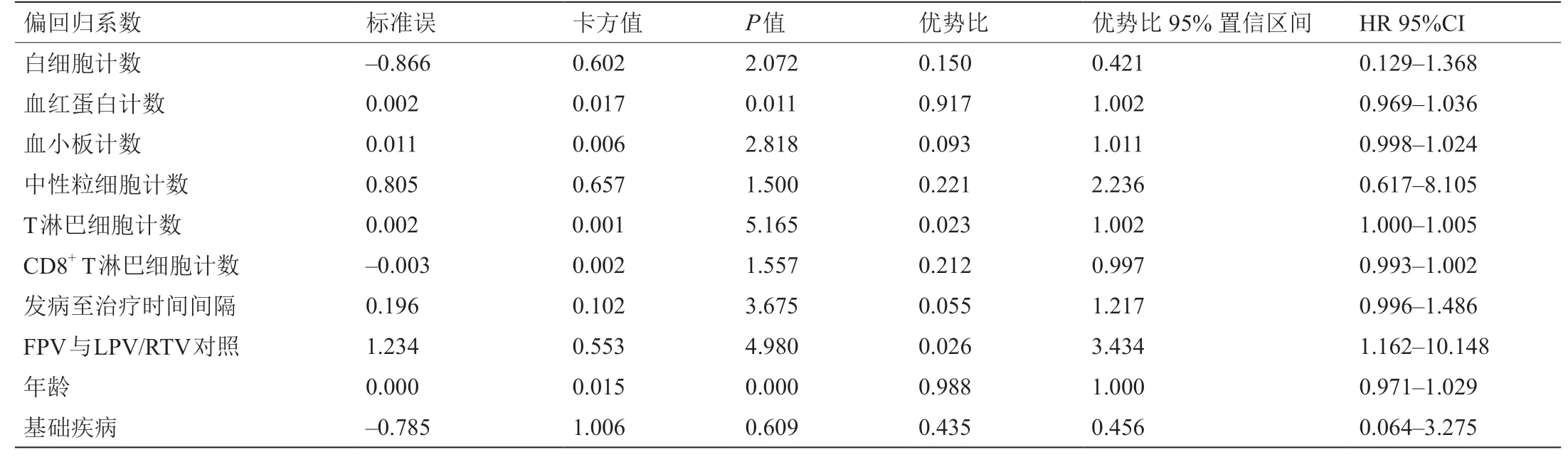
表4 病毒清除的Cox回归分析
对照组发生的不良事件多于FPV治疗组,不良事件发生率与既往利用LPV/RTV治疗艾滋病的研究相似。值得一提的是,本研究中FPV的治疗时间是治疗流感所用时间的两倍。然而,试验组的不良事件很少见且耐受,并且没有患者需要停止FPV治疗。这些结果表明,如有必要,FPV的治疗时间可以延长。所有患者均经连续两次RNA检测阴性(间隔24 h以上)及临床改善后出院,并于指定隔离地点隔离,出院后再随访14天。
SARS-CoV-2感染已在全世界迅速蔓延,而目前还没有有效的针对性药物。当前的任务是进行一项精心设计的试验,以根据大量证据确定有效的治疗方法。然而,在这项研究的开始,某些条件不允许患者随机接受标准护理或试验药物。在此对照试验的初步研究中,我们发现FPV在COVID-19患者的疾病进展和病毒清除方面显示出更好的治疗效果。我们的研究结果为治疗SARSCoV-2感染提供了初步证据。另外,我们还介绍了病毒清除时间可作为抗病毒治疗试验的主要终点,而且可能是研究COVID-19相关治疗中设计方案的一个有效替代方案。
致谢
感谢李松教授对此临床试验的设计与指导。本工作由国家科技重大专项(2017ZX10204401、2018ZX10711001、2017ZX10103011、2018ZX09711003、2020YFC 0841700)、深圳市“三名”医学项目(SZSM201412003、SZSM201512005)、深圳市科技研发项目(20200207 3000001)、中国博士后科研基金(2019M660836)、广东省2020年科技创新战略专项基金、广东省科技厅防控新型冠状病毒感染科技攻关应急专项(2020B111105001)资助完成。
Author’s contributions
Lei Liu, Yingxia Liu, Qingxian Cai, Minghui Yang,Wu Zhong, and Jun Chen contributed to the study design.Qingxian Cai, Minghui Yang, Dan Shu, Junxia Xia, Xuejiao Liao, Dongjing Liu, Yuanbo Gu, Qiue Cai, Xiaohe Li, Jiaye Liu,Ling Peng, Deliang Huang, and Jing Zhang contributed to the collection of clinical data. Qingxian Cai, Minghui Yang, Shurong Zhang, Fuxiang Wang, Li Chen, Shuyan Chen, Zhaoqin Wang, and Zheng Zhang contributed to the data analysis. Qingxian Cai, Minghui Yang, Jun Chen,Yang Yang, Chenguang Shen, Ruiyuan Cao, and Wu Zhong contributed to the manuscript preparation. All the authors have read and approved the manuscript.
Compliance with ethics guidelines
Qingxian Cai, Minghui Yang, Dongjing Liu, Jun Chen,Dan Shu, Junxia Xia, Xuejiao Liao, Yuanbo Gu, Qiue Cai, Yang Yang, Chenguang Shen, Xiaohe Li, Ling Peng,Deliang Huang, Jing Zhang, Shurong Zhang, Fuxiang Wang, Jiaye Liu, Li Chen, Shuyan Chen, Zhaoqin Wang,Zheng Zhang, Ruiyuan Cao, Wu Zhong, Yingxia Liu, and Lei Liu declare no competing interests.
