SARS-CoV-2 侵入因子——ACE2 和TMPRSS2 在围着床期胚胎和母胎界面存在表达
2021-01-25陈伟袁鹏杨铭严智强孔思明严杰柳溪溪陈依东乔杰闫丽盈
陈伟,袁鹏,杨铭 ,严智强,孔思明,严杰,柳溪溪,陈依东,乔杰,f,g,h,*,闫丽盈
a Center for Reproductive Medicine, Department of Obstetrics and Gynecology, Peking University Third Hospital, Beijing 100191, China
b Key Laboratory of Assisted Reproduction (Peking University), Ministry of Education, Beijing 100191, China
c Beijing Key Laboratory of Reproductive Endocrinology and Assisted Reproductive Technology, Peking University Third Hospital, Beijing 100191, China
d Academy for Advanced Interdisciplinary Studies, Peking University, Beijing 100871, China
e Peking–Tsinghua Center for Life Sciences, Peking University, Beijing 100871, China
f National Clinical Research Center for Obstetrics and Gynecology, Beijing 100191, China
g Beijing Advanced Innovation Center for Genomics, Beijing 100871, China
h Research Units of Comprehensive Diagnosis and Treatment of Oocyte Maturation Arrest, Beijing 100191, China
1. 引言
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)在全世界蔓延,截至2020年6月29日,全世界报道的确诊病例超过1000万,死亡病例超过50万。血管紧张素转换酶2(angiotensin-converting enzyme 2, ACE2)是一种锌金属肽酶,最早于2000年被发现,其表达水平与心功能、高血压和糖尿病密切相关[1,2]。ACE2被认为是SARSCoV和SARS-CoV-2的受体[3,4],而跨膜丝氨酸蛋白酶2(transmembrane protease serine 2, TMPRSS2)则是一种能够激发SARS-CoV-2刺突蛋白(S蛋白)的丝氨酸蛋白酶[5]。ACE2阳性表达的器官也因此被认为面临着较高的感染风险[6]。ACE2表达于肺泡上皮细胞、小肠上皮细胞[7]、少量的II型肺泡(type II alveolar, AT2)细胞[8]和呼吸道上皮细胞[6]。也有报道称,ACE2在心肌细胞、回肠和食道的上皮细胞、肾近端小管细胞和膀胱尿路上皮细胞中高表达[6]。
母体免疫系统在妊娠期间整体上会转变为免疫抑制状态,以避免对作为同种异体移植物的胎儿发生排斥[9],但这也使母体受各类病毒感染的风险增加[10]。胎盘是阻止病毒的母婴传播的重要屏障之一[11]。有报道称,ACE2阳性表达细胞分布于母胎界面的多种细胞类群中,比如绒毛中的合胞滋养层(syncytiotrophoblast,STB)细胞和细胞滋养层(cytotrophoblast, CTB)细胞,蜕膜中血管外周(decidual perivascular, dP)细胞、蜕膜基质(decidual stromal, dS)细胞、内皮和血管平滑肌细胞[12,13]。在STB中,ACE2能够调控血管紧张素(angiotensin 1-7, Ang 1-7)以释放到母体循环中促进母体血管舒张[12]。既往研究报道,在感染了SARS-CoV或SARS-CoV-2的孕妇所分娩的新生儿中[14–16],以及在感染了SARS-CoV和SARS-CoV-2患者的子宫中均未检出SARS-CoV和SARS-CoV-2 [14,17]。但是最近有两项研究声称,在三例新生儿血液样本中检测到SARSCoV-2特异性的免疫球蛋白M(immunoglobulin M, IgM)[18,19]。因为IgM抗体一般不能通过胎盘传递给胎儿,通常在感染后的3~7 d产生,这提示尽管胎儿体内的病毒检测结果为阴性,但宫内感染的可能性依旧存在。胚胎植入前后在形态和分子水平上经历显著变化[20–22],胚胎受精后6 d(D6)左右从透明带中孵出,并将直接暴露于子宫内膜腔[23],因此植入前后的胚胎受SARSCoV-2侵袭的潜在风险仍有待阐明。
为了更好地了解SARS-CoV-2垂直传播的潜在风险,我们从单细胞转录组水平对植入前后胚胎和母胎界面中ACE2和TMPRSS2的表达模式进行了分析,以期阐明SARS-CoV-2在母胎间宫内垂直传播的可能性与理论基础。
2. 材料和方法
2.1. 数据下载与处理
植入前胚胎数据从已发表的文章[24]中下载,围着床期胚胎数据则从另一篇已发表文章[22]中下载。利用STAR [25]对植入前胚胎的原始数据进行清洗并映射至人类参考基因组参考序列(版本37),表达量采用每百万已映射读段中映射到外显子的每千碱基上的片段数(fragments per kilobase per million, FPKM)进行衡量。围着床期胚胎数据的处理方法则如已发表文章[22]所述。蜕膜细胞和绒毛细胞的Smart-seq2单细胞转录组数据(RNA转录本5′端转换机制——switching mechanism at 5′ end of the RNA transcript-sequencing, SMART)的基因表达矩阵及相关细胞类型注释文件分别从两篇已发表文章[26,27]中下载。人母胎界面的单细胞转录组droplet scRNA-seq数据的原始矩阵和细胞类型注释文件来源于已发表的数据[27]。
2.2. ACE2 和TMPRSS2 基因阳性表达的定义
在Smart-seq2数据集中,将基因表达水平[每百万条已映射读段中的转录本数目(transcripts per kilobase million, TPM)]大于或等于1的细胞定义为阳性表达细胞。在droplet scRNA-seq数据中,计数大于0的细胞定义为阳性表达细胞。
2.3. 差异表达基因计算和基因本体论分析
具有不同ACE2表达水平的细胞类群间的差异表达基因(DEG)是通过“Seurat v3.0”包[28]中的“Find-Markers”函数进行鉴定的,具体参数为:logfc. threshold = log(2)、min.pct = 0.4、test.use =“roc”、only.pos= F。基因本体论(gene ontology, GO)富集分析是利用“clusterProfiler(3.8.1)”包中的“enrichGO”函数进行的[29],具体参数为:ont =“BP”、pvalueCutoff = 0.05、pAdjustMethod =“BH”、qvalueCutoff = 0.1、readable =T。使用R包“VennDiagram(1.6.20)”和“UpSetR(1.3.3)”来展示不同组别的DEG、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路或GO条目之间的相互关系[30,31]。使用R(3.5.2版)进行所有这些分析。
2.4. 胚胎和绒毛性别的鉴定
通过由15个Y染色体特异性表达的基因来确定每个胚胎和绒毛样品的性别,包括:RBMY2FP、RBMY1B、TTTY15、KDM5D、RBMY1J、RBMY1F、RBMY1D、RBMY1E、TSPY4、TSPY2、TSPY8、TSPY1、RPS4Y1、EIF1AY和DDX3Y。我们需要确定整体样本的性别,因此首先计算了单个细胞内Y染色体特异性表达基因的表达水平总和。有85%或以上细胞达到阈值的胚胎将被定义为雄胚[Y染色体(chrY)特异性表达基因水平总和≥ 100]。另外,有65%或以上的细胞达到阈值的绒毛样品将被定义为雄胚[在Smart-seq2样本中总chrY基因表达量≥ 5(TPM),在droplet scRNA-seq的数据中总chrY基因表达量≥ 1]。
2.5. 统计分析
对于箱点图,使用Wilcoxon秩和检验计算两组间的显著性差异。使用Spearman相关系数分析围着床期D6胚胎中ACE2和TMPRSS2表达之间的相关性。
3. 结果
3.1. 围着床期胚胎SARS-CoV-2 感染的潜在风险
我们先前的研究全面绘制了人类植入前和围着床期胚胎在不同发育阶段的转录动态图谱[22,24]。ACE2是SARS-CoV-2的细胞受体,因此为了研究植入前和围着床期胚胎的潜在感染风险,我们根据之前的研究[22,24]进一步分析了卵母细胞和不同发育阶段胚胎中ACE2的表达模式。我们发现,ACE2在植入前胚胎的各个发育阶段均有表达,表达水平在合子期最高,并从4细胞阶段开始急剧下降,直至桑椹胚阶段已基本检测不到,但在囊胚(blastocyst, Bst)阶段其表达水平重新升高[图1(a)]。在围着床期胚胎中,ACE2主要在受精后第6天胚胎的滋养外胚层(day 6 trophectoderm, D6_TE)、第10天胚胎的原始内胚层(day 10 primitive endoderm, D10_PE)和第12天胚胎的原始内胚层(day 12 primitive endoderm, D12_PE)细胞中表达[图1(b)]。由于SARSCoV-2进入细胞还依赖于ACE2和TMPRSS2的共表达[5],因此研究了围着床期胚胎中TMPRSS2的表达。TMPRSS2在TE谱系细胞类群中高表达,并且在D6_TE细胞中的表达水平最高[图1(c)、(d)]。得益于单细胞测序,我们可以了解在不同发育阶段细胞间的异质性。接下来,总结了在各发育阶段,ACE2和TMPRSS2阳性表达细胞(TPM ≥1)的比例。ACE2阳性表达细胞的比例在D6_TE细胞类群中最高(38.9%),而在上胚层细胞类群中,ACE2阳性表达细胞的比例很低。和ACE2表达水平的观察结果一致,D10_PE细胞也具有较高的ACE2阳性表达细胞的比例[图1(e)]。有趣的是,TMPRSS2阳性表达细胞的比例在D6_TE细胞类群中同样是最高的(74.1%),而在上胚层(epiblast, EPI)和PE谱系细胞类群中则相对较低[图1(f)]。我们进一步发现,D6_TE中的ACE2和TMPRSS2共表达细胞的比例在各细胞类群中最高(33.3%)[图1(g)],而且在194个ACE2阳性表达的TE细胞中有166个同时表达了TMPRSS2。在围着床期胚胎中,D6雌胚TE中的ACE2与TMPRSS2表达水平之间的相关性最高[图1(h)]。在92个ACE2阳性表达的D6雌胚TE细胞中,有80个也同时表达TMPRSS2[图1(i)]。以上结果表明,发育第6天的囊胚可能相对易受SARS-CoV-2感染,在围着床期胚胎发育过程中存在SARS-CoV-2感染的潜在风险。
3.2. 母胎界面发生SARS-CoV-2 感染的潜在风险
为了评估胚胎植入后发生SARS-CoV-2垂直传播的潜在风险,我们基于已发表的单细胞转录组数据[26,27]检测了母胎界面上ACE2基因的表达水平。先前的研究详细解析了母胎界面上不同类群细胞的转录特征,本文采用了先前研究中对每一细胞类型的已有定义。ACE2和TMPRSS2基因的表达水平在母胎界面上不同细胞类型间具有高度异质性(见附录A中的图S1和S2)。基于droplet scRNA-seq的数据分析结果显示,孕妇外周血中未检出ACE2阳性表达的细胞类群。ACE2阳性表达细胞占比最大的4类细胞群分别为蜕膜血管周细胞(dP1和dP2,1和2表示不同的细胞亚型)、绒毛中的STB和CTB [分别为10%、5%、9%和5%;图S3(a)和表S1]。基于Smart-seq2数据的进一步分析显示,ACE2阳性表达的蜕膜细胞类型比例最高的是Endo(L)(占所有5个细胞的20%)和dP(占84个细胞的13%)[图2(a)和表S2]。此外,尽管ACE2在各自细胞类群中的占比较低,但是在蜕膜自然杀伤细胞(decidual natural killer, dNK,1%)和蜕膜巨噬细胞(decidual macrophages, dM, 1%)中也存在ACE2阳性表达的细胞(表S2)。在绒毛细胞类群中,整体的ACE2阳性表达细胞的占比为8.5%,而在6类主要绒毛细胞类群中,ACE2阳性表达细胞在STB和CTB中占比最高(STB_8W:41%和CTB_8W:20%)[图2(b)和表S3]。相较于droplet scRNA-seq的数据集的分析结果,此处ACE2阳性表达细胞比例的显著增加,可能是由于更高的测序深度使得表达水平较低的ACE2也能够被检出。值得注意的是,在从妊娠24周的胎盘蜕膜面富集的绒毛外滋养层(EVT_24W)细胞中,ACE2阳性表达的细胞占比达到63%,这要远高于妊娠8周的绒毛外滋养层(EVT_8W, 3%)细胞[图2(b)及表S3]。和ACE2相似,我们同样能够在上述提及的绒毛以及蜕膜的细胞类群中检测到TMPRSS2基因的表达,其中TMPRSS2阳性表达细胞占比最高的细胞类群分别为STB_8W(26%)、EVT_24W(19%)和腺状上皮细胞(Epi, 19%)[图S3(b)~(d)和表S1~S3]。ACE2和TMPRSS2的共表达主要存在于STB_8W和EVT_24W [13%和14%;图2(c)和表S3],而在其他蜕膜细胞类群中并未观察到[图2(d)和表S2]。这表明绒毛中的STB和蜕膜中的EVT均易感染SARS-CoV-2。以上结果表明,由于母胎界面上存在ACE2和TMPRSS2双阳性表达细胞,因此妊娠期内存在发生SARS-CoV-2垂直传播的潜在风险。
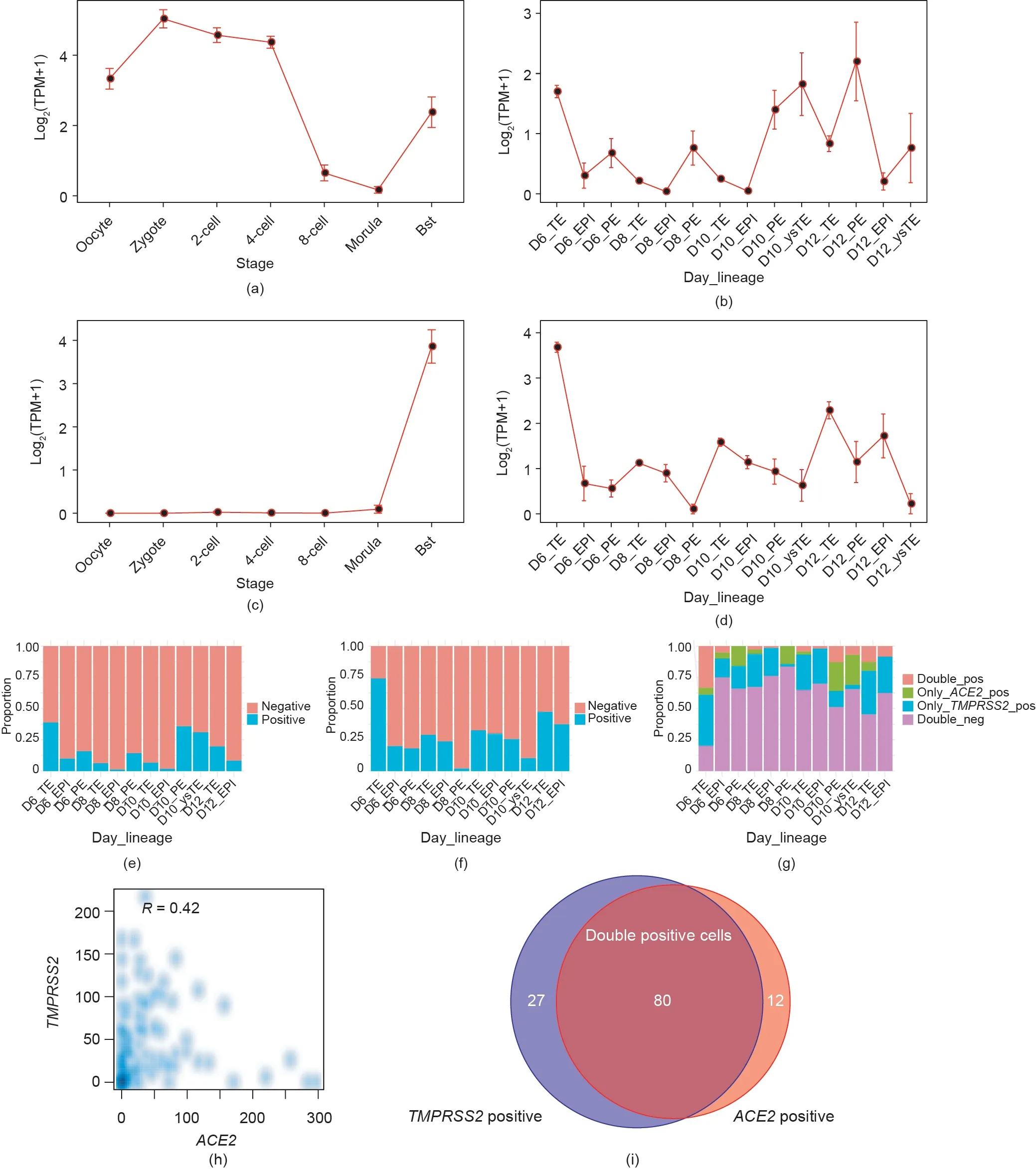
图1. 植入前和围着床期胚胎中ACE2和TMPRSS2的表达模式。(a)不同阶段植入前胚胎中ACE2的表达水平;(b)不同阶段围着床期胚胎中ACE2的表达水平;(c)不同阶段植入前胚胎中TMPRSS2的表达水平;(d)不同阶段围着床期胚胎中TMPRSS2的表达水平;(e)不同阶段围着床期胚胎中ACE2阳性表达和阴性表达细胞的比例;(f)不同阶段围着床期胚胎中TMPRSS2阳性表达和阴性表达细胞的比例;(g)不同阶段围着床期胚胎中具有不同ACE2和TMPRSS2表达模式的细胞比例(double_pos:ACE2和TMPRSS2均为阳性表达的细胞;only_ACE2_pos:ACE2阳性表达但不表达TMPRSS2的细胞;only_TMPRSS2_pos:TMPRSS2阳性表达但不表达ACE2的细胞;double_neg:TMPRSS2和ACE2均为阴性表达的细胞);(h)D6 围着床期胚胎中ACE2和TMPRSS2表达之间的相关性,R表示斯皮尔曼相关系数;(i)D6围着床期期胚胎中ACE2和TMPRSS2阳性表达的细胞数目。Bst:囊胚;ysTE:卵黄囊滋养外胚层细胞。误差线代表平均值±标准误差。

图2. ACE2和TMPRSS2在早期母胎界面的表达模式。(a)不同蜕膜细胞类群中ACE2阳性表达细胞和ACE2阴性表达细胞的比例;(b)不同绒毛细胞类群中ACE2阳性表达细胞和ACE2阴性表达细胞的比例;(c)不同绒毛细胞类群中,在ACE2和TMPRSS2表达水平上存在差异的各细胞亚群的比例;(d)不同的蜕膜细胞类群中,在ACE2和TMPRSS2表达水平上存在差异的各细胞亚群的比例。DC:树突细胞;dM:蜕膜巨噬细胞;dNK:蜕膜自然杀伤细胞;dP:蜕膜血管外周细胞;dS:蜕膜间质细胞;Endo:内皮细胞;Epi:腺状上皮细胞;ILC:固有淋巴细胞;STB:合胞滋养层细胞;CTB:绒毛内细胞滋养层细胞;EVT:绒毛外滋养层细胞;Marc:胎儿巨噬细胞(也称霍夫鲍尔细胞);Mes:间充质细胞;L:淋巴;m:孕妇;p:增殖;CD16也被称为FcγRIII,属于免疫球蛋白超家族(IgSF),CD16+/−表示在免疫荧光染色中呈现CD16阳性或阴性表达的细胞;T细胞:胸腺依赖性淋巴细胞。
3.3. 不同细胞类群中ACE2 阳性表达细胞的共同特征
如同前文所述,D6雌胚的TE细胞、EVT_24W和STB_8W细胞是受SARS-CoV-2感染风险最高的三种细胞类群。为了进一步探究这些细胞类群的特征,我们对这三个细胞类群中ACE2阳性表达和阴性表达细胞亚型之间的DEG进行了GO和KEGG通路富集分析(详细内容见表S4和表S5)。在随后的整合分析中,我们发现不同富集列表中存在共同的DEG、GO和通路条目[图3(a)与图S4(a)、(b)]。GO分析显示,三组表达上调的DEG中均存在“病毒生命周期”(viral life cycle)“利用自噬机制的过程”(utilizing autophagic mechanism)和“膜融合”(membrane fusion)过程富集,其中前两个过程甚至存在于所有的五组富集分析结果中[图3(b)、图S4(c)和图S5]。同时,“鞘脂代谢”(sphingolipid metabolism)是三个上调DEG富集组中共有的KEGG通路,“溶酶体”(lysosome)在5个富集分析组中均存在富集[图3(c)和图S6]。许多研究曾报道,“鞘脂代谢”和“溶酶体”相关机制参与了病毒感染及相关的细胞应答过程[32–35]。这表明ACE2阳性表达和ACE2阴性表达的细胞除了对SARS-CoV-2的易感性不同外,它们对病毒感染的应答状态也可能不同。3类细胞的比较组中存在的与免疫和病毒相关的GO富集条目[图S7(a)],同样支持了我们的这一猜想。而且这些条目中涉及的DEG包含许多已经报道的干扰素应答基因(IFN-stimulated gene,ISG)以及参与炎症和病毒感染防御的基因[图S7(b)~(g)]。此外,EVT_24W或STB_8W细胞类群中的ACE2阳性表达和ACE2阴性表达细胞可能在代谢方面存在差异,因为对应的DEG在相关代谢过程/通路上也存在富集,如“胆固醇代谢过程调控”(regulation of cholesterol metabolic process)的GO条目和“甾体生物合成”(steroid biosynthesis)的KEGG通路[图S4(c)和图S6(a)]。在3类ACE2阳性表达细胞中共有12个表达水平均显著上调的DEG [图3(d)],其中MDK、UGCG和RAB25与炎症反应、细胞增殖、细胞生长和细胞迁移等过程密切相关。综上所述,与ACE2阴性表达的细胞相比,D6雌胚的TE细胞、EVT_24W和STB_8W细胞类群中ACE2阳性表达细胞存在一定的共性差异,这展示了潜在的对SARS-CoV-2易感的早期和后期滋养外胚层谱系细胞在转录水平上的共同特征。
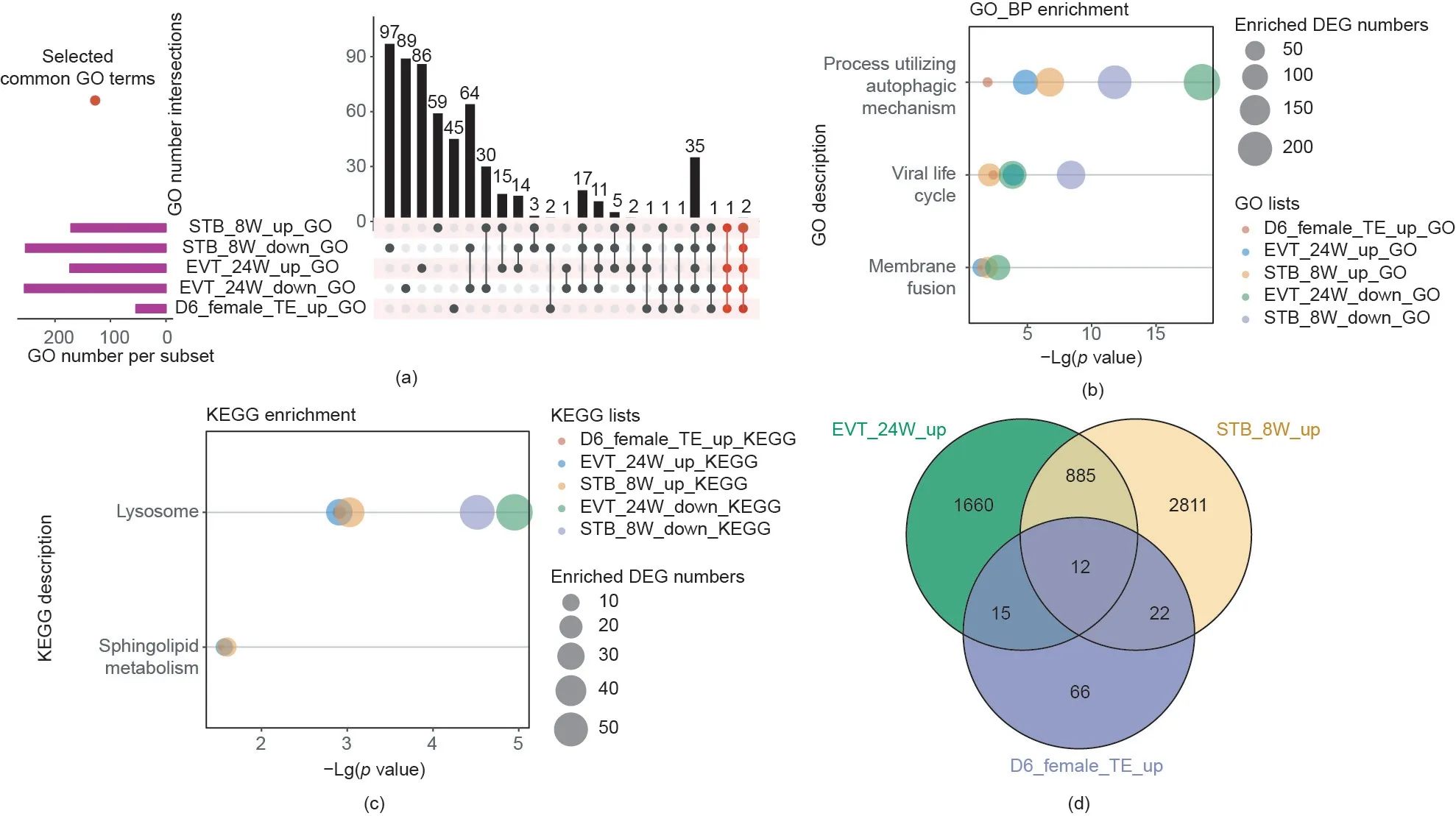
图3. 在D6雌胚TE、EVT_24W和STB_8W细胞中,ACE2阳性表达和ACE2阴性表达细胞亚群间的差异基因和富集的生物学过程/通路。(a)在D6雌胚TE、EVT_24W和STB_8W细胞中,细胞类型特异性或细胞间共有的GO富集条目的数量;(b)在D6雌胚TE、EVT_24W和STB_8W细胞中,表达水平上调的DEG共有的GO富集条目;(c)在D6雌胚TE、EVT_24W和STB_8W细胞中,表达水平上调的DEG共有的KEGG富集通路;(d)在D6雌胚TE、EVT_24W和STB_8W细胞中,表达水平上调的DEG共有的DEG数量。
3.4. 围着床期胚胎和绒毛细胞类群中ACE2 表达的性别差异
由于ACE2基因位于X染色体上,并且是染色体失活的逃逸基因[36],我们推测由于雄胚和雌胚中的X染色体拷贝数不同,ACE2基因的表达水平可能存在差异。通过比较不同性别胚胎,我们发现,在D6雌胚的TE和PE细胞中,ACE2的表达水平较高,但在植入后发育的后期并不高[图4(a)]。除了围着床期胚胎的D12 TE细胞外,TMPRSS2基因表达水平在雄胚与雌胚间并无显著差异[图4(b)]。我们同样比较了ACE2和TMPRSS2基因在后续不同性别的绒毛细胞中的表达水平。在droplet scRNA-seq数据集中,我们鉴定出3个绒毛样本源自雄胚。ACE2的表达水平在ACE2阳性表达的STB和CTB细胞亚群中存在显著的性别差异,但在TMPRSS2阳性表达细胞中,TMPRSS2基因的表达水平并无性别差异[图4(c)、(d)及图S8(a)]。Smart-seq2数据中仅有1例雄胚绒毛样本,在STB_8W和EVT_8W细胞类群中观察到的结果与植入后胚胎的TE细胞相似,并无明显的性别偏差[图S8(b)~(d)]。总之,ACE2表达水平整体上在植入后胚胎中并未显示出性别偏差,但其在D6雌胚的TE和PE细胞中表达水平的升高以及阳性表达的STB和CTB细胞亚群表现出的性别差异,表明D6胚胎以及妊娠期间的不同性别胚胎对SARS-CoV-2的易感性可能存在差异。

图4. 不同性别的围着床期胚胎和绒毛细胞类群中ACE2的表达水平。(a)不同性别的围着床期胚胎的各细胞类群中ACE2的表达情况;(b)不同性别的围着床期胚胎的各细胞类群中TMPRSS2的表达情况;(c)droplet scRNA-seq数据中不同性别绒毛细胞的ACE2阳性表达亚群中ACE2的表达情况;(d)droplet scRNA-seq数据中不同性别绒毛细胞的TMPRSS2阳性表达亚群中TMPRSS2的表达情况。Nor_count:归一化后的片段数;HB:霍夫鲍尔细胞;fFB1:胎儿成纤维细胞类群1。采用Wilcoxon秩和法计算两组间的p值。
4. 讨论
新冠病毒肺炎(COVID-19)大流行对全球公共卫生构成巨大挑战。考虑到SARS-CoV-2感染相关的妊娠并发症及其对子宫内胎儿发育的潜在不良影响,因此需要特别关注妊娠期罹患COVID-19的孕妇患者。SARSCoV-2能否感染胚胎或胎盘,干扰妊娠的建立或维持,以及垂直传播是否存在均是热门话题。在本研究中,我们全面分析了不同发育阶段的植入前后胚胎及母胎界面的单细胞转录组数据,具体阐述了ACE2、TMPRSS2及其他与SARS-CoV-2感染相关的分子的表达特征。我们发现较大比例的D6雌胚的TE、STB_8W和EVT_24W细胞类群中存在ACE2和TMPRSS2的共表达现象。同时我们也在这3类受SARS-CoV-2感染风险最高的细胞类群中观察到了共同的DEG、GO条目和KEGG通路,这表明ACE2阳性表达细胞相较于ACE2阴性表达细胞在“溶酶体”、自噬相关过程以及免疫和病毒相关过程存在较为保守的改变。此外,我们还揭示了ACE2高表达于D6雌胚的TE和PE细胞类群中,并且在ACE2阳性表达的STB细胞中同样呈现出显著的性别差异。总体而言,本研究首次在单细胞转录组水平上展示了ACE2在围着床期胚胎和母胎界面细胞类群中的表达模式,提示了在围着床期和妊娠期存在SARS-CoV-2垂直传播的潜在风险。
ACE2在围着床期胚胎各谱系细胞中存在表达。D6 TE细胞中ACE2阳性表达细胞的比例最高,其他谱系相对较低。TMPRSS2阳性表达细胞的比例和ACE2/TMPRSS2共表达细胞的比例在D6 TE细胞中同样是最高的,这表明发育第6天的胚胎对SARS-CoV-2易感性可能相对较高。然而其他发育阶段的胚胎依然存在ACE2表达,尽管表达水平相对较低,但仍然存在感染的可能性。这同样提示在体外受精-胚胎移植(IVF-ET)过程中存在潜在的SARS-CoV-2感染风险。
在母胎界面中,CTB、STB、EVT和dP细胞类群中的ACE2阳性表达细胞的占比较高,STB_8W和EVT_24W中的ACE2和TMPRSS2共表达细胞的占比最高。正如我们所知,CTB由TE发育而来,进而可分化为STB和EVT。前者被母体血液浸润,后者则侵入子宫螺旋动脉[23,37]。据此前发表的一项研究[38],在来自205名患者的307个血液样本中,检测到三个SARSCoV-2阳性样本,尽管检出率很低。由于STB直接暴露在母体血液中,因此血液中存在的病毒很可能会感染STB。EVT存在于蜕膜与血管壁中,因此也存在较高的感染风险。虽然ACE2阳性表达细胞在EVT_24W中的比例要远高于EVT_8W,但妊娠不同阶段的垂直传播风险是否具有差异仍有待评估。综上所述,这些结果表明了妊娠期间SARS-CoV-2垂直传播的潜在风险。
2013年6月从佛山当地种植的“鸿运金钻蔓绿绒”快速繁殖无性系群体中筛选到10 株变异株,与亲本“鸿运金钻蔓绿绒”相比,颜色更加丰富鲜艳。对1 株变异单株进行组织培养快速繁殖、栽培和育种目标性状稳定性观察,结果表明,突变单株易工厂化繁殖、后代性状稳定,综合性状好,符合育种目标,命名为“鸿福金钻蔓绿绒”(表1)。
虽然尚无直接证据证明SARS-CoV-2的垂直传播,但The Journal of the American Medical Association(JAMA)发表的两项研究报道了3例新生儿存在SARSCoV-2 IgM抗体阳性,这暗示了垂直传播存在的可能性。此外,本研究发现母胎界面存在ACE2和TMPRSS2表达双阳性的细胞,这为妊娠期间发生SARS-CoV-2垂直传播提供了理论上的可能性。如果孕妇在怀孕初期感染了SARS-CoV-2,则应加强对母婴的健康监测。因此,SARS-CoV-2是否存在垂直传播可能会直接影响受感染孕妇的临床治疗方案。本研究希望为孕妇的临床诊疗提供理论依据,而垂直传播的直接证据仍需临床病例的进一步积累和相关基础研究的确认。
我们对3类具有SARS-CoV-2的高感染风险的细胞类群(D6雌胚的TE、EVT_24W和STB_8W细胞类群)中ACE2阳性表达细胞和ACE2阴性表达细胞的差异基因做了进一步分析。我们发现一些病毒相关以及细胞应答相关过程和通路在这3种细胞类群中均存在富集。GO条目:“利用自噬机制的过程”(process utilizing autophagic mechanism)和KEGG通路:“溶酶体”(Lysosome)在全部5个DEG组中均能够观察到。而自噬作为一个“溶酶体”依赖的过程,被认为在维持细胞稳态和抵御病毒感染方面发挥重要作用[39,40]。许多研究表明,病毒在侵袭细胞期间可能会劫持在进化上十分保守的自噬机制以促进感染过程[41,42]。在不同阶段的滋养外胚层细胞谱系中,我们发现ACE2阳性表达和ACE2阴性表达细胞之间存在差异,并且均存在一些涉及自噬过程的变化,从这点上我们认为将自噬过程作为治疗SARS-CoV-2感染策略中的靶标之一是具有一定合理性的[43]。我们还发现这3个细胞类群中的DEG均在免疫和对病毒防御应答相关生物过程中存在富集。在GO条目中,这些富集的生物学过程包含许多ISG。Ziegler等[44]表示ACE2实际上是一个被忽略的ISG,这部分解释了ACE2和这些ISG在3个细胞类群中的协同变化。
X染色体失活(XCI)是平衡雄性(XY)和雌性(XX)X染色体表达剂量的关键表观遗传机制。作为逃逸基因,曾有报道称ACE2显示出性别差异[36]。在本研究中,我们发现D6雌胚的TE细胞中的ACE2表达水平显著高于同阶段的雄胚,但在随后的发育阶段并没有显著差异。STB和CTB中的ACE2阳性表达细胞具有显著的性别差异。这说明在围着床期和妊娠期发生的SARS-CoV-2垂直传播也可能存在性别差异。另外,这一结果表明ACE2可能无法逃逸植入后胚胎发育后期的X染色体失活,这增进了我们对胚胎发育过程中XCI的了解。
5. 结论
虽然在新生儿的血液样本中检测出IgM抗体,但SARS-CoV-2能否通过宫内传播依旧存在争议,急需更确凿的证据进行检验。本研究为围着床期胚胎和妊娠期间SARS-CoV-2垂直传播的可能性提供了理论依据,同时也为在妊娠期或备孕期感染的患者提供了一些参考建议。
致谢
Author contributions
Wei Chen, Peng Yuan and Ming Yang wrote the manuscript. Wei Chen and Peng Yuan performed bioinformatic analysis. Zhiqiang Yan, Siming Kong, Jie Yan, Xixi Liu and Yidong Chen were helpful for the discussion of this study.Jie Qiao and Liying Yan developed the study conception and designs. All the authors have read and approved the final manuscript.
Compliance with ethics guidelines
Wei Chen, Peng Yuan, Ming Yang, Zhiqiang Yan, Siming Kong, Jie Yan, Xixi Liu, Yidong Chen, Jie Qiao, and Liying Yan declare that they have no conflict of interest or financial conflicts to disclose.
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2020.07.013.
