感染新型冠状病毒的2 型糖尿病患者的临床特征和结果——一项回顾性研究
2021-01-25陈滢宇陈剑坤宫晓荣向路叶得伟金英花a张忠德李际强郭姣a
陈滢宇,陈剑坤,宫晓,荣向路,叶得伟,金英花a,,张忠德*,李际强*,郭姣a,,*
a The First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, China
b Guangdong Metabolic Diseases Research Center of Integrated Chinese and Western Medicine & Key Laboratory of Glucolipid Metabolic Disorder, Ministry of Education of China & Key Unit of Modulating Liver to Treat Hyperlipemia SATCM & Guangdong TCM Key Laboratory for Metabolic Diseases, Guangdong Pharmaceutical University, Guangzhou 510006, China
c The Second Clinical College, Guangzhou University of Chinese Medicine, Guangzhou 510120, China
d The Second Affiliated Hospital of Guangzhou University of Chinese Medicine (Guangdong Provincial Hospital of Chinese Medicine), Guangzhou 510120, China
e School of Public Health, Guangdong Pharmaceutical University, Guangzhou 510006, China
1. 引言
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是在近190个国家和地区发生的紧急公共卫生事件,截至2020年4月7日,全球影响了1 279 722例患者,其中72 614例死亡[1]。在大多数情况下,严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-Cov-2)会引起的症状是发热、咳嗽、呼吸急促、疲劳和肌肉疼痛[2]。高分辨率计算机断层扫描(computed tomography, CT)可以准确评估肺部病变,从而使我们能够更好地了解该疾病的发病机制[3]。急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、呼吸衰竭、败血症、急性心脏损伤和心力衰竭已成为COVID-19恶化期间最常见的关键并发症[4]。
越来越多的证据表明,慢性病合并症对COVID-19感染患者的临床结局有显著影响。根据美国卫生与公共服务部疾病控制与预防中心的冠状病毒报告,感染COVID-19的2型糖尿病和代谢综合征患者死亡风险可能高10倍[5]。在来自575家医院的1590名经实验室确认感染COVID-19的住院患者中,有399名(25.1%)报告患有至少一种合并症[6]。COVID-19的最普遍合并症是高血压(16.9%),其次是糖尿病(8.2%)。该报告引起了对COVID-19共存疾病患者的极大关注。在重症患者中发现并存疾病更为普遍[7]。COVID-19患者具有与死亡率相关的潜在危险因素,包括男性、高龄以及存在合并症(包括高血压、糖尿病、心血管疾病和脑血管疾病)[8]。死亡病例中的主要合并症包括高血压、糖尿病、冠心病、脑梗塞和慢性支气管炎[9]。值得注意的是,糖尿病已被证明是与死亡率密切相关的潜在危险因素[10]。
COVID-19给医疗机构带来了沉重负担,尤其是对于合并症患者。大约20%合并多种疾病的COVID-19感染患者需要重症监护,住院治疗的病死率(case fatality rate, CFR)大于13%[11]。在包括儿童、医疗保健提供者和老年人在内的易感人群中应特别注意并努力保护或减少传播[12]。成年COVID-19糖尿病患者的死亡率和重症比例较高,因此在综合治疗COVID-19中,良好的住院血糖控制尤为重要。应根据COVID-19糖尿病患者的具体情况制定个性化的血糖目标和治疗策略[13,14]。
在我们最近的荟萃分析中,包括9项研究中的1936名COVID-19患者,表明COVID-19可能与几种代谢性疾病(高血压、糖尿病和冠心病)显著相关[15]。血糖和脂质代谢紊乱对免疫系统的不利影响使患者更容易受到各种感染的影响。但是,需要更多的证据来证明COVID-19合并糖尿病患者比非糖尿病患者更易恶化。
为了阐明感染COVID-19的糖尿病患者合并症的风险和严重程度,进行了一项回顾性研究,以调查患有或不患有糖尿病的COVID-19患者的临床特征、影像学和实验室检查、并发症、治疗和临床结局。
2. 方法
2.1. 研究设计和数据源
我们纳入了2020年1月12日至3月25日来自湖北省中西医结合医院的208例经实验室确认的COVID-19的住院患者(≥45岁)。COVID-19的诊断依据是世界卫生组织(World Health Organization, WHO)的临时指南。经确认的鼻腔和咽拭子标本的高通量测序或实时逆转录酶聚合酶链反应(reverse-transcriptase polymerase chain reaction, RT-PCR)检测为阳性结果的确诊病例为COVID-19患者。随机选择了96例糖尿病患者和112例非糖尿病患者。
有关近期接触史、临床症状或体征以及入院时实验室检查结果的信息均摘自电子病历。我们根据医学图表中的文档或描述确定了放射学异常的存在。通过与第三位专家协商,解决了两位专家之间的重大分歧。实验室评估包括以下内容:全血细胞计数、血糖、血脂、凝血功能、肝肾功能、电解质、C反应蛋白、降钙素原(procalcitonin, PCT)、乳酸脱氢酶、肌酸激酶、血气分析和炎症因子检测。
根据《中国2型糖尿病预防和控制指南》(2017年版)[16],我们将COVID-19患者分为有糖尿病和没有糖尿病的两组。所有医疗数据均由经验丰富的临床医生团队处理,他们对数据进行了审查和提取。将数据输入计算机数据库并进行检查。如果缺少核心数据,则将核对要求发送给协调员,协调员随后与主治医生联系。
2.2. 实验室确认
SARS-CoV-2的实验室确认是在湖北省中西医结合医院进行的。RT-PCR分析是根据WHO建立的方案进行的。
2.3. 统计分析
分类变量被描述为频率和百分比,连续变量被描述为使用均值、中位数和四分位间距(interquartile range,IQR)值。当数据呈正态分布时,使用独立t检验比较连续变量的均值;否则,使用Mann-WhitneyU检验。数据有限时使用Fisher精确检验,但使用χ2检验比较了类别变量的比例。所有统计分析均使用社会科学统计软件包(Statistical Package for the Social Science, SPSS)13.0版软件(SPSS Inc.)进行。对于未经校正的比较,小于0.05的双向P值被认为具有统计学意义。该分析尚未针对多个比较进行调整,并且鉴于存在I型错误的可能性,应将发现解释为探索性和描述性的。
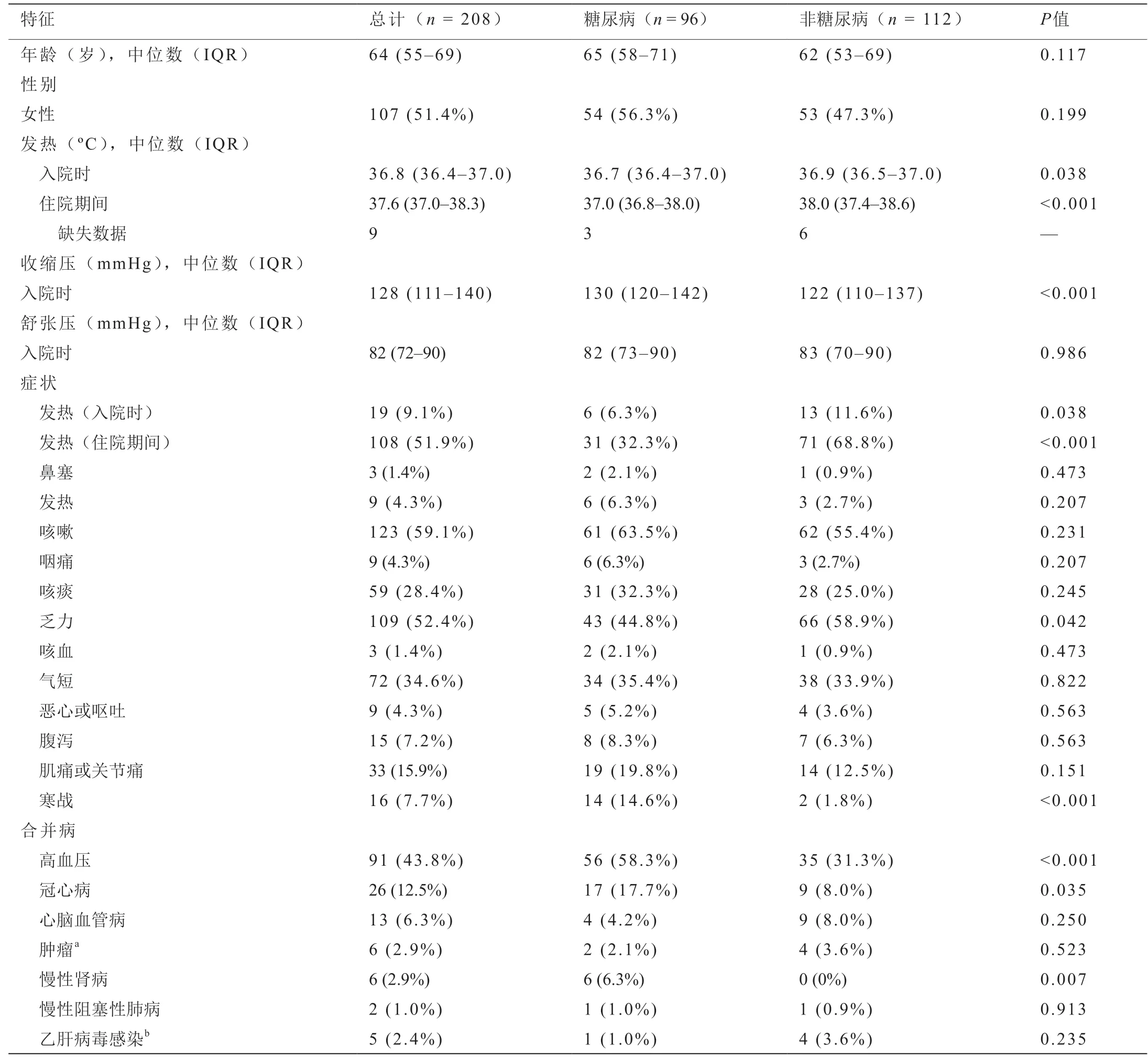
表1 COVID-19患者的临床特征
3. 结果
3.1. 人口统计学和临床特征
如表1所示,入组了96名(46.2%)2型糖尿病患者和112名(53.8%)无糖尿病患者。患者的中位年龄为64岁(IQR: 55~69),女性占51.4%。入院时有9.1%的患者发热(体温≥37.5 ℃),住院期间发热患者的比例为51.9%。最常见的其他症状是咳嗽(59.1%)、疲劳(52.4%)、呼吸急促(34.6%)、痰(28.4%)、肌痛或关节痛(15.9%)、寒战(7.7%)以及腹泻(7.2%)。在总人口中,有66.3%患有至少一种并存的糖脂代谢异常,如糖尿病、高血压、冠心病或脑血管疾病。
入院时和住院期间,糖尿病患者的体温均低于非糖尿病患者[36.7 ℃ (IQR: 36.4~37.0) vs. 36.9 ℃ (IQR:36.5~37.0),P< 0.038; 37.0 ℃ (IQR: 36.8~38.0) vs. 38.0 ℃(IQR: 37.4~38.6),P< 0.001] [17]。这种情况可能归因于糖尿病患者的免疫应答受损。此外,在糖尿病和非糖尿病患者中,疲劳(44.8% vs. 58.9%,P= 0.042)和寒战(14.6% vs. 1.8%,P< 0.001)是最明显的症状。糖尿病患者由于能量代谢紊乱而长期处于疲劳状态,因此感染SARS-CoV-2后,他们可能对疲劳症状的敏感性降低。糖尿病会促进有害的促炎状态[18],并可能导致发冷症状更加明显。
本研究显示糖尿病COVID-19患者与非糖尿病患者合并症的显著差异,包括高血压(58.3% vs. 31.3%,P<0.001)、冠心病(17.7% vs. 8.0%,P= 0.035)和慢性肾脏病(6.3% vs. 0%,P= 0.007)。众所周知,高血压、冠心病和慢性肾病与糖尿病并存,导致COVID-19的发病率和死亡率更高。在糖尿病患者以及相关的糖脂功能异常的患者中,血管紧张素转换酶2(angiotensin-converting enzyme 2, ACE2)受体在肺、肾和肝等多个器官中过表达,这促进了SARS-S蛋白的受体结合结构域与CoV-2细胞受体ACE2结合[19]。有几条证据表明,糖尿病是COVID-19进展和预后的危险因素[17,20]。我们的研究加强了这一假设。尽管如此,两组之间的脑血管疾病、乙型肝炎感染、癌症和慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)的患病率相当。

表2 放射学检查
3.2. 放射学和实验室检查结果
入院时的放射学数据见表2。入院时对201例患者进行CT扫描,有90.4%的结果显示异常。111例无糖尿病的患者中有7例(6.3%)未发现CT异常,而90例糖尿病的90例中有6例(6.7%)未发现CT异常。与非糖尿病患者相比,糖尿病患者最常见的胸部CT表现为磨玻璃片混浊(85.6% vs. 64.9%,P<0.001)和双侧斑片状阴影(76.7% vs. 37.8%,P< 0.001)。这与其他最近的报道一致[2],提示糖尿病COVID-19患者的肺损伤更为严重。
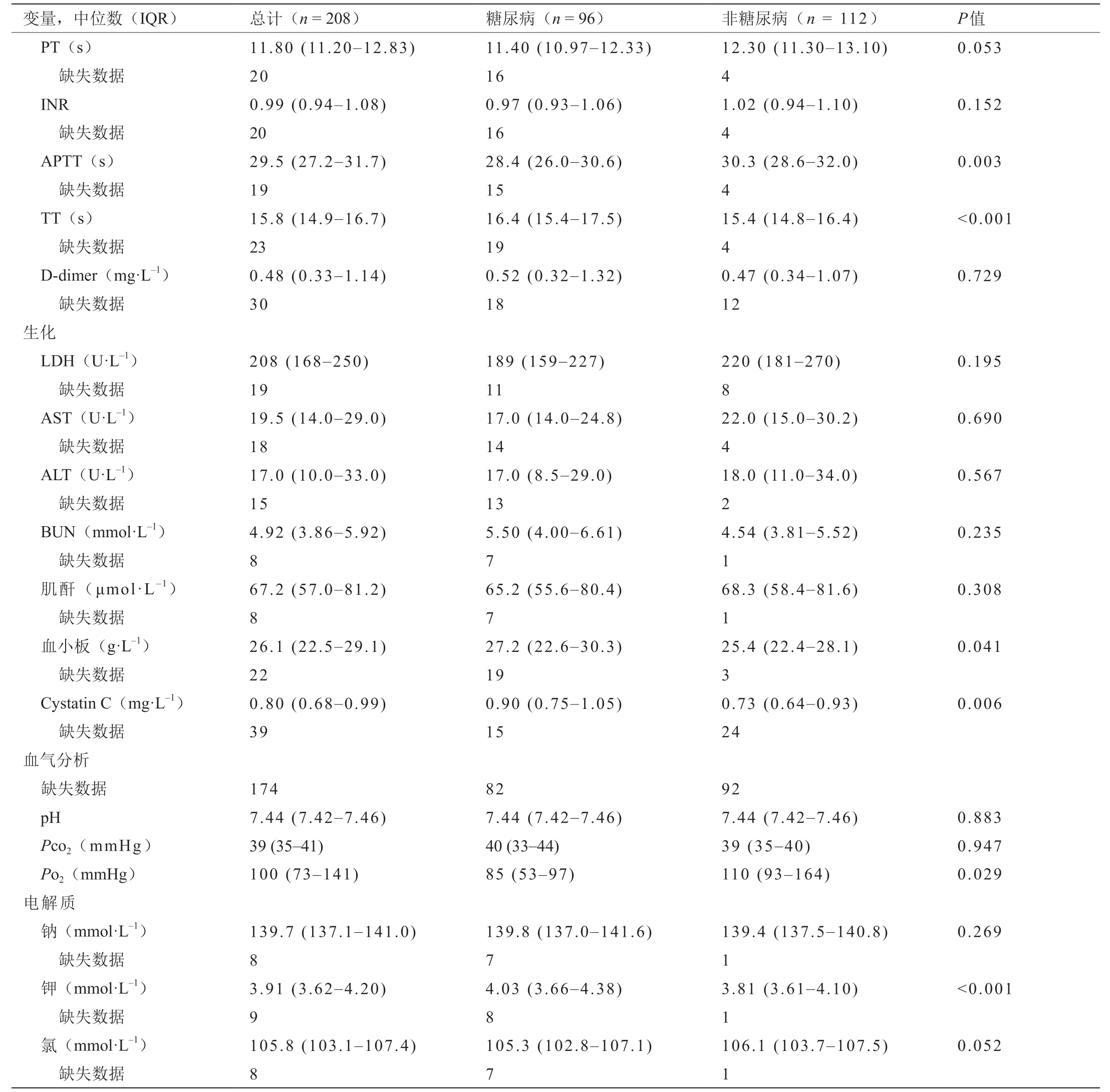
表3显示了入院时的实验室检查结果。血糖[7.23 mmol·L–1(IQR: 5.80~9.29) vs. 5.46 mmol·L–1(IQR:5.00~6.46)]、血液低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)[2.21 mmol·L–1(IQR:1.67~2.76) vs. 1.75 mmol·L–1(IQR: 1.27~2.01)]和收缩压[130 mmHg (IQR: 120~142) vs. 122 mmHg (IQR:110~137),P< 0.001,表1]在糖尿病COVID-19患者中显著高于非糖尿病COVID-19患者(P< 0.001)。该结果表明糖尿病患者的血糖和脂质代谢紊乱。
关于血液学参数,入院时19.7%的患者存在淋巴细胞减少症,血小板减少症占1.4%,白细胞减少症占5.7%。淋巴细胞减少症的存在提示患者感染了病毒。糖尿病和非糖尿病COVID-19组的血液学参数没有差异。
炎症参数红细胞沉降率(erythrocyte sedimentation rate, ESR)(31.7%)和C反应蛋白(21.2%)升高,但是两组COVID-19在有和没有糖尿病的情况下没有差异。两组COVID-19中的促炎细胞因子降钙素(pro-inflammatory cytokines procalcitonin, PCT)、肿瘤坏死因子(tumor necrosis factor, TNF)、白介素(interleukin, IL)等均无差异。
血液生化丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、血液尿素氮(blood urea nitrogen, BUN)、肌酐等均未显示实验室异常,提示肝、肾和肌细胞功能异常较少。免疫参数水平显示相似的阴性结果,尽管免疫球蛋白A(immunoglobulin A, IgA)呈阳性变化。血清IgA在保护黏膜纤毛区域中起着重要作用,并且是抵抗病原体、抗原甚至过敏原的屏障[22]。与没有糖尿病的COVID-19患者相比,COVID-19患者合并糖尿病对免疫状态的影响不同,因为血糖和脂质代谢异常可能会增加免疫反应。
与没有糖尿病的COVID-19组相比,患有糖尿病的COVID-19组有以下变化:D-二聚体[0.52 mg·L–1(IQR:0.32~1.32)与0.47 mg·L–1(IQR: 0.34~1.07),P= 0.729]、激活的部分凝血活酶时间(activated partial thromboplastin time, APTT)[28.4 s (IQR: 26.0~30.6) vs. 30.3 s (IQR:28.6~32.0),P= 0.003]、纤 维 蛋 白 原[2.90 g·L–1(IQR:2.43~4.03)与2.87 g·L–1(IQR: 2.36~3.86),P= 0.045]和凝血酶时间(thrombin time, TT)[16.4 s (IQR: 15.4~17.5)vs. 15.4 s (IQR: 14.8~16.4),P<0.001]。这些发现表明,在临床实践中,患有COVID-19的糖尿病患者更有可能表现出异常的凝血功能。在炎性风暴期间凝血功能异常。在早期,这是炎症激活纤溶酶的结果。随后,低氧诱导的分子可以直接激活凝血酶,并伴有进行性炎症,单核巨噬细胞的激活还分泌许多组织因子,从而激活外源性凝血途径,从而导致整体高凝状态[17]。
(续表)
与非糖尿病患者相比,糖尿病患者的PO2[85 mmHg(IQR: 53~97) vs. 110 mmHg (IQR: 93~164),P= 0.029]和血浆中LDH [189 U·L–1(IQR: 159~227) vs. 220 U·L–1(IQR: 181~270),P= 0.195]低得多。PO2较低表示缺氧,其激活氧化应激和炎症反应,导致以后需要机械通气。血浆中球蛋白[27.2 g·L–1(IQR: 22.6~30.3) vs. 25.4 g·L–1(IQR: 22.4~28.1),P= 0.041]、胱抑素C [0.9 mg·L–1(IQR:0.75~1.05) vs. 0.73 mg·L–1(IQR: 0.64~0.93),P= 0.006]、钾[4.03 mmol·L–1(IQR: 3.66~4.38) vs. 3.81 mmol·L–1(IQR: 3.61~4.10),P< 0.001]水平更高。球蛋白和半胱氨酸蛋白酶抑制剂C水平升高表明存在影响肾功能的损害。慢性肾功能受损可能会减慢钾的代谢,并促进更高的血液水平。
3.3. 临床结果
表4显示208名患者中有18名(8.7%)发生了主要的复合终点事件,其中包括8名(3.8%)进入ICU的患者,8名(3.8%)接受了机械通气的患者(其中1名患者经历了有创和无创机械通气),以及9例(4.3%)死亡。中位住院时间为14 d(IQR: 9~20)。
在96例糖尿病患者中,尽管在糖尿病组和非糖尿病组之间的临床结局中,包括主要复合终点事件(10.4% vs.7.1%,P= 0.402)、中位住院时间(12 d vs. 15 d,P=0.307)、入住ICU的发生率(5.2% vs. 2.8%,P= 0.344)、出院率(84.8% vs. 88.4%,P= 0.397)、死亡率(6.3% vs.2.7%,P= 0.307)和住院率(17.7% vs. 18.8%,P= 0.846)没有统计学意义,但能观察到严重的预后趋势。
3.4. 治疗和并发症
大多数患者(62.9%)接受静脉内抗生素治疗,85.1%接受抗病毒治疗,30.4%接受全身性糖皮质激素,0.6%接受抗真菌药物。机械通气占4.3%,中药治疗占80.4%,针灸治疗占11.3%。与非糖尿病患者相比,更多的糖尿病患者进行非侵入性机械通气(4.2% vs. 1.8%,P= 0.306)(表4)。
在住院期间,一些患者从医生那里被诊断出ARDS(2.0%)、急性肾损伤(1.5%)、败血性休克(1.0%)或心力衰竭(1.0%)。没有患者进入弥散性血管内凝血(disseminated intravascular coagulation, DIC)阶段。
在我们的临床数据中,有17位糖尿病患者(17.7%)接受了糖皮质激素治疗,占所有糖尿病患者的23.9%,有35位非糖尿病患者接受了糖皮质激素治疗,占所有非糖尿病患者的35.0%(P= 0.121)。根据一项回顾性研究,在接受糖皮质激素治疗的患者中,来自COVID-19的ARDS患者的死亡率较低[22]。COVID-19患者可从糖皮质激素治疗中受益,以降低自身免疫性和细胞因子毒性[23]。
在这项回顾性研究中,由于疫情隔离管理,并未对每位使用糖皮质激素治疗的COVID-19患者进行血糖监测。因此,由于临床数据不足,我们无法分析糖皮质激素对有或无糖尿病的COVID-19患者血糖水平的影响。这是研究的局限性。尽管糖皮质激素不可避免地会影响血糖水平,但没有证据表明糖皮质激素的服用会使COVID-19恶化。将来,将进一步研究糖皮质激素对COVID-19糖尿病患者的影响。
4. 结论和观点
这项回顾性研究提供了第一个直接证据,证明COVID-19患者中2型糖尿病、高血压、冠心病和慢性肾病并存的频率很高。这一新发现强有力地支持了我们提出的糖脂代谢疾病(glucolipid metabolic disease,GLMD)的新概念,以及一种用于治疗SARS-CoV-2感染基础的代谢疾病的综合策略[24]。学者们已经认识到血糖和脂质代谢紊乱是各种代谢疾病(包括2型糖尿病、血脂异常、非酒精性脂肪肝疾病、高血压、动脉粥样硬化和心血管并发症)的发生和发展的最初触发因素和强大动力。由于脂质和葡萄糖的代谢在生理和疾病条件下都是高度协调的过程,因此与脂质或葡萄糖的代谢相对应的信号损伤不仅是常见的机制,而且是GLMD发病机理的关键机制[25]。
本研究中的另一个新发现是具有合并症的COVID-19患者的严重程度增强。尽管先前的一些研究报道糖尿病是SARS-CoV-2感染患者中最常见的合并症之一[7,26,27],但糖尿病与COVID-19进展之间密切相关的病理生理后果仍然难以捉摸。我们的分析强调了患有COVID-19感染的糖尿病患者的发病率显著提高。糖尿病COVID-19患者的放射学检查的异常频率和程度显著高于无糖尿病的对照组。另外,在糖尿病COVID-19患者中,对葡萄糖代谢和血压的稳态控制的破坏更为严重。糖尿病及其相关的代谢紊乱一直被证明是感染其他类型冠状病毒,如中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)[28,29]和SARS相关冠状病毒(SARS-associated coronavirus, SARS-CoV)[30]的患者严重预后的关键危险因素之一。因此,我们在本研究中的数据表明,糖尿病及其相关的代谢并发症是导致COVID-19患者发病率和死亡率增加的关键因素。
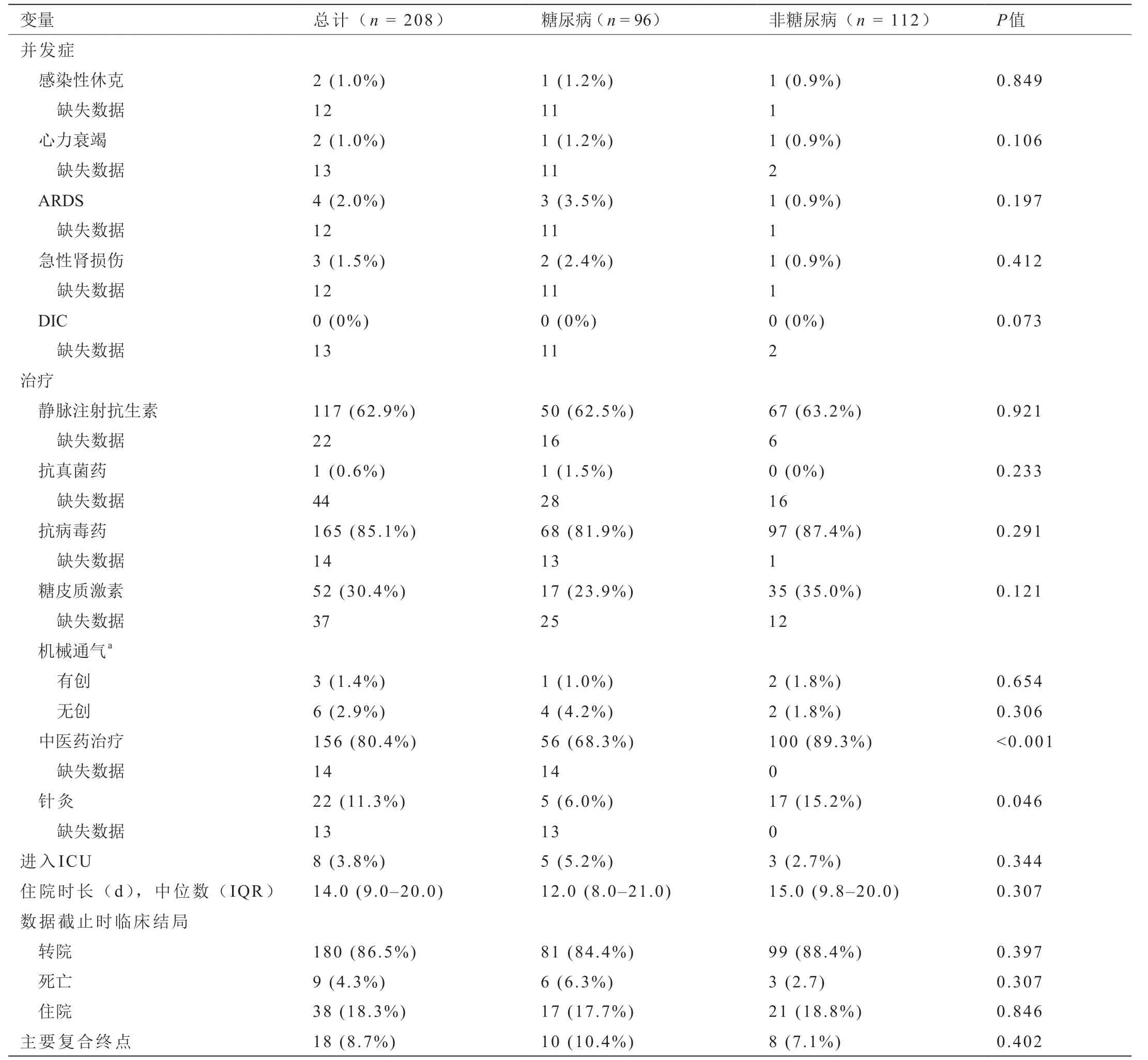
表4 并发症、治疗和临床结果
GLMD的概念构建与COVID-19的临床管理有很大关系。一方面,我们的数据表明在COVID-19患者中必须通过最佳临床管理来维持血糖和脂质代谢中的稳态。另外,冠状病毒家族另一成员(即SARS-CoV)感染的证据表明,SARS-CoV与胰腺中其受体ACE2的结合会导致胰岛损伤和胰岛素释放的显著减少,从而引起短期高血糖,甚至糖尿病的发作[31]。此外,SARS冠状病毒诱发的糖尿病样特征通过正反馈回路显著增强了多器官衰竭的进展。因此,严格控制血糖和脂质代谢的参数集可能是无糖尿病和(或)其他代谢病史的COVID-19患者获得最佳临床结果的关键。另一方面,糖尿病已在世界范围内流行。根据国际糖尿病联合会的估计数据,有4.15亿人患有糖尿病,其中90%的人患有2型糖尿病[32]。因此,应该启动强有力的综合方法来全面预防GLMD,这对于显著降低COVID-19和其他新兴传染病引起的发病率和死亡率具有重要意义。
本研究可能有局限性。首先,这项回顾性研究是针对历史人群进行的,所有已记录的事件均已发生。因此,有关潜在危险因素对COVID-19进程可能具有深远影响的信息可能不会包含在数据库和后续分析中。所以,针对糖尿病及其并发症对临床结果影响的测量将不如前瞻性研究那么准确。其次,样本量相对较小。因此,在本研究中观察到的发现值得在以后的研究中以较大的样本量进一步验证。
总之,在GLMD疾病谱范围内,糖尿病和其他并存的代谢疾病显著提高了COVID-19患者的发病率。因此,这些发现为COVID-19的临床管理提供了至少两个重要信息。首先,血糖和脂质代谢的最佳管理是确保更好的临床结果的关键。其次,对于COVID-19合并GLMD的基础和慢性疾病的患者,应提高临床警惕性。
致谢
作者感谢湖北省中西医结合医院的协助;感谢蔡倩、吴余婉、白晓辉、倪詠诗、郭明凯、朱海丽、严凯旋、杨祎琦、杨桂智、陈智权、马博伟、叶玉珍和林柱坚的数据提取,并感谢兰天对本文的建议。这项工作得到了国家中医药领军人才支持项目、广东省中医药传承工作室、广东省教育厅(2020KZDZX1054)、中国国家重点研究发展计划(2018YFC1704200和2020YFC0845300),以及广东省自然科学基金项目(2018A030313391)的支持。
Compliance with ethics guidelines
Yingyu Chen, Jiankun Chen, Xiao Gong, Xianglu Rong, Dewei Ye, Yinghua Jin, Zhongde Zhang, Jiqiang Li,and Jiao Guo declare that they have no conflict of interest or financial conflicts to disclose.
